医疗器械生物学评价系列标准(GB/T 16886/ISO 10993)是保障医疗器械安全的基础标准,内容涵盖医疗器械生物学评价基本指导原则、各项生物学试验方法、样品制备方法、理化表征方法等,是医疗器械生物学试验、评价、技术审批的重要依据,是医疗器械研发、生产、检验、审评及使用人员进行生物学评价的基本遵循。
医疗器械生物学评价系列标准之现行标准有19个,即将实施的有7个,如下:
现行标准:

即将实施:

生物学评价流程参考:
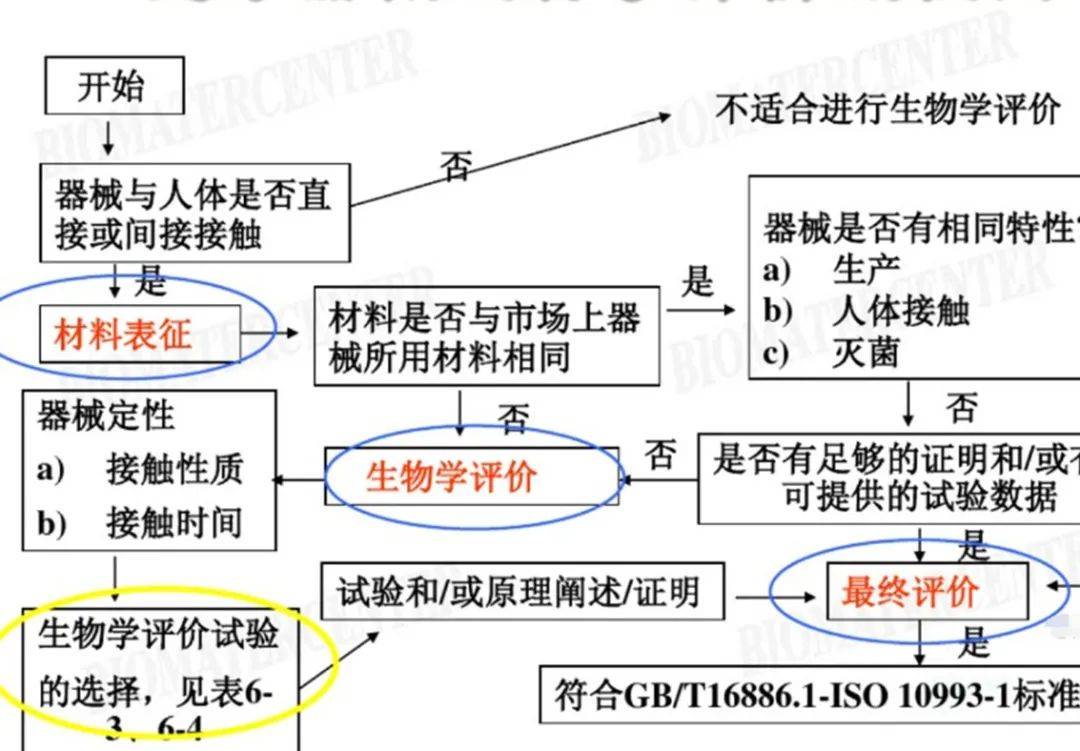
总结:经过几十年的发展,生物学评价已经从最初单纯的试验转变为专业和复杂的研究工作,从简单的产品检测延伸为产品设计开发的输入,从上市前的安全性评价转变为全生命周期的评价。虽然在风险管理中进行生物学评价和试验的理念已经被广泛接受,但在具体的操作过程中以试验代替评价的现象还广泛存在,建议各相关方协同努力,推动医疗器械产业的发展,包括对对新材料、新技术、新工艺的创新产品进行充分、科学生物相容性评价等。







 本文探讨了医疗器械生物学评价系列标准的重要性,其在保障安全中的作用,以及如何从单一试验向全生命周期评价的转变。强调了风险管理中试验与评价的区分,呼吁行业各方共同努力,推动创新产品的科学生物相容性评价。
本文探讨了医疗器械生物学评价系列标准的重要性,其在保障安全中的作用,以及如何从单一试验向全生命周期评价的转变。强调了风险管理中试验与评价的区分,呼吁行业各方共同努力,推动创新产品的科学生物相容性评价。
















 438
438

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








