
这期分享一篇发表在 AACR 的文章,作者综述肿瘤进化作为治疗靶点。
摘 要
分子诊断领域的最新技术进步(包括基于血液的肿瘤基因分型)允许测量癌症患者的克隆进化,从而为精准医学增加了一个新的维度:时间。将这些新知识转化为临床益处意味着重新思考治疗策略。从本质上讲,这意味着不仅要考虑单个致癌基因,还要考虑人类肿瘤的进化性质。在这里,分析了靶向治疗的局限性,并提出了在进化框架内治疗的方法。
在日常医疗实践中,精确的癌症医学依赖于将患者疾病的详细基因组图谱与针对肿瘤特异性改变的药物组合相匹配的可能性。临床对癌基因的阻断是有效的,但只是短暂的,一种监测患者克隆进化并开发随时间进化的疗法的方法可能会改善治疗控制和生存结果。

介 绍
治疗癌症患者的一个主要问题是对治疗的耐药性的发展。这种癌症适应药理学压力的能力可以用肿瘤进化的术语来描述,并且源于其内在的多样性或异质性。肿瘤异质性是指在同一病变内或同一患者的不同病变中存在不同遗传或表观遗传改变的细胞群。肿瘤进化描述了沿时间轴肿瘤异质性的变化,并描述了在环境压力下,具有选择优势的癌细胞亚群以牺牲其他细胞为代价出现的动力学。当癌症承受医疗治疗带来的突然选择压力时,这一过程似乎特别明显。
通过液体活检对血液中肿瘤特异性突变的纵向检测和定量的最新进展,已经允许将克隆进化模式定义为患者癌症的可测量特征。迄今为止,治疗方法是基于二维方式的肿瘤特征,即通过原位组织分析(将疾病描述为特定病变在特定时间点的分子改变的总和);现在,癌症突变的纵向跟踪提供了前所未有的机会来尝试调节肿瘤的进化以达到治疗目的。
这篇综述将讨论测量肿瘤进化作为对治疗反应的读数的相关性,以及利用进化本身来控制癌症的可能性。首先介绍支持测量肿瘤演变的技术方法;然后,将讨论肿瘤进化在耐药性发展中的作用,并提出不同的策略来利用肿瘤的进化性质来造福癌症患者。
监测肿瘤进展的技术
多区域测序
在单个患者中,来自一个或多个肿瘤病变的多个区域的同步样本的比较导致实体肿瘤具有遗传异质性的概念,这已经通过空间分离样本的测序在不同的癌症类型中得到证实。
将达尔文的进化原理转化为癌症发病机制,肿瘤异质性被解释为遗传变异的获得),由遗传不稳定性促进,以及由外部压力、微环境条件和“纯粹”地理因素(中性进化;因此,来自多区域活检的信息可以有效地用于重建肿瘤的进化动力学,以图形形式呈现为肿瘤系统发育树,其中存在于所有肿瘤细胞中的主干或克隆改变代表祖先事件,而异质遗传改变构成分支。然而,对多个但有限的组织样本进行静态准时评估并不足以完全描述肿瘤的空间异质性,也不足以适当描述非稳态生物系统(如肿瘤)的深刻动力学。
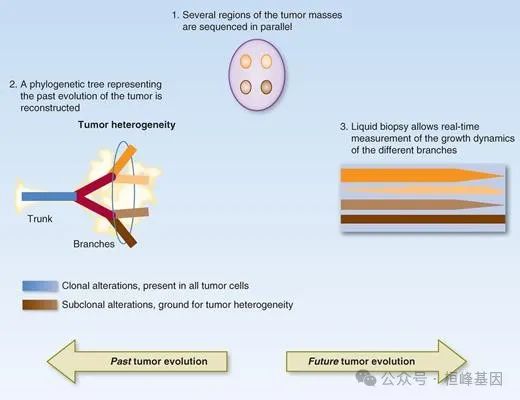
追踪癌症在空间和时间上的演变:多区域活检包括平行分析来自单个肿瘤肿块的不同区域的组织,以及来自同一患者的不同转移性病变(步骤1)。通过评估它们在不同样本中的发生模式,推断个体改变的克隆性。在分析的所有样本中(蓝色)存在的克隆性改变可能代表“祖先”事件,发生在肿瘤发生的早期,因此被表示为肿瘤的系统发育“主干”(步骤2),而异质性(亚克隆)事件(棕色阴影)可能发生较晚,因此代表系统发育树的“分支”。亚克隆改变是肿瘤异质性、治疗适应性和癌症进化的基础。液体活检允许纵向评估不同亚克隆的生长动态,通过交叉比较突变亚克隆等位基因的相对频率和(假定的)主干改变的正常化(步骤3)。
液体活检
由于克隆进化是由肿瘤异质性在空间和时间上的变化(时间异质性)定义的,因此其分析需要实时跟踪肿瘤特异性遗传改变的能力。多区域测序证明,来自地理上定位的肿瘤区域的单一活检不能概括空间异质性的复杂性。此外,与外科手术相关的发病率强烈限制了重复的纵向采样,特别是在接受治疗的转移性疾病患者中,从而限制了对组织活检的依赖,以测量克隆进化。
最近,DNA测序技术的敏感性的提高使得从血浆和其他生物液体(液体活检)。ctDNA的分析是基于对肿瘤特异性改变的识别,这使得其具有高特异性和敏感性,其检出率可与组织活检相媲美。此外,无细胞DNA(cfDNA)的半衰期约为2小时,可以实时监测基因改变的等位基因频率的变化。克隆和亚克隆改变都可以通过液体活检检测到:“系统发育ctDNA跟踪”在早期非小细胞肺癌(NSCLC)患者中有效进行,这些患者接受了多区域活检取样,并通过液体活检纵向监测了一组代表树干和分支突变的单核苷酸变异。这表明手术时从多区域活检分析(关于空间异质性)中获得的信息可以在一定程度上转化为ctDNA分析。
液体活检允许跟踪不同细胞亚克隆的进化(参见图2),并且这被证明在转移性环境中接受靶向治疗的患者的随访中特别有效。在这种情况下,介导对特定靶向药物耐药的改变的相对频率(等位基因分数)的增加已被用于测量难治性肿瘤亚群(分支)的上升(进化)。例如,在西妥昔单抗和帕尼单抗治疗的结直肠腺癌(CRC)中,基于血液检测血浆中KRAS突变变异体水平升高,可以通过成像诊断在复发前识别耐药亚克隆;在相同的环境下,在一些研究中发现了多重KRAS改变和伴随的KRAS和NRAS突变(多克隆耐药)。类似的观察结果在乳腺癌和肺癌患者中也有报道。外显子组测序可以应用于ctDNA来系统地解剖克隆进化,在接受不同治疗方案的乳腺癌、卵巢癌和肺癌患者的长期随访中研究了耐药性的遗传标记。此外,对结直肠癌或乳腺癌患者血液中的ctDNA进行全基因组测序分析,可以检测染色体拷贝数和结构改变。例如在血浆中监测了一名接受曲妥珠单抗治疗的胃癌患者的HER2扩增动态,通过ctDNA分析发现,在一二线EGFR抑制后复发的转移性非小细胞肺癌患者中,EGFR突变和EML4-ALK基因易位共存,支持两种ALK抑制剂的有效治疗。
ctDNA 数量的差异与肿瘤的组织学类型、位置和分期有关,此外,与原发性非小细胞肺癌的坏死和代谢活性有关。与少数髓母细胞瘤、胶质瘤和肾癌、前列腺癌或甲状腺癌的转移性癌患者相比,大多数晚期卵巢癌、肝癌以及胰腺癌、膀胱癌、结肠癌、肺癌、胃癌和乳腺癌患者存在可测量的 ctDNA。晚期疾病患者检测到 ctDNA 水平的比例较高,但在早期阶段显著降低。通过 ctDNA 对结肠癌、乳腺癌和肺癌患者进行微小残留疾病监测已有报道。游离肿瘤 DNA 的扩散也受到人体解剖结构的限制,通过血脑屏障的转运也受到限制。最近的一项研究强调,在脑原发肿瘤和脑转移瘤中,脑脊液比血浆更能提供 ctDNA的信息来源。同样,从胸腔积液和恶性腹水中收集的 cfDNA 可能具有很高的信息性:从高级别浆液性卵巢肿瘤患者的腹膜液中鉴定出 cfDNA 中的TP53突变,并且成功地使用支气管肺泡灌洗液和胸膜液检测晚期 NSCLC 的 EGFR 突变。ctDNA也已从唾液和尿液中分离出来。因此,从多个来源分析可能有助于解剖病变间异质性。然而,尽管多区域组织取样可以剥离空间异质性,但仅用液体活检是不可能的。例如,释放 ctDNA 的突变细胞可能在一个或几个病变中占主导地位,也可能在所有转移部位混合组成较小的群体;在这两种情况下,产生的循环突变等位基因片段可能是相似的。此外,包括病变大小、坏死和血管化在内的因素也可能在循环中释放的突变 DNA 的相对数量中发挥作用。
因此,有效监测肿瘤演变需要临床医生仔细选择组织样本进行活组织检查(具体目的是描述肿瘤的异质性),选择循环DNA检测的时间点,并将分子情景与“标准”技术(如成像诊断和蛋白质标记)获得的信息相结合。包括多种诊断技术来监测治疗期间肿瘤演变的综合研究。
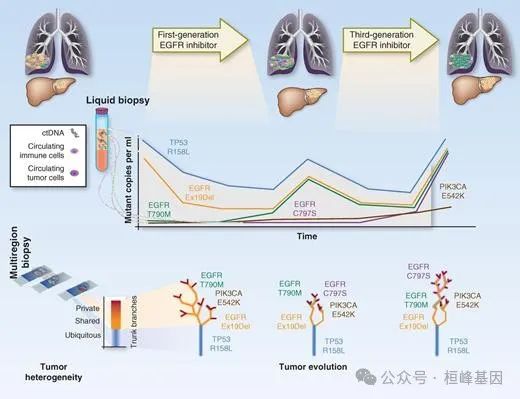
测量癌症治疗对克隆进化影响的诊断方法。肿瘤具有分子异质性。多区域活组织检查提供了这种异质性的快照,允许重建肿瘤系统发育树并识别普遍存在的,共享的或私人的改变。液体活检可以通过 ctDNA 分析实时监测肿瘤异质性在抗癌治疗选择性压力下的变化。亚克隆改变的等位基因频率分析提供了肿瘤内不同细胞群生长动态的测量,而主干改变的量化允许肿瘤负担的正常化。循环肿瘤细胞可以整合 ctDNA 测序获得的生物信息,循环免疫细胞可以帮助描述肿瘤反应性免疫微环境的演变。
肿瘤进化对治疗的反应
对治疗后样本的分析揭示了,尽管靶向治疗的临床疗效得到了无可否认的证明,但除了少数例外,获得性耐药的出现不可避免地限制了这种治疗在总生存期方面取得的进展。同样,肿瘤异质性增加的标记物(进化的底物)与靶向治疗之外的较差结果相关,例如头颈癌、非小细胞肺癌、卵巢癌和慢性淋巴细胞白血病。广泛存在的原发性和新出现的获得性免疫治疗耐药的证据表明,至少一些肿瘤能够适应治疗释放的免疫反应。因此,对治疗的进化适应似乎是癌症的一个标志,而理解和量化这一标志的可能性突出了设计旨在克服疾病复发的癌症治疗方法的必要性。
既存对治疗的耐药性
利用高分辨率测序技术系统识别复发肿瘤中靶向耐药的遗传标记(改变)和预处理样本的可能性表明,小群体的遗传耐药细胞亚克隆通常已经存在于治疗之前,这支持了先前存在群体的克隆选择是获得性靶向治疗耐药的主要机制的观点
例如,在携带激活外显子19缺失或 L858R 突变的肺腺癌中,EGFR 突变 T790M 的出现是对 EGFR 抑制剂厄洛替尼和吉非替尼耐药的最常见机制,预处理样品中 T790M 等位基因的鉴定与较短的无进展生存期相关。同样,在22%对 EGFR 激酶抑制剂产生耐药性的肺标本中也检测到 MET 癌基因扩增,并且在药物暴露前的患者和细胞系中也发现了MET癌基因扩增。在这些肿瘤中,以不同遗传谱为特征的不同系统发育分支的共存解释了不同亚克隆之间的动态平衡如何允许肿瘤逃避专门针对耐药细胞的新一代抑制剂的施用。事实上,在使用奥西替尼(能够克服 T790M 介导耐药的第三代 EGFR 抑制剂之一)治疗的肿瘤中,不仅 EGFR C797S 耐药突变出现在 T790M 阳性克隆中,而且 EGFR 激活改变阳性但缺乏 T790M 突变的肿瘤部分也有所增加。同样,对第三代抑制剂rociletinib的耐药不仅可能由EGFR (L798I, C797S)突变介导,还可能由 MET, PIK3CA, ERRB2 和KRAS 的改变以及 T790M 突变亚克隆的负选择介导。
在抗 EGFR 抗体西妥昔单抗和帕尼单抗治疗的结直肠癌中也有类似的观察结果。在这种情况下,RAS 通路突变和 EGFR 细胞外结构域(ECD)突变是主要的耐药机制。这些突变通常在同一肿瘤中共存,而不同的细胞克隆可能存在不同的 KRAS、NRAS和BRAF 改变。此外,通过液体活检表明,在停药后,对抗 EGFR 药物耐药的结直肠癌患者血液中突变 KRAS 的等位基因频率下降。
新生获得对治疗的继发性耐药
CRC 患者肿瘤生长的数学模型支持这样一种观点,即临床实践中经常出现的多克隆耐药的复杂模式不太可能只是或主要是在药物治疗的短时间内从头开始。然而,尽管在治疗前在患者和细胞系中检测到抗 EGFR 抗体的结直肠癌中存在 RAS 突变克隆,但在 EGFR ECD 突变中未观察到同样的情况,这表明这些变异可能主要起源于治疗时,或者在治疗前以低频率存在,从而逃避了当前测序技术的检测。事实上,在接受吉非替尼治疗的患者来源的肺癌细胞中先前存在的 T790M 突变细胞的早期耐药亚克隆的出现,以及晚期耐药群体的检测;后者在耐药持久性细胞中重新出现 T790M 突变,耐药存在于表观遗传水平。有趣的是,这些细胞似乎对第三代 EGFR 抑制剂不那么敏感。此外对 erlotinib 敏感的 PC9 细胞的一个耐药克隆可以产生多种耐药机制,耐药 PC9 细胞的药物敏感性可以通过抑制 IGF1R 恢复。与 RAS 突变相比,EGFR ECD 突变在 cfDNA 中出现较晚,并且与转移性 CRC 患者更长的无进展生存期相关;这一观察结果与新生获得性耐药的两步进展模型一致。因此,液体活检可能用于识别针对持久性细胞的治疗可能消除耐药性储存库的患者。
一些报道也强调了非遗传的耐药机制参与了对靶向治疗的反应,并可能在克隆进化中发挥重要作用。例如,对西妥昔单抗耐药的 CRC 细胞分泌 TGFβ 和双调节蛋白的增加被证明可以维持邻近的敏感细胞。一项对67例用 MAPK 抑制剂治疗的继发性耐药黑色素瘤的研究显示,39%的病例没有任何有效的突变机制,这表明非基因组适应性耐药。在 T 细胞急性淋巴细胞白血病(ALL)中,发现γ分泌酶抵抗的持久性细胞依赖于染色质调节剂 BRD4 的过表达,而 BRD4 抑制使细胞对治疗重新敏感。NSCLC 对 PD-1 检查点抑制剂的获得性耐药与替代免疫检查点的上调相关,这表明适应性表观遗传进化介导了几种情况下的治疗耐药。事实上,液体活检可能通过测定来自 ctDNA 的甲基化谱和可能通过表征肿瘤来源的外泌体来实现表观遗传标记的有效整合。循环肿瘤细胞的转录分析也提供了信息,如在雄激素抵抗性前列腺癌患者中发现非典型 WNT 信号通路激活。
靶向癌症进化
如果克隆进化最终驱动了对治疗的耐药性,那么通过组织和液体活检来测量它的可能性可能是指导确定最有效的额外治疗线的关键(图2)。在这里讨论了以肿瘤进化调节为终点的策略的基本原理、适用性和可能的限制,其示意图表示在图3。
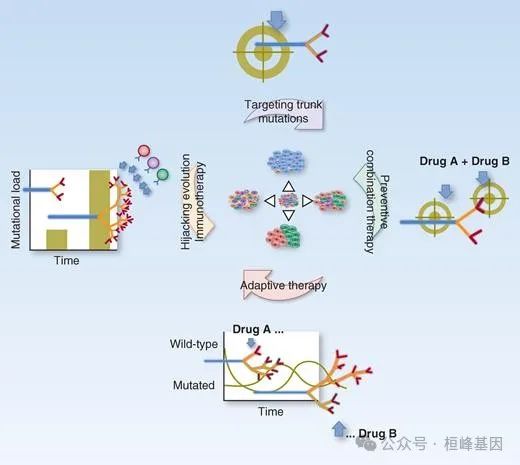
靶向克隆进化的策略。通过液体活检(和多区域活检)测量克隆进化允许选择和整合适当的策略来利用肿瘤进化。可靶向树干改变的识别降低了缺乏靶向改变的克隆分支逃脱的几率。预防性联合治疗可能允许在出现进一步的耐药机制之前消灭耐药细胞。适应性策略,如交替给药假期和针对肿瘤不同分支的治疗,再加上亚克隆生长比的液体活检监测,可以促进克隆竞争并控制肿瘤的整体生长。免疫反应可以被引导对抗进化,要么通过选择和输注肿瘤淋巴细胞特异性的躯干改变,从而能够承受进化,要么通过触发进化来促进免疫反应,通过增加新抗原的数量。
调节基因组不稳定性
肿瘤进化是由基因改变推动的,导致基因组稳定性降低。例子包括失配修复蛋白功能缺失的家族性和散发性结直肠癌,同源重组修复缺失的 BRCA1 和 BRCA2 缺陷乳腺癌和卵巢癌,以及以聚合酶 epsilon 和 delta 对活性受损为特征的超突变肿瘤。最近,APOBEC 家族蛋白的激活被认为增加了一半人类癌症的突变率,并代表了非小细胞肺癌亚克隆多样化的共同原因。
控制基因组稳定性的基因的分子改变的可操作性仅得到部分测试。一个众所周知的例子是使用合成致死方法选择性地杀死同源重组缺陷细胞,PARP 抑制剂在 BRCA 缺陷和 BRCA 样肿瘤中的活性证明了这一点。有趣的是,这种模式表明,超过耐受性阈值的基因组不稳定性增加(通过靶向DNA修复的互补途径)可能导致基因组完整性的破坏,从而导致细胞死亡。
此外,携带错配缺陷的肿瘤对免疫检查点抑制剂表现出极高的应答率和异常持久的应答,因此将突变负担水平与治疗效果相关联。在这方面,遗传不稳定性水平的增加可以在治疗上加以利用,正如在使用替莫唑胺等烷基化剂治疗的患者中报道的诱导微卫星不稳定性(MSI)所提示的那样,这些患者可能进一步受益于免疫检查点封锁。另一方面,为了治疗目的而抑制基因组不稳定性可能会减缓肿瘤的进展。然而,除临床前模型中 p53 缺失外,肿瘤细胞对特异性诱变的依赖性尚未得到证实,APOBEC 抑制的有效性有待进一步验证。我们有理由认为,在疾病负担和肿瘤异质性较低的情况下,这种方法可能最能影响患者的预后,特别是在预防/辅助治疗方面。
靶向克隆突变
由于肿瘤亚克隆的遗传异质性在抗癌药物的选择压力下有利于进化,因此直观地认为,针对所有细胞中存在的截尾改变的药物管理可以更好地增加持久控制疾病的几率。
在这方面,对 FGFR 抑制剂 AZD4547 有反应的胃癌患者携带高水平克隆性 FGFR 扩增的肿瘤。相反,没有反应的肿瘤则是亚克隆或低水平扩增。在一项对120名接受 PI3K/AKT/mTOR 抑制剂治疗的乳腺癌患者的研究中,PIK3CA 克隆突变的肿瘤表现出更好的反应趋势,但这一趋势没有统计学意义;事实上,基于癌症基因组图谱的一项研究,PI3K/mTOR 亚克隆改变在不同肿瘤中的高频率表明,这至少可以部分解释 PI3K 抑制剂在实体恶性肿瘤患者中的一般效果。
因此,了解单个癌症中可操作药物靶点的克隆状态可以帮助设计和实施旨在降低获得性耐药几率的治疗方法。然而,直接靶向克隆改变并不总是可行的:这是肿瘤抑制因子如腺瘤性息肉病大肠(APC)功能丧失的情况。APC 的恢复导致结直肠癌细胞系的细胞凋亡和临床前模型的肿瘤消退。不幸的是,APC 活性的药理学恢复尚未实现。类似地,p53 的恢复在不同肿瘤类型的克隆突变中显著富集,导致原位小鼠肉瘤和淋巴瘤的肿瘤消退;不幸的是,p53与靶向药物的可操作性仍然具有挑战性。
此外,针对单一的躯干致癌变异可能不足以产生长期的益处。这在转移性黑色素瘤的情况下得到了证实,突变的 BRAF 是真正的主要驱动因素,但与达卡巴嗪相比,vemurafenib 治疗只增加了2个月的总生存期。在 BRAF 抑制获得性耐药的患者中,在同一肿瘤或同一患者的多个肿瘤中通常检测到 MAPK 和 PI3K 通路的多个分子病变。同样,在Ph+ ALL中,BCR-ABL 易位是一种主干改变,伊马替尼的复发率很高,尽管初始有效率很高。
组合的方法
多种有效药物的经验关联在很大程度上支持化疗方案在血液病和实体恶性肿瘤中的有效性。从概念上讲,同样的模式可能适用于靶向药物,如致癌信号通路的抑制剂。获得性耐药的数学模型进一步支持药物关联;例如,对胰腺癌、结直肠癌或黑色素瘤患者的研究表明,在转移性癌症中,即使存在有限的肿瘤负荷,靶向药物的单一治疗也不能根除疾病,而双重联合治疗只有在低肿瘤负荷和没有交叉耐药突变的情况下才有成功的希望。因此,可能需要三种或更高阶的联合治疗来获得肿瘤根除,即使是靶向截骨改变的药物;类似地,也需要抑制不同的途径来避免交叉抗性。这种组合方法可能会受到针对多种不同克隆改变和对正常组织毒性的可用治疗方法数量的限制。
免疫疗法靶向主干突变
如前所述,用靶向药物影响多克隆改变受到可药物性和毒性问题的限制。克服这些限制的策略包括靶向克隆新抗原,或通过手术或全身治疗等进化瓶颈选择的显性分支抗原,通过个性化疫苗或过继细胞治疗。通过这些方法靶向多种新抗原的可能性将显著降低耐药性的几率。在2例接受T细胞过继输注的黑色素瘤患者中,后者已被证明与新抗原表达缺失(通过遗传或表观遗传机制)有关。此外,在对 CART-19 输注有反应的ALL患者中,耐药机制涉及获得性突变,但也涉及免疫原性表位的选择性剪接。在这种情况下,液体活检在追踪目标新抗原的动态方面可能特别有效,并且与血液中的T细胞受体测序相结合,可以预测复发的几率。然而,针对克隆性新抗原的T细胞的免疫逃避可以,例如,通过克隆选择携带突变或HLA缺失的肿瘤细胞而产生;最近有报道称,一名转移性结直肠癌患者在过继T细胞转移后复发;IFNγ 通路效应物的改变也可能损害靶向T细胞介导的免疫应答。这表明单独的免疫治疗可能不足以根除肿瘤,可能需要与其他形式的治疗结合肿瘤演变的诊断监测来最大化疗效。
预防性联合疗法
耐药细胞克隆通常在治疗开始时就已经存在(尽管无法检测到),这一观察结果支持了这样一种观点,即在获得性耐药性被公开诊断出来之前,在数量非常少的情况下,早期进行组合治疗有更高的机会根除这种克隆。从头开始联合疗法在预防其他病理情况(如传染病)的耐药性方面特别有效。在这种情况下,药物组合已被证明对快速发展的病原体有效,例如HIV。然而,在肿瘤学中,肿瘤细胞和宿主之间较窄的治疗窗口限制了可以同时组合的药物数量。液体活检测序可以指导基于进化的联合方案,最初旨在降低耐药几率,并进一步利用逃逸机制,在耐药发生时维持肿瘤生长控制。从头开始靶向联合药物可以同时靶向大肿瘤(躯干有活性药物)和预期的继发耐药机制,因此与复发时给药相比,在生存方面具有显著优势。
在慢性髓性白血病中,伊马替尼、达沙替尼和尼洛替尼以及肺癌中,不同代的 EGFR 抑制剂经常出现药物靶点继发性突变介导的获得性耐药,这表明被抑制途径的再激活是一种生物学上有利的机制。同样,一名携带活化 PIK3CA 突变的乳腺癌患者在接受 PI3Kα 抑制剂 BYL719 治疗后复发,其14种不同的转移灶具有不同的 PTEN 基因改变,导致 PTEN 表达趋同性丧失,在相应的患者来源的异种移植物中,通过同时阻断 PI3K p110β, PTEN 表达得以恢复。事实上,观察到通常在抑制致癌驱动因子后,相关数量的逃逸机制聚集在同一途径上,这表明至少在某些肿瘤中,提供垂直抑制主干靶点及其下游效应物的预防性联合治疗可能会降低复发的可能性(即延迟复发)。此外,同步靶向下游耐药参与者不仅代表了一种预防行动,而且还可能导致对大部分肿瘤的细胞毒性作用增加,从而进一步减少肿瘤负担。这也可能限制新生耐药性的储存库。
例如,在 CRC 中,抗 EGFR 抗体治疗的继发性耐药,通过 MAPK 级联干扰信号传导,通常是通过 RAS、MEK和MET 的额外功能获得改变通路的再激活介导的。根据这些观察结果,通过垂直抑制 EGFR 和 MEK (MAPK途径的下游效应物)的 EGFR 敏感结直肠癌模型的联合治疗可以防止耐药的发生,并且正在进行一项在 EGFR 敏感结直肠癌中采用这种方法的临床试验以验证这一假设。同样,据报道,EGFR/MEK 联合抑制可以防止 EGFR 突变肺癌模型中出现耐药性。建立患者获得性耐药模型的平台,用于识别有效的靶向药物组合:细胞系来源于肺癌患者,使其对主要驱动癌基因的单一药物抑制产生抗性,并筛选能够克服耐药性的药物。选定的化合物在小鼠身上进行了试验。值得注意的是,与耐药联合治疗相比,从头开始联合治疗显示出更高的疗效。
这种方法的局限性是患者耐药机制的可变性:BRAF 和 MEK 抑制剂联合使用可增加黑色素瘤患者的生存率(而序贯疗法则没有这样的效果);然而,观察到肿瘤复发。事实上,在对 MAPK 抑制剂失去敏感性的转移性黑色素瘤中,不仅 BRAF、NRAS、KRAS、MEK1或MAP2K1 的改变在复发时富集,而且还激活了不同的逃逸途径,如 PIK3CA、AKT1和AKT3 的功能获得事件和 PIK3R2、DUSP4、CDKN2A、PTEN 的功能丧失事件的证据,以及可能的非基因组改变,如 MET 过表达、β-catenin 和 YAP1 的解除。最近,能够防止发散旁路逃逸机制的组合药物以抗体混合物的形式进行了测试。例如,EGFR 抗体混合物 Sym004 被证明可以克服 CRC 和 pan-HER 中由 EGFR ECD突变介导的西妥昔单抗耐药,靶向 EGFR、HER2和HE。
适应性治疗
存在治疗的细胞特异性适应度也可以被利用来控制肿瘤的进化。抗性可能以适应度为代价,在靶向治疗下表现出生长优势的亚克隆可能在缺乏选择压力的情况下失去其适应度优势。在对西妥昔单抗或帕尼单抗产生耐药性并出现 KRAS 突变细胞群的结直肠癌患者中,通过液体活检评估,中断治疗或使用不同类别的化合物(例如 VEGF 抑制剂)治疗与血浆中 KRAS 突变等位基因分数的减少相关)。在对 BRAF 抑制剂具有耐药性的黑色素瘤患者来源的异种移植瘤模型中,与连续治疗不同,间歇性给药 vemurafenib 可长期控制肿瘤生长,这与对 BRAF 抑制剂具有获得性耐药性的黑色素瘤患者再次挑战时的反应观察一致。
肿瘤进化的数学分析进一步支持了这些观察结果。有或没有治疗的情况下模拟了克隆动力学,表明尽管高剂量方案导致耐药群体迅速扩大(竞争性释放),调节治疗(适应性治疗)允许控制肿瘤生长。这是通过保持药物敏感性肿瘤细胞和耐药细胞之间的平衡来实现的,药物敏感性肿瘤细胞在没有药物的情况下增殖得更好,耐药细胞只有在药物本身存在的情况下才更适合,卵巢癌和乳腺癌异种移植模型就是一个例。
因此,肿瘤克隆之间的竞争可以用于治疗目的。在这种情况下,通过液体活检测量克隆进化可以指导药物假期和再挑战的精确管理(图4)。然而,耐药克隆在治疗前的预先存在表明,尽管速度不同,耐药和药物敏感群体都能够在无药物环境中增殖,从而支持在分子复发时引入顺序治疗策略。从这个角度来看,出现的多克隆多基因耐药机制可以通过液体活检转变为适应性治疗的治疗机会,允许微调肿瘤内克隆竞争的可能性,并通过交替两种(“进化双重束缚”)或更多针对不同肿瘤分支(和耐药机制)的药物。
对高剂量交替治疗方案的补充策略意味着在连续的时间表上减少治疗剂量(达到控制肿瘤生长而不是MTD所需的剂量)(节拍疗法)。在化疗治疗的乳腺癌异种移植物中,节律治疗比全剂量治疗能更好地控制肿瘤生长。在该模型中,间歇给药(即药物假期)未能控制肿瘤生长。事实上,低剂量维持方案早已在临床实践中得到评估;然而,缺乏证据表明通过节拍方法在患者中控制肿瘤进化。在这种情况下,测量肿瘤演变可以为评估复杂方案的疗效提供额外的标准,并可能为实体肿瘤诱导和维持治疗的更有效序列建模。不应低估采用新的临床试验范式实施进化模型,取代目前的治疗方法直至疾病进展的伦理和临床挑战。
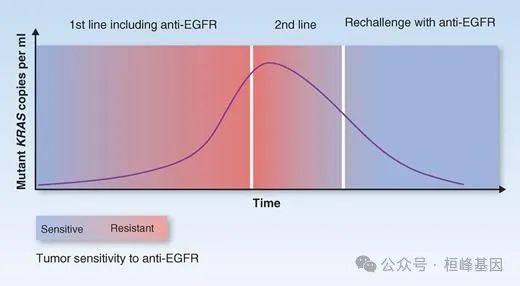
液体活检作为指导适应性治疗方法的工具。在对抗 EGFR 抗体治疗有反应的 CRC 中,KRAS 突变通常作为获得性耐药的机制出现。值得注意的是,当 EGFR 阻断暂停时,ctDNA 中的 KRAS 突变会下降。监测 ctDNA 中 KRAS 突变等位基因的进化可用于设计额外的治疗方案,旨在重新挑战最初对 EGFR 阻断有反应但随后复发的患者。
利用生物标志物和肿瘤演变的实时评估
那么,应该如何指导医疗干预呢?到目前为止,癌症医学一直依赖于预测性生物标志物来帮助选择最有效的治疗方案。癌症平行进化的证据表明,至少部分预测肿瘤进化(即能够预测肿瘤的下一步移动)的影响。即使在基因不同的肿瘤中,肿瘤进化的方式也相对有限。如前所述,明确的选择压力可能导致对共同途径的放松管制。在这方面,在同一患者中,遗传上不同的亚克隆通常通过平行进化具有针对相同基因或途径的遗传改变。
详尽的后续研究将多区域活检与 ctDNA 分析相结合,并通过尸检分析分析肿瘤异质性,将确定肿瘤进化可预测的程度,希望这些研究将通过区分总是克隆的驱动事件与那些经常或很少克隆的驱动事件,提供对癌症“进化规则手册”的全面理解。通过估计分子亚型驱动改变的频率和动态,并可能通过揭示分子谱如何与抗癌治疗压力下的进化模式相关联。
同时,临床和临床前研究测试同时靶向大肿瘤的药物组合的疗效和耐药机制将提供有价值的信息,以确定从头开始给药的关联。例如,西妥昔单抗耐药 CRC 患者中,抗 EGFR 抗体帕尼单抗和 MEK 抑制剂曲美替尼联合使用对 MEK 突变的转移性病变有效(但对 KRAS 突变的克隆无效。另一项结合功能分析和组织基因分型的研究显示,MET 扩增使 BRAF 突变的结直肠癌患者对帕尼单抗和 vemurafenib 联合耐药。在同一例患者中,vemurafenib 与双 ALK/MET 抑制剂 crizotinib 联合使用即使是暂时的,也能够克服耐药性;有趣的是,这一选择得到了 BRAF 突变细胞系的药理学分析的支持,该细胞系对 BRAF 抑制产生抗性,并显示出新的 MET 扩增。同样仅对患者样本进行测序并不足以预测有效的组合,这表明患者衍生的化身也可以用于功能性地定义患者特异性药物关联。
对特定进化模式的进一步临床前洞察可以指出引导肿瘤进化向更有利或更可靶向的分子背景发展的方法,例如肺癌中的 T790M 突变,使耐药克隆对第三代抑制剂敏感,或 CRC 中的 EGFR ECD 突变,这是寡克隆抗体 MM-151 有效靶向的。通过靶向与“不需要的”基因型相关的特定表型,可以实现肿瘤进化的导向。例如,最近报道的 KRAS 突变克隆对线粒体代谢的依赖性增加和对脱氢抗坏血酸摄取的依赖性增加,可以用来降低 KRAS 介导的耐药性出现的几率。液体活检的纵向分析可以使患者实时监测所需表型的出现。
重要的是要强调几个技术问题,如查询空间和时间异质性的能力,目前限制了我们预测肿瘤演变的能力。此外,每个肿瘤都是独特的,即使只考虑遗传改变,随机事件可能构成预测耐药特定机制的内在障碍。临床实施液体活检可以提供肿瘤演变的实时评估,从而允许医生采取适当的治疗措施并选择最佳策略来利用患者肿瘤的演变。多个参数,如对靶向治疗的敏感性/耐药性的特定标记物,以及对免疫治疗反应的代理,可以同时进行评估,并可能与标准的基于成像的参数一起作为治疗成功的终点。
未来发展方向
通过多区域测序和液体活检对肿瘤进化的研究为我们理解肿瘤的形成过程和肿瘤逃避治疗的机制提供了新的思路。技术进步和测序成本的降低可能会促进这些领域的进展。单细胞分析可以支持多区域活检的临床应用,即使在有限的样本材料下,也可以提供肿瘤异质性的高分辨率读数。降低测序成本和增加标准化平台的可及性将进一步促进液体活检在临床实践中的实施。此外,靶向治疗耐药的表观遗传驱动因素的证据,以及对肿瘤(微)环境评估的需要,以便对其他类型的治疗(如免疫治疗)的反应进行随访,要求开发利用 ctDNA 的新方法。从外泌体或循环肿瘤细胞中提取肿瘤 RNA 的转录分析可以扩大我们识别和靶向肿瘤进化的非遗传驱动因素的能力,需要进一步的研究来评估这些方法的价值。T细胞受体的遗传分析正被用于追踪T淋巴细胞对肿瘤进化本身的“进化”。因此,通过多区域活检和液体活检来识别肿瘤进展模式可能会为个体患者的癌症演变和肿瘤微环境背景提供新的治疗策略。临床试验的设计将液体活检驱动的治疗决策与标准算法进行比较,这将是促进该领域进展的关键。
Reference
Amirouchene-Angelozzi N, Swanton C, Bardelli A. Tumor Evolution as a Therapeutic Target. Cancer Discov. 2017 Jul 20. doi: 10.1158/2159-8290.CD-17-0343. Epub ahead of print. PMID: 28729406.
第二期线上直播肿瘤克隆进化生信分析培训课程报名啦!
克隆进化生信分析教程
我们在桓峰基因公众号也推出克隆进化分析教程,从组织到单细胞的克隆进化分析都有介绍,供大家参考:
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








