今天给同学们分享一篇生信文章“Prediction of prognosis, immunogenicity and efficacy of immunotherapy based on glutamine metabolism in lung adenocarcinoma”,这篇文章发表在Front Immunol期刊上,影响因子为7.3。

结果解读:
LUAD中与谷氨酰胺代谢相关基因的遗传变异景观
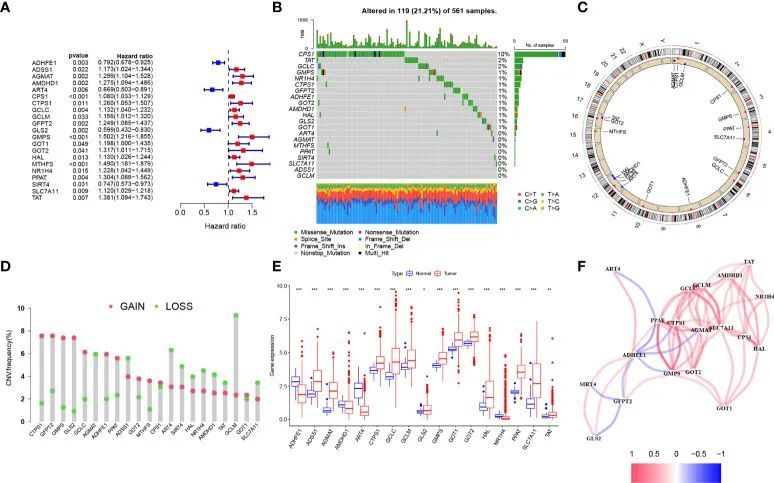
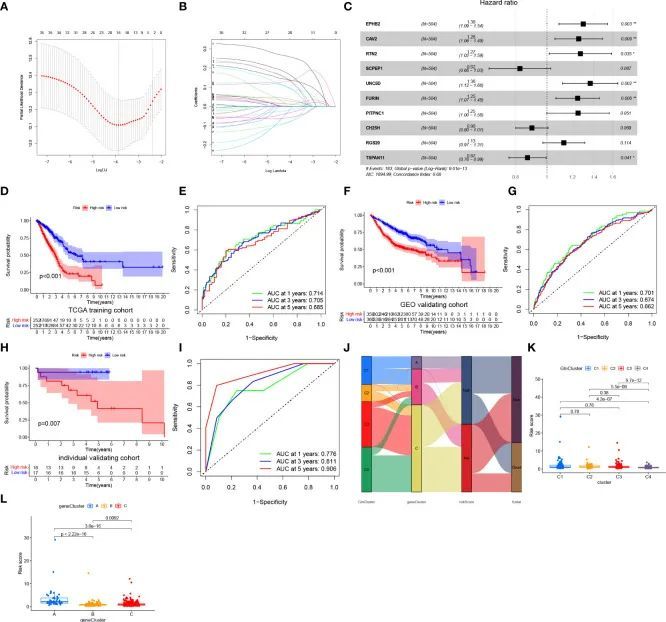
作者研究的整体设计如流程图所示(图1)。从MSigDB和已发表的文章中鉴定出了73个谷氨酰胺代谢基因。基于单变量Cox回归分析,选择了21个与生存相关的谷氨酰胺代谢基因进行进一步分析(图2A)。绘制了瀑布图以显示这21个基因的体细胞突变情况,其中CPS1的体细胞突变率最高(图2B)。染色体上拷贝数变异(CNV)的位置显示在图2C中。CNV扩增和缺失的频率显示在图2D中。差异表达分析显示,在肿瘤中有13个基因显著上调,而有4个基因下调(图2E)。相关网络显示了这21个与生存相关基因之间的表达相关性(图2F)。
独特GlnClusters的建设
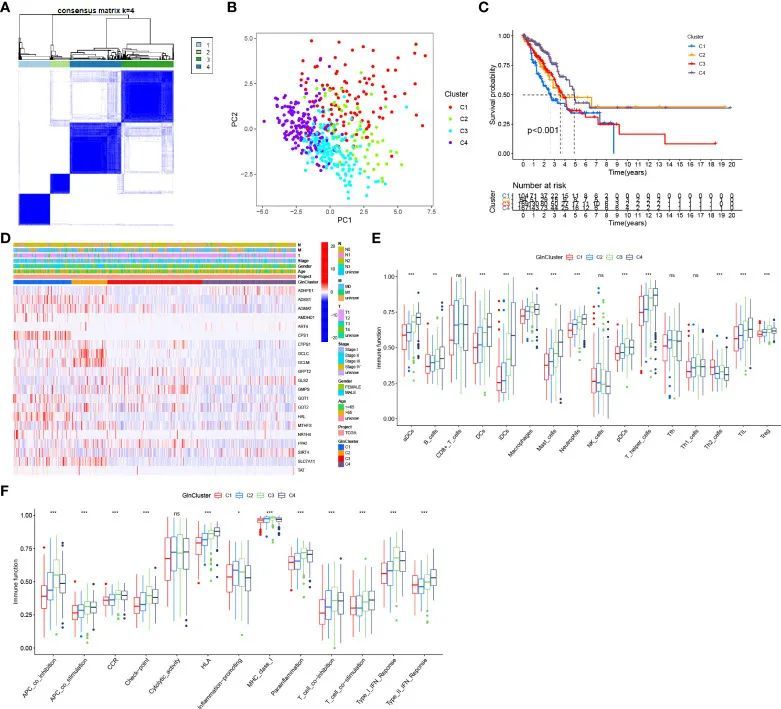
基于与生存相关的谷氨酰胺代谢基因,从TCGA中选择了513名LUAD患者,将其分为4个不同的模式,定义为GlnClusters(图3A)。主成分分析显示了4个亚型之间谷氨酰胺代谢基因的显著差异(图3B)。生存分析显示C4亚型患者的预后改善,而C1亚型患者的总体生存率较差(图3C)。大部分谷氨酰胺代谢基因在C1和C2亚型中显著上调,其次是C3亚型,表明相对活跃的谷氨酰胺代谢。相反,C4亚型显示谷氨酰胺代谢减少,谷氨酰胺代谢相关基因普遍表达低(图3D)。
基于差异表达基因(DEGs)的基因亚型构建
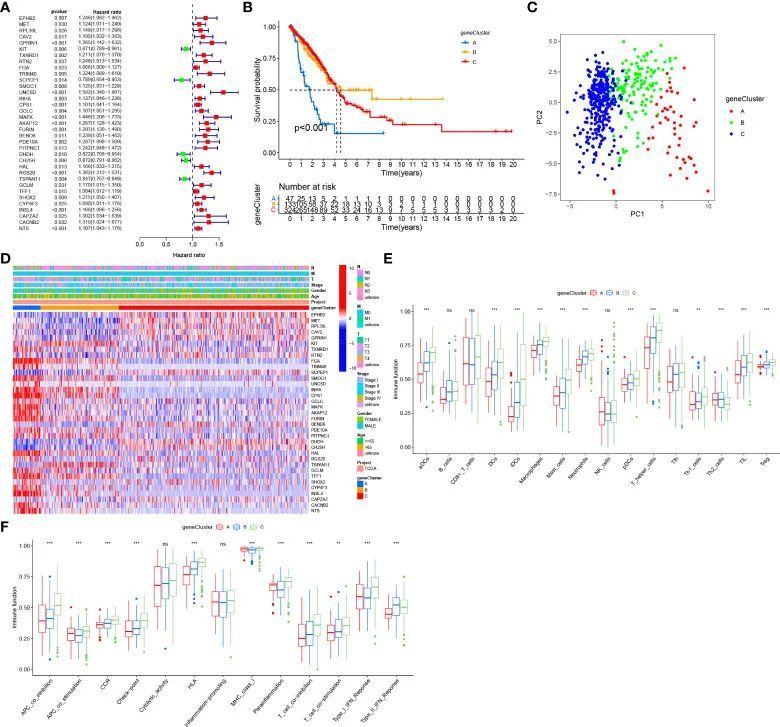
筛选出了4个GlnClusters中的237个差异表达基因(P值<0.001,|logFC|>1),并与GEO验证队列进行了交集分析。对这些差异表达基因进行了单变量Cox回归分析,鉴定出了35个与生存相关的差异表达基因,用于进一步分析(图4A)。基于这35个差异表达基因,将513名患者分为3个基因亚型。与基因亚型B和C相比,基因亚型A表现出明显的生存劣势(图4B)。PCA分析显示不同基因亚型之间在维度上存在明显差异(图4C)。热图显示了不同基因亚型之间差异表达基因的显著差异,大多数差异表达基因在基因亚型A中上调表达(图4D)。与生存劣势相对应,基因亚型A还表现出大多数浸润免疫细胞和免疫功能的较低丰度(图4E,F)。总之,基因亚型A可以被定义为免疫“冷”表型。
风险模型
为了构建一个更方便的临床预测评分模型,作者对确定的35个与生存相关的差异表达基因和18个与谷氨酰胺代谢相关的基因进行了Lasso回归分析,基于最小偏差似然值(图5A)。随后,作者根据赤池信息准则(AIC)值对这18个基因进行了多元Cox回归分析,最终得到了10个与谷氨酰胺代谢相关的基因,包括EPHB2、CAV2、RTN2、SCPEP1、UNC5D、FURIN、PITPNC1、CH25H、RGS20和TSPAN11(图5B)。根据多元Cox回归分析的结果,作者构建了一个风险模型,其公式为:
Coefi和Expi分别表示风险系数和基因表达
根据训练队列中风险评分的中位数,将来自训练(TCGA)和验证(整合GEO)队列的LUAD患者分为低风险组和高风险组。热图显示低风险组中谷氨酰胺代谢相关基因丰度较高,表明谷氨酰胺代谢活化(图5C)。Kaplan-Meier生存曲线显示训练(图5D)和验证队列(图5F)中低风险组患者与高风险组患者相比具有显著的生存优势。对于预测1年、3年和5年生存时间,TCGA训练队列的ROC曲线下面积(AUC)分别为0.714、0.705和0.685,GEO验证队列的AUC分别为0.701、0.674和0.662,显示了该模型在预测LUAD患者总体生存方面的出色表现(图5E、G)。此外,使用山东省医院的33名LUAD患者组成的独立验证队列对风险模型进行验证。一致地,低风险组患者显示出明显的生存优势,与高风险组相比(图5H)。ROC曲线显示风险评分在预测预后方面表现出色(图5I)。图5J展示了在四个GlnClusters、三个geneClusters和两个风险组中被诊断为LUAD的患者的分布情况。与GlnClusters C1、C2和C3相比,GlnCluster C4的患者风险评分显著较低(图5K)。geneCluster A的患者风险评分最高,而geneCluster B的患者风险评分最低(图5L)。
TMB和药物敏感性分析
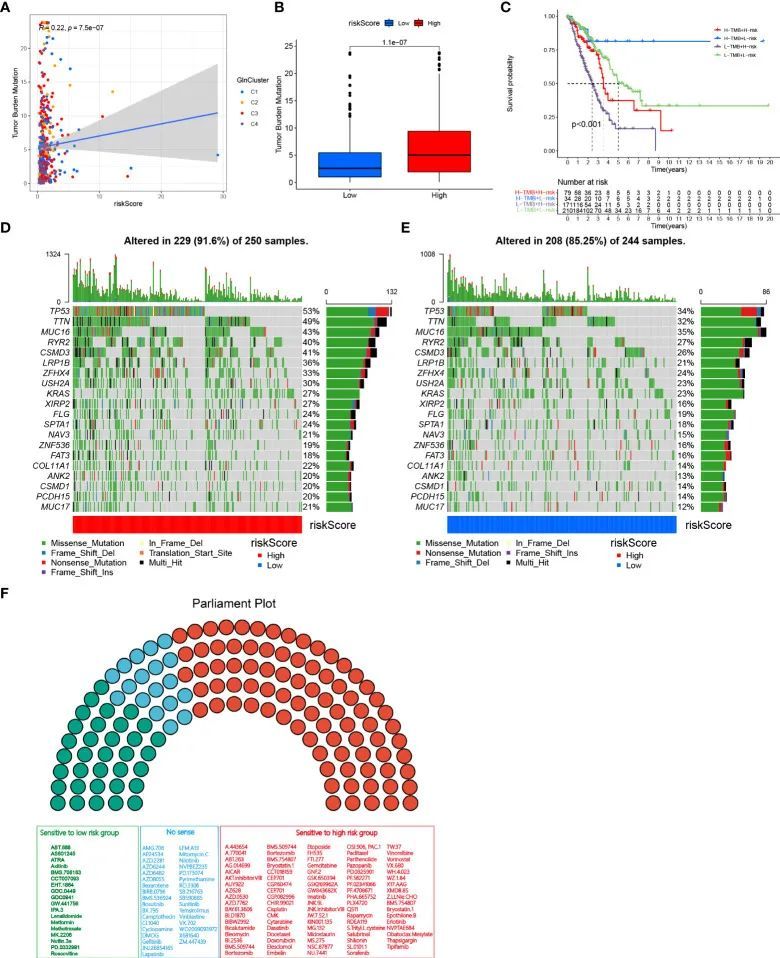
为了研究风险评分与TMB之间的相关性,进行了Spearman相关性分析,并发现风险评分与TMB之间存在显著正相关(R = 0.22,P < 0.001,图6A)。高风险组患者的TMB水平高于低风险组(图6B)。在整合TMB评分后,TCGA中的LUAD患者被分为四组。生存分析显示,TMB高且风险低的患者具有显著的生存优势,其次是TMB高且风险低的组和TMB低且风险高的组,依次排列。TMB低且风险高的组显示显著的生存劣势(图6C)。在TCGA-LUAD队列中,研究了低风险组和高风险组之间体细胞突变的分布变化。高风险组患者的体细胞突变频率明显高于低风险组患者,尤其是在TP53(53% vs 34%)、TTN(49% vs 32%)、MUC16(43% vs 35%)、RYR2(40% vs 27%)、CSMD3(41% vs 26%)和LRP1B(36% vs 21%)方面(图6D、E)。作者进一步进行了药物敏感性分析,预测了136种化疗药物的IC 50 (图6F)。作者的结果显示,84种药物在高风险组中的IC 50 值较低,表明敏感性较高。相反,低风险组的患者对18种药物敏感。综上所述,这些结果为LUAD患者的治疗分层提供了参考标准。
谷氨酰胺代谢的分布和风险评分
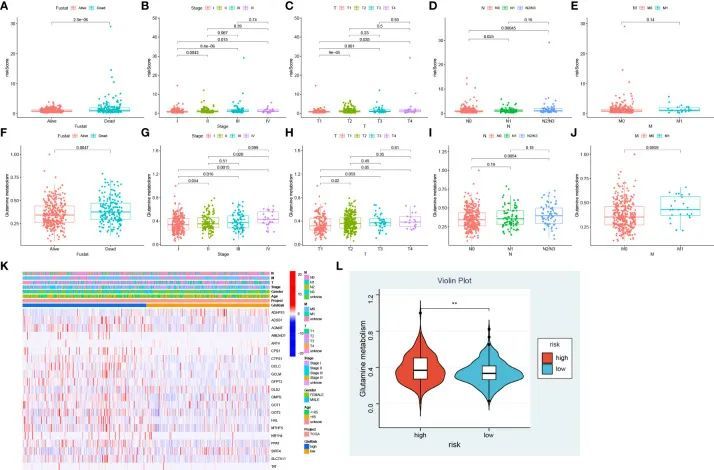
为了确定风险评分与临床特征之间的相关性,作者评估了基于生存状态、分期和TNM分期的不同亚组之间的风险评分差异。与其他组相比,存活、I期、T1期和N0期的患者风险评分较低,而M期的风险评分没有差异(图7A-E)。为了进一步研究谷氨酰胺代谢的分布情况,作者进行了ssGSEA计算,基于73个已鉴定的谷氨酰胺相关基因计算了谷氨酰胺代谢的值。与风险评分类似,死亡患者的谷氨酰胺代谢水平较高(图7F)。此外,谷氨酰胺代谢水平与T、N和M分期显著正相关,分期越高,谷氨酰胺代谢水平越高(图7G-J)。接下来,作者分析了低风险组和高风险组之间的谷氨酰胺代谢差异。热图显示高风险组中预后相关的谷氨酰胺代谢相关基因显著上调(图7K)。一致地,风险评分较高的患者显示较高水平的谷氨酰胺代谢(图7L)。总之,谷氨酰胺代谢和风险评分之间存在显著相关性,并且两者都与肺腺癌的恶性进展呈正相关。
TME的评估和高风险和低风险群体中免疫疗法疗效的预测
为了进一步研究功能特征,作者对两组进行了GSVA富集分析(图8A)。结果显示,低风险组中胆汁酸代谢显著上调。相反,低风险组中KRAS信号通路被抑制。此外,高风险组中激活了多种致癌通路,暗示可能与谷氨酰胺代谢呈正相关,如TGF-β信号通路、缺氧、糖酵解、上皮间质转化、PI3K-AKT-MTOR信号通路、DNA修复、MYC信号通路和E2F靶点。

为了进一步探索风险评分与肿瘤微环境(TME)之间的相关性,作者分析了免疫浸润细胞和免疫功能的差异丰度,以描绘TME的景观。在低风险组中,参与抗原呈递、处理和肿瘤杀伤的各种免疫细胞的丰度水平较高,例如aDCs、B细胞、DCs、iDCs、NK细胞、T辅助细胞、Th1细胞和TIL(图8B)。相应地,低风险组还显示了抗原识别、处理和呈递的活跃信号以及抗肿瘤效应,包括APC共刺激、HLA、T细胞共刺激和II型干扰素反应(图8C)。此外,低风险组显示了免疫检查点的高表达,表明可能从免疫检查点抑制剂(ICI)治疗中获益。风险评分还与其他致癌途径呈正相关,如核苷酸切除修复、DNA损伤修复、错配修复和DNA复制(图8D)。低风险评分还与高免疫评分和ESTIMATE评分显著相关,表明浸润免疫细胞的丰度增加(图8E)。总结一下,低风险组可以被定义为“热”免疫表型,与高度浸润的抗肿瘤免疫细胞和上调的抗肿瘤途径相关。
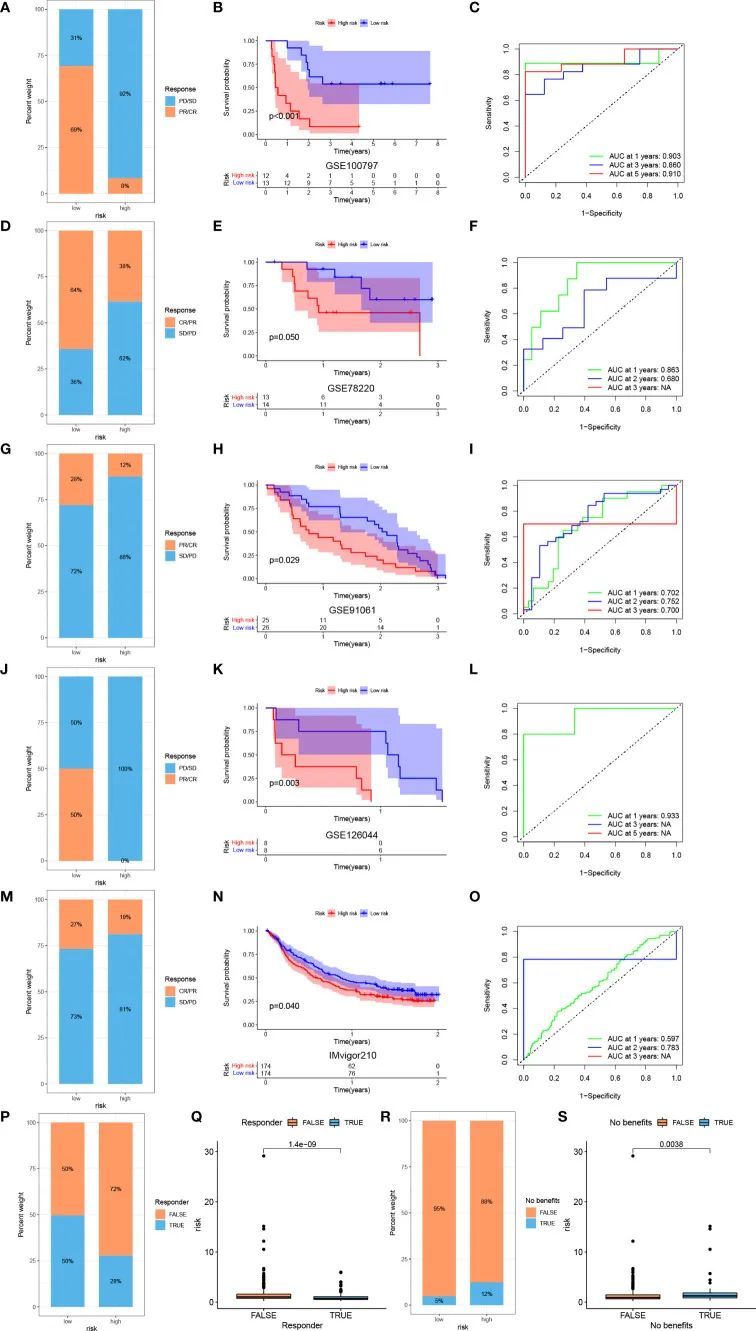
为了进一步研究免疫治疗的风险评分与疗效之间的相关性,作者计算了TIDE评分。低风险患者表现出更高水平的T细胞功能障碍,T细胞排斥和TIDE评分水平较低(图 8F)。作者进一步评估了每个基因的表达与几种免疫治疗相关特征之间的关系,包括T细胞功能障碍、ICB反应结果、遗传筛选中的表型和促进T细胞排斥的细胞类型(图 8G)。与高危组相比,低风险组的患者也表现出更高的IPS,这表明低风险评分的患者对免疫疗法更敏感(图 8H–K)。为了充分验证风险评分在预测免疫疗法疗效方面的准确性,使用已发表文献中的多个独立免疫疗法队列来验证免疫疗法的疗效和预后。采用过继性T细胞疗法(ACT)治疗的黑色素瘤(图 9A-C),用抗PD-1抗体pembrolizumab治疗的黑色素瘤(图 9D–F),用抗CTLA4和抗-PD1治疗的黑色素瘤(图 9G–I),用nivolumab或pembrolizumab(一种抗PD-1抗体)治疗的NSCLC(图 9J–L),用atezolizumab(一种抗PD-L1抗体)治疗的晚期尿路上皮癌症(图 9M–O)用于验证风险评分在预测免疫治疗预后和疗效方面的性能。低风险评分的患者对免疫疗法更敏感(图 9A,D,G,J,M)。此外,与高危组相比,低风险组的患者具有显著的生存优势(图 9B、E、H、K、N),并使用ROC曲线测试预测性能(图 9C,F,I,L,O)。使用TIDE网站基于TCGA队列计算抗PD1和抗CTLA4治疗的反应(图 9P–S)。低风险组的患者被确定为免疫疗法的应答者(图 9P、Q)。相比之下,高危组的患者从抗PD1和抗CTLA4免疫疗法中获益的可能性较小(图 9R、S)。
泛癌症风险评分的预测验证
为了进一步验证风险评分在预测其他肿瘤预后方面的表现,作者对TCGA中除LUAD外的32种肿瘤中的高风险组和低风险组患者进行了生存分析(图10A)。低风险组患者在22种肿瘤中具有显著的生存优势,包括膀胱尿路上皮癌(BCLA,p = 0.001)、宫颈鳞状细胞癌和子宫颈腺癌(CESC,p = 0.004)、胆管癌(CHOL,p = 0.017)、结肠腺癌(COAD,p = 0.001)、淋巴组织肿瘤弥漫性大B细胞淋巴瘤(DLBC,p = 0.02)、胶质母细胞瘤(GBM,p = 0.003)、头颈部鳞状细胞癌(HNSC,p < 0.001)、肾透明细胞癌(KIRC,p < 0.001)、肾乳头状细胞癌(KIRP,p < 0.001)、急性髓系白血病(AML,p = 0.007)、脑低级别胶质瘤(LGG,p < 0.001)、肝细胞癌(LIHC,p < 0.001)、间皮瘤(MESO,p = 0.005)、胰腺腺癌(PAAD,p < 0.001)、嗜铬细胞瘤(PCPG,p = 0.013)、肉瘤(SARC,p = 0.002)、皮肤切除性黑素瘤(SKCM,p < 0.001)、甲状腺癌(THCA,p = 0.003)、胸腺瘤(THYM,p = 0.022),子宫体内膜癌(UCEC,p < 0.001),子宫肉瘤(UCS,p = 0.017)和葡萄膜黑色素瘤(UVM,p < 0.001)。进行了ROC曲线评估全癌风险评分的预后表现。AUC值见图10B。
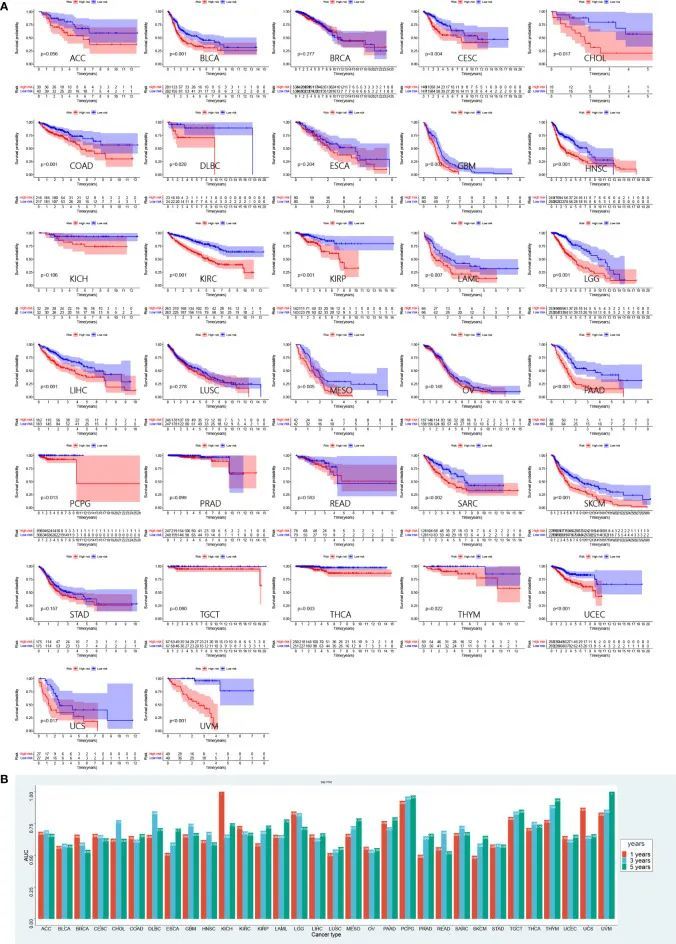
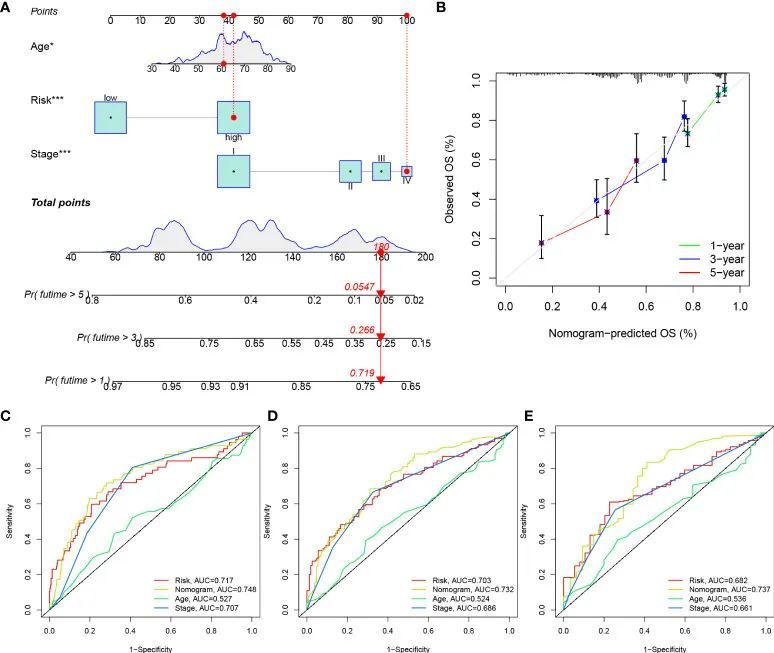
开发一个预测生存率的图表
考虑到风险评分在预测LUAD患者OS方面的不便,作者开发了一个预测1年、3年和5年OS率的Nomogram,将风险评分、年龄和临床病理参数整合在一起(图11A)。构建的Nomogram在TCGA-LUAD队列中的表现与理想模型相当(图11B)。作者进一步构建了ROC曲线来评估Nomogram、风险、分期和年龄在预测1年、3年和5年OS方面的表现(图11C-E)。Nomogram始终显示出最佳的预测1年、3年和5年OS率的表现,其次是风险和分期。
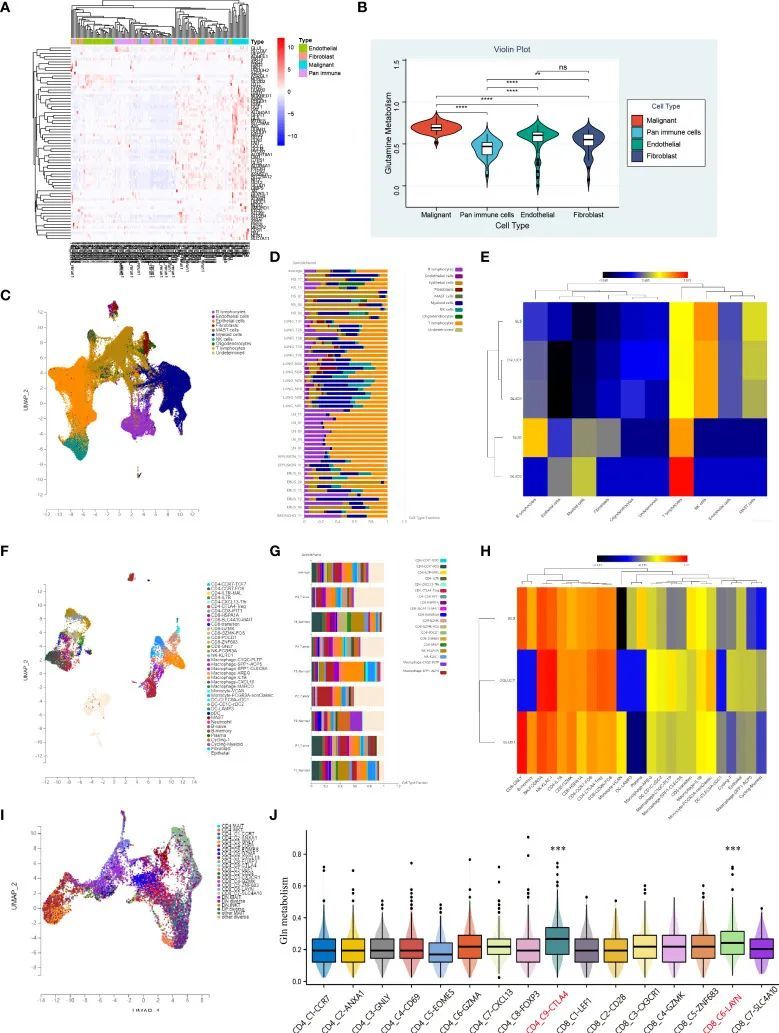
单细胞水谷氨酰胺代谢分析
为了研究LUAD中不同细胞类型的谷氨酰胺代谢活性差异,作者对肺癌的公共单细胞测序数据进行了深入分析。作者开发了一个热图来展示构成TME的四种主要细胞类型(包括流式分选的恶性细胞、内皮细胞、免疫细胞和成纤维细胞)中与谷氨酰胺代谢相关的基因表达情况(图12A)。谷氨酰胺代谢相关基因在恶性细胞中最显著上调,其次是成纤维细胞,而免疫细胞的谷氨酰胺代谢表达最低(图12A)。ssGSEA显示恶性细胞中谷氨酰胺代谢水平最高,浸润的免疫细胞中谷氨酰胺代谢活性最低(图12B)。
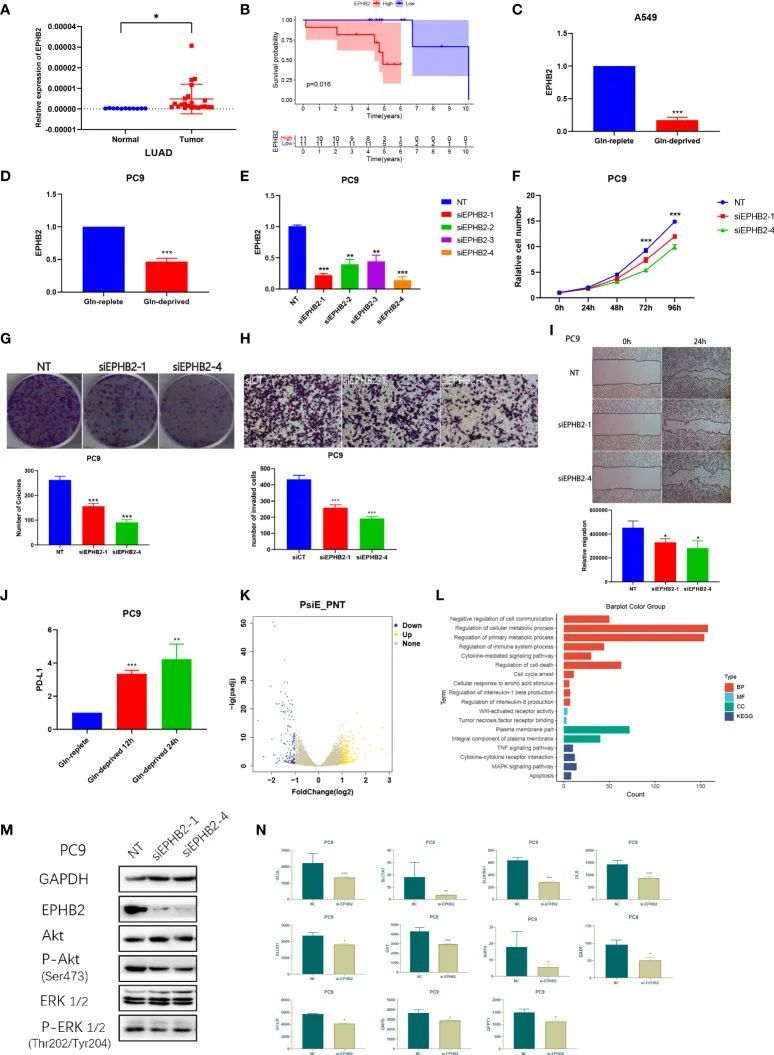
EPHB2影响体外LUAD细胞的生物行为
作者对10个基因在全癌风险评分中进行了差异表达分析。在这10个基因中,EPHB2在所有癌症的正常细胞和肿瘤细胞之间显示出最显著的差异,并且在肿瘤中明显过表达。然而,EPHB2在LUAD中的生物学作用鲜为人知。随后,作者进行了一系列实验来阐明EPHB2在LUAD中的作用。
检测了22个LUAD标本和11个正常标本中EPHB2的表达情况,发现EPHB2在LUAD标本中高度表达(图13A)。与EPHB2低表达组相比,EPHB2高表达患者的总体生存率较差(图13B)。
EPHB2对TME中浸润的免疫细胞的影响
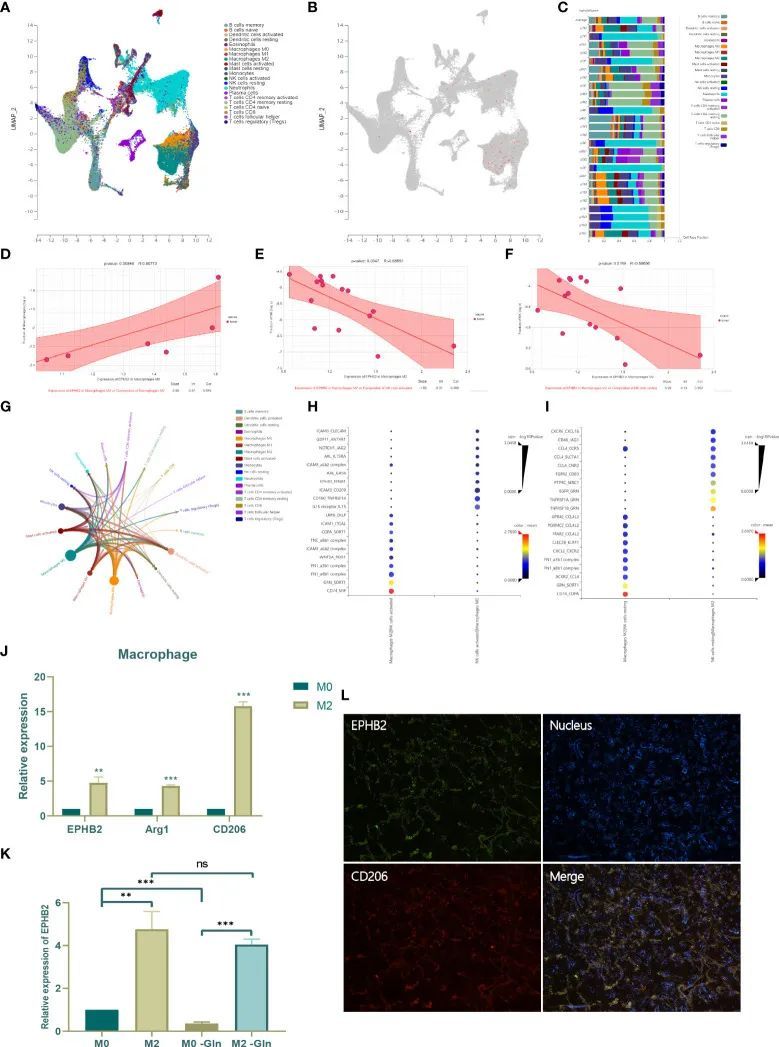
为了研究EPHB2在免疫细胞中的表达和作用,作者选择了NSCLCs的单细胞测序数据(GSE127465)进行进一步的聚类和定义,使用Uniform Manifold Approximation and Projection (UMAP)算法将53215个细胞分为21种类型(图14A)。发现EPHB2主要富集在M0和M2巨噬细胞中,尤其是在M2巨噬细胞中,表明EPHB2可能主要在巨噬细胞中发挥作用(图14B)。每个样本的细胞类型比例如图14C所示,其中M2占据了最高比例。作者进一步分析了M0/M2中EPHB2表达与浸润免疫细胞组成之间的相关性。发现EPHB2在M0巨噬细胞中的表达与浸润的M2巨噬细胞的丰度显著正相关,这表明EPHB2可能参与M2巨噬细胞的极化(图14D)。此外,EPHB2在M2巨噬细胞中的表达与活化的NK细胞和静止的NK细胞的丰度呈负相关(图14E,F)。这些结果表明EPHB2可能与M2巨噬细胞和NK细胞之间的细胞通讯有关。浸润免疫细胞的相互作用网络显示,M2巨噬细胞与其他免疫细胞之间的相互作用最为广泛(图14G)。M2巨噬细胞与活化的NK细胞之间的配体-受体相互作用如图14H所示。同样,作者还研究了M2巨噬细胞与静息的NK细胞之间的配体-受体相互作用(图14I)。为了验证EPHB2在M0和M2巨噬细胞中的分布,作者将THP-1细胞诱导为M0和M2巨噬细胞,并通过qPCR检测EPHB2的表达(图14J)。与M0巨噬细胞相比,M2巨噬细胞显示出EPHB2的显著上调,伴随着M2标记物的显著上调。作者进一步使用缺乏谷氨酰胺的培养基培养M0和M2巨噬细胞,并发现谷氨酰胺剥夺显著下调了M0巨噬细胞中的EPHB2表达,但对M2巨噬细胞的表达没有影响(图14K)。此外,作者还发现EPHB2与LUAD组织中M2巨噬细胞标记物CD206显著共表达,通过免疫荧光显示(图14L)。这些结果表明EPHB2在巨噬细胞中也起着重要作用。
总结
总之,基于Gln代谢的调节因子,作者最终构建了一个Gln代谢相关风险模型,以准确预测LUAD甚至多种癌症患者的预后以及多种免疫疗法的疗效。此外,作者在单细胞水平上描述了TME中细胞的Gln代谢。最后,模型中的一种Gln代谢相关分子EPHB2被证明可以促进LUAD细胞的恶性进展,并在M2巨噬细胞中发挥重要作用。






















 261
261











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










