蛋白组学研究的重要性已毋庸置疑,但很多老师在组学技术的选择、样本准备及数据分析等方面仍然存在很多疑问。本文小易总结了一些蛋白质组学的常见问题供大家参考,赶紧学习收藏吧!
Q1 蛋白组研究的常用手段有哪些?
根据目的的不同,蛋白组研究的常用技术手段也有较大差异。
1)双向电泳技术(理想目的:将细胞(或组织)内所有蛋白质都分离开来);
2)质谱技术及一系列派生技术 (测蛋白质序列);
3)蛋白质互相作用研究:酵母双杂交,细菌双杂交,免疫共沉淀技术,pull-down,FRET,BiFC等;
4)蛋白质定位:荧光标记技术,共聚焦荧光显微镜技术,免疫荧光,免疫化学等技术。
其中,通量最高,结果转化最快,应用范围最广的技术手段要数质谱技术及一系列派生技术,通过质谱平台,可以对样本中的蛋白进行定性和定量分析,明确不同生长条件,不同生理状态,不同样本之间的蛋白表达差异。
Q2 质谱实现定性定量的原理?
蛋白经酶切后会形成多肽,多肽在质谱的离子源位置会带上正电荷,成为一级母离子飞进质谱的质量检测器,质量检测器输出一级谱图;接下来母离子还会在碰撞池的位置进行氨基酸的依次断键,再进入检测器,输出二级谱,经过与数据库生成的理论谱图匹配,可以判断肽段的氨基酸组成,然后再根据肽段反推出蛋白。一级和二级谱的峰值,根据定量原理的不同,均可以作为蛋白定量的依据。
Q3 蛋白组学技术该如何选择?
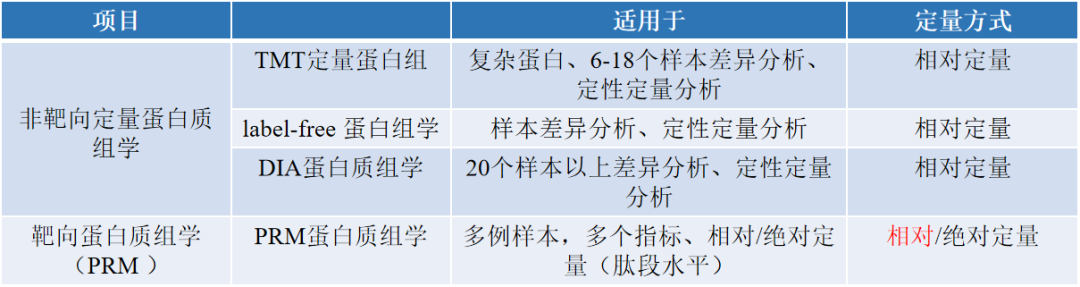

Q4 为什么TMT技术建议检测样本为同物种同组织,而DIA和Label-free不受组织限制?
因为TMT是标记后一起上机检测,标记的是所有样本中共有的蛋白,不同组织部位包含的蛋白质差异比较大,如果不同组织部位一起检测会遗漏很多蛋白信息。DIA和Label-free不进行标记,一个个上机检测,因此每个样本的检测都是独立的。
Q5 为什么Label-free的缺失值会比较多,而TMT和DIA缺失值相对较少?
Label-free进行质谱采集时只选取topN的母离子进行二级碎裂和MS2检测,所以会丢失一些丰度较低的肽段信息,缺失值比较多;
TMT使用二级定量报告离子定量,不同样本的丰度信息同时被采集,缺失值非常非常少;
DIA是无偏好的全息扫描,获得的信息全面,稳定性更好,缺失值相对较少。
Q6 蛋白组学样本寄送前是否需要精确计数或是称量?
不同样本寄送会有不同的送样要求,按照收集方法提供可以更好的保证实验用量充足。项目开展前会进行蛋白浓度的测定,后续也是不同样本等蛋白量处理、上机检测,但是要保证每个样本的寄样量达到实验要求。
Q7 血清血浆样本如何选择?
都可以选择使用,血浆含有纤维蛋白原,在血清中检测到的蛋白丰度相对于血浆来说更高,不进行高丰度蛋白去除情况下,一些比较微量的蛋白可能血清才可以检测出。但是血清的操作步骤相对比血浆而言更复杂,可能会带来人为误差。血清血浆预处理完毕后送样量必须大于200ul。
Q8 物种如何选择数据库?
常规是使用uniprot网站中研究物种的蛋白数据库作为搜库文件,如果该物种的数据库比较小或者没有数据库,可以选择以下2种解决方案:1)选择近源物种库,或扩大物种分类层级,选择上一层级或是更大层级的物种库;2)转录组测序结果作为数据库。个别物种有专门的数据库网站可以进行搜库分析。
Q9 如何设置生物学重复?
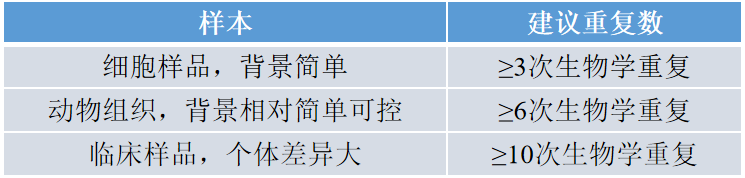
Q10 进行质谱检测蛋白组的样本应该如何处理、运输和保存?
细胞、组织、蛋白溶液、菌体等样品最好采用收集后液氮速冻,干冰运输,对于SDS-PAGE条带和2D点以及酶解好的肽段样品直接常温运输即可,如果天气较热,路途较远,也可以进行液氮速冻,干冰运输。





















 985
985











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








