无菌医疗器具生产管理规范》(YY/T 0033-2000)标准中对洁净室(区)定义有了明确的规定,即需要对尘埃及微生物含量进行控制的房间(区域),其建筑结构、装备及其作用具有减少对该房间(区域)内污染源的介入、产生和滞留的功能。
《洁净室及相关受控环境 第1部分:按粒子浓度划分空气洁净度等级》(GB/T 25915.1-2021)中规定,洁净室是指空气悬浮粒子浓度受控并分级的房间,其设计、建造到运行均使进入、产生、滞留于房间的粒子受控。洁净区是指空气悬浮粒子计数浓度受控并分级的限定空间。其建造和运行使进入、产生和滞留于空间的粒子受控。洁净区可以是限定于洁净室内的空间,也可用隔离装置实现。隔离装置既可设在洁净室内也可在洁净室外。
 !
!
洁净室(区)的洁净度级别和设置原则
(一)洁净度级别
洁净度:洁净环境内单位体积空气中含大于或等于某一粒径悬浮粒子的允许统计数。
依据《无菌医疗器具生产管理规范》(YY/T 0033-2000)标准,洁净室(区)的环境级别分为300,000级、100,000级、10,000级和100级。
表1 《无菌医疗器具生产管理规范》(YY/T 0033-2000)中
空气洁净度等级
| 洁净度级别 | 尘埃最大允许数(个/m3) | 微生物最大允许数 | ||
| ≥0.5μm | ≥5μm | 沉降菌 (个/皿) | 浮游菌 (个/m3) | |
| 100级 | 3,500 | 0 | 1 | 5 |
| 10,000级 | 350,000 | 2,000 | 3 | 100 |
| 100,000级 | 3,500,000 | 20,000 | 10 | 500 |
| 300,000级 | 10,500,000 | ≤60,000 | 15 | —— |
《医药工业洁净厂房设计标准》(GB 50457-2019)中对洁净度等级也作出了相关的规定。
表2 《医药工业洁净厂房设计标准》(GB 50457-2019)中医药洁净室(区)空气洁净度等级
| 洁净度级别 | 悬浮粒子最大允许值(个/m3) | |||
| 静态 | 动态 | |||
| ≥0.5μm | ≥5.0μm | ≥0.5μm | ≥5.0μm | |
| A级 | 3,520 | 20 | 3,520 | 20 |
| B级 | 3,520 | 29 | 352,000 | 2,900 |
| C级 | 352,000 | 2,900 | 3,520,000 | 29,000 |
| D级 | 3,520,000 | 29,000 | 不作规定 | 不作规定 |
表3 《医药工业洁净厂房设计标准》(GB 50457-2019)中医药洁净室环境微生物监测的动态标准
| 洁净度 级别 | 浮游菌 (cfu/m³) | 沉降菌 (φ90mm) cfu/4小时 | 表面微生物 | |
| 接触(φ55mm) cfu/碟 | 5指手套 cfu/手套 | |||
| A级 | <1 | <1 | <1 | <1 |
| B级 | 10 | 5 | 5 | 5 |
| C级 | 100 | 50 | 25 | – |
| D级 | 200 | 100 | 50 | – |
!
洁净室(区)的日常监测项目
依据《无菌医疗器具生产管理规范》(YY/T 0033-2000)标准,洁净室(区)的监测项目包括温湿度、静压差、风速、换气次数、尘埃粒子数、沉降菌或浮游菌。
表4 《无菌医疗器具生产管理规范》(YY/T 0033-2000)中
环境监测项目
| 监测项目 | 技术指标 | 监测 方法 | 监测 频次 | ||||
| 100级 | 10,000级 | 100,000级 | 300,000级 | ||||
| 温度,℃ | (无特殊要求时)18~28 | JGJ 71-1990 | 1次/班 | ||||
| 相对湿度, % | 45~65 | 1次/班 | |||||
| 风速, m/s | 水平层流≥0.4 垂直层流≥0.3 | —— | —— | —— | 1次/月 | ||
| 换气次数,次/ h | —— | ≥20 | ≥15 | ≥12 | 1次/月 | ||
| 静压差,Pa | 不同级别洁净室(区)之间≥5 | 1次/月 | |||||
| 洁净室(区)与室外大气≥10 | |||||||
| 尘埃 个/m3 | ≥0.5μm | ≤3,500 | ≤350,000 | ≤3,500,000 | ≤10,500 ,000 | GB/T 16292-1996 | 1次/季 |
| ≥5μm | 0 | ≤2,000 | ≤20,000 | ≤60,000 | |||
| 浮游菌数,个/m3 | ≤5 | ≤ 100 | ≤ 500 | —— | GB/T 16293-1996 | 1次/季 | |
| 沉降菌数,个/皿 | ≤1 | ≤ 3 | ≤ 10 | ≤ 15 | GB/T 16294-1996 | 1次/周 | |
!
洁净室(区)环境控制要求
我们首先介绍一下空气净化过程主要涉及的几方面内容:
一是利用过滤器有效地控制送入室内的全部空气的洁净度,由于细菌都会依附在微粒上,微粒过滤同时也滤掉了细菌。
二是利用合理的气流组织排除已经发生的污染,由送风送入洁净空气,使室内产生的微粒和细菌被洁净空气稀释后强迫其由回风口进入系统的回风管路,在空气净化系统的混合段和从室外引入的经过过滤的新风混合,再经过进一步过滤后又进入室内,通过反复的循环就可以把污染控制在一个稳定的水平上,这个水平就应该低于相应的洁净度级别。
三是通过调整,使不同级别洁净室(区)室内的空气静压大于5Pa(包括与非洁净室(区)),与室外大气大于10Pa,防止外界污染或交叉污染从门或各种缝隙部位侵入室内。
!
洁净室(区)环境监测项目及指标要求
本部分中关于洁净室(区)环境监测应按照《无菌医疗器具生产管理规范》(YY/T 0033-2000)标准出具洁净室(区)环境检测报告。
体外诊断试剂产品应参照表4《无菌医疗器具生产管理规范》(YY/T 0033-2000)中环境监测项目执行。
1.温湿度和静压差
一般情况下,温湿度和静压差是日常监测项目,在产品生产过程中应随时检查温湿度、静压差应在规定的范围内。
值得注意的是,温湿度的要求应当与产品生产工艺要求相适应,无特殊要求时,温度应当控制在18~28℃,相对湿度控制在45%~65%。主要考虑医疗器械产品的种类繁多,生产工艺过程中可能存在有在不同温度或湿度环境要求下进行生产的情况,如胶体金试剂、酶联免疫试剂的工序中可能存在的干燥环境。生产企业应充分考虑产品生产工艺的需要,具体规定洁净间里的温湿度要求。
《无菌医疗器具生产管理规范》(YY/T 0033-2000)中规定:空气洁净级别不同的相邻房间之间的静压差应大于5Pa,洁净室(区)与室外大气的静压差应大于10Pa。但要注意,对于同级别洁净室(区)内,针对不同生产工序也应区别对待,如注塑间与相邻同级别功能间应有压差梯度,以防止污染。
2.风速或换气次数
一般来说,洁净室(区)的换气次数越高,室内的空气质量就越好。不同的洁净等级要求,空气循环次数要求不同,洁净等级越高,需要的单位时间内循环次数越多。在空气净化系统设计时,应当依据规范拟定合理的换气次数,计算出需要的循环风量、排风量、新风量等参数进行设备选型。换气次数无法通过仪器直接测量得到,需要使用风量计或风速仪对进入洁净区域的洁净空气进行测量,并与该洁净区域的房间容积计算后得到。而对100级洁净区域需要测量洁净空气单向流的风速。
表10 《无菌医疗器具生产管理规范》(YY/T 0033-2000)
中有关风速、换气次数的规定
| 监测项目 | 技术指标 | |||
| 100级 | 10,000级 | 100,000级 | 300,000级 | |
| 换气次数,次/ h | – | ≥20 | ≥15 | ≥12 |
| 风速, m/s | 水平层流≥0.4 垂直层流≥0.3 | – | – | – |
3.尘埃颗粒数、沉降菌和浮游菌
《洁净厂房设计规范》(GB50073-2013)标准对洁净室(区)的尘埃颗粒数及微生物菌落数的检测都规定了相关的要求,正常情况下洁净室(区)状态一般分为空态、静态和动态三种:
空态:已经建造完成并可以投入使用的洁净室(区)。它具备所有有关的服务和功能。但是,在设施内没有操作人员操作的设备。
静态:各种功能完备、设定安装妥当,可以按照设定使用或正在使用的洁净室(区),但是设施内没有操作人员。
动态:处于正常使用的洁净室(区),服务功能完善,有设备和人员从事正常的生产工作。
洁净室(区)建设完工后应对整体工程项目进行验证,以确认是否达到规定的设计要求。无菌医疗器械生产洁净室(区)的验证通常是由安装确认、运行确认、性能确认组成的,其中设备安装、仪器仪表的校正属于安装确认,性能确认是作最后的判断。在生产环境验证中性能确认是对净化系统是否能达到规定的洁净级别做出判断;医疗器械工业洁净室(区)的洁净度主要包括尘埃和微生物两个方面,因此洁净度的测定主要是对尘埃粒子和微生物菌落数的测定。
01悬浮粒子的测定
悬浮粒子的测定可参见《医药工业洁净室(区)悬浮粒子的测试方法》(GB/T16292-2010)标准,主要采用自动粒子计数法。
自动粒子计数法是把洁净室(区)中粒径大于等于0.5μm的粒子,按悬浮状态连续计数的方法测定。
02微生物菌落数的测定
由于微生物均是附着在悬浮粒子上,故判断洁净室(区)是否达到规定的洁净度需要测量环境中的微生物数量。微生物菌落数的测定有浮游菌和沉降菌两种测定方法。两种方法所用检测设备、工具不同,判定标准也不同。应根据实际需要选择测定方法。
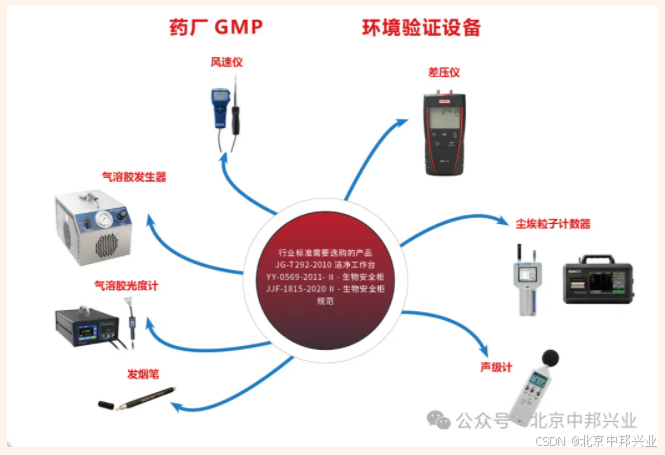
03检测设备
生产无菌、植入性医疗器械和体外诊断试剂生产企业应当具备环境监测能力,具有相适应的检测设备,检测设备一般包括尘埃粒子计数器、风速仪、温湿度计、压差表等。日常环境监测应由本企业独立完成,不得委托检测。
04检测状态
一般情况下,生产企业可在静态环境下进行环境监测,必要时进行动态监测。
05检测周期
一般情况下,生产企业宜定期委托有资质的检测机构进行环境监测,当影响产品的主要因素,如工艺、工装、质量控制方法、主要原辅料、主要生产设备发生改变时,生产一定周期后,以及进行了洁净室(区)改扩建,均应进行重新验证或确认。
06检测方法
检测前洁净室(区)的空气净化系统宜至少运行30min,如开紫外消毒灯等消毒设备应在检测前15min关闭。
1.温度、相对湿度的检测
设备:温度的检测可采用玻璃温度计、数字式温湿度计;湿度的检测可采用干湿球温度计、数字式温湿度计、电容式湿度检测仪等;
方法:《洁净室施工及验收规范》(GB 50591-2010);
检测点:可在送回风口处或在工作区具有代表性的地方布置。测点一般应布置在距墙面大于0.5m、距地面0.8m的同一高度上;也可根据检测区的大小,分别布置在距地面不同高度的几个平面上。
2.风速和换气次数的检测
设备:风速仪、风量罩;
方法:《洁净室施工及验收规范》(GB 50591-2010);
检测点:对于单向流洁净室,可采用送风面的截面平均风速和截面积乘积的方法确定送风量。垂直单向流洁净室的测定截面取距地面0.8m的无阻隔面的水平截面;水平单向流洁净室的测定截面取距送风面0.5m的垂直于地面的截面。测点数应不少于20个,均匀布置。
对于非单向流洁净室,可采用风量罩直接测量得出风量值,测量时应将风量罩口完全罩住过滤器或出风口,风量罩面积应与风口面积对中,风量罩边与接触面应严密无泄漏。当选用套管法时,将辅助风管连接于过滤器风口外部,在套管出口平面上均匀划分小方格,方格边长不大于200mm,在方格中心设测点,最少测点数不少于6点,测量截面平均风速,乘以测量截面面积得出风量。
3.静压差的检测
设备:压差计;
方法:《洁净室施工及验收规范》(GB 50591-2010);
检测点:宜从平面上最里面的房间依次向外测定相邻想通房间的压差,直至测出洁净区与非洁净区、室外环境之间的压差。
4.尘埃数的检测
设备:粒子计数器;
方法:《医药工业洁净室(区)悬浮粒子的测试方法》(GB/T16292-2010)
检测点:在静态时,悬浮粒子采样点数及其分布应力求均匀;在动态时,悬浮粒子采样点数目及其布置应根据产品的生产及关键工序设置。采样点一般在离地面0.8m高度的水平面上均匀布置,也可在离地面0.8m~1.5m高度的区域内分层布置,但每层不少于5点。最少采样点数目可符合表11的要求
表11 最少采样点数目
| 面积m2 | 洁净度级别 | |||
| 100级 | 10,000级 | 100,000级 | 300,000级 | |
| <10 | 2 ~ 3 | 2 | 2 | 2 |
| ≥10 ~ <20 | 4 | 2 | 2 | 2 |
| ≥20 ~ <40 | 8 | 2 | 2 | 2 |
| ≥40 ~ <100 | 16 | 4 | 2 | 2 |
| ≥100 ~ <200 | 40 | 10 | 3 | 3 |
| ≥200 ~ <400 | 80 | 20 | 6 | 6 |
| ≥400 ~ <1000 | 160 | 40 | 13 | 13 |
| ≥1000 ~ <2000 | 400 | 100 | 32 | 32 |
| ≥2000 | 800 | 200 | 63 | 63 |
注:表中的面积,对于单向流洁净室(区),是指送风口表面积 ;对于乱流洁净实是指房间的面积。
5.微生物的检测
浮游菌的测定
a.浮游菌的测定是通过收集悬浮在空气中的生物性微粒子,通过专门的培养基,在适应的生长条件下,让其繁殖到可见的菌落进行计数,从而判定洁净环境中单位体积空气中菌落数的多少。浮游菌的测定可参见《医药工业洁净室(区)浮游菌的测试方法》(GB/T 16293-2010)。
b.浮游菌测定需有专门的采样器、真空抽气泵等设备,浮游菌采样器常用撞击法中的狭缝式采样器。
c.采用的浮游菌采样器必须要有流量计和定时器,并严格按仪器说明书的要求定期进行校验和操作。
d.浮游菌测定的采样点及数目与悬浮粒子测定相同,即在同悬浮粒子相同的测定点采样。
e.浮游菌测定的最少采样点数同时还应符合表12的要求,最小采样量的要求符合表13,浮游菌结果评定参见相关标准的规定。
表12 最少培养皿数
| 洁 净 度 级 别 | 最少培养皿数(φ90mm) |
| 100 | 14 |
| 10,000 | 2 |
| 100,000 | 2 |
| 300,000 | 2 |
表13 最小采样量
| 洁净度级别 | 采样量L/次 |
| 100 | 1,000 |
| 10,000 | 500 |
| 100,000 | 100 |
| 300,000 | 100 |
2)沉降菌的测定
a.沉降菌测定主要用φ90培养皿和各种培养基,可根据培养目的使用大豆酪蛋白琼脂培养基(TSA)或沙氏培养基(SDA)或经验证的培养基。
b.沉降菌测定其培养皿应布置在具有代表性的地方和气流扰动最小的地方,沉降菌的测定可参见《医药工业洁净室(区)沉降菌的测试方法》(GB/T 16294-2010)。
c.采样方法及培养:将培养皿按要求放置后,打开平皿盖,使培养基表面暴露30分钟后,将平皿盖盖上,然后在30~35℃的条件下(可用恒温培养箱)培养48小时后计数。
d.沉降菌测定的采样点及数目在符合悬浮粒子采样点要求的同时,还应符合表13的要求。不论面积大小,作为一个被测对象,都应该满足以上要求。
07检测注意事项
在进行测试之前,应先确定待测区域、测试状态、仪器设备、测试规程、采样点位置、评价标准以及相关注意事项;建立环境监测程序,这样才能证实设备以及产品的接触环境是洁净和卫生的,并可以确定潜在的污染物是否能被控制到适当水平;所有仪器设备在未进入被测区域时,应保证其符合性、有效性和已完成清洁,或在相应的洁净室(区)内准备和存放(用保护罩或其它适当地外罩保护仪器);测试人员在测试时必须穿戴符合被测环境级别的洁净工作服或无菌工作服;在测试时应避免肤屑、微生物或人体皮肤上的油造成潜在的污染。
08洁净室(区)验证要求
洁净室(区)的验证应包括室内系统及设施,如净化空气、工艺用水等系统及设施的设计确认、安装确认,运行确认和性能确认。系统及设施的安装确认包括各分部工程的外观检查和单机试运转,系统及设施的运行确认应在安装确认合格后进行,内容包括带冷(热)源的系统联合试运转,并不应少于8小时,洁净室(区)的综合性能确认要求见下表。
表14 洁净室(区)综合性能评定检测项目
| 序号 | 检测项目 | 单向流 | 非单向流 |
| 1 | 系统送风、新风、排风量 | 检测 | |
| 室内送风、回风、排风量 | 检测 | ||
| 2 | 悬浮粒子 | 检测 | |
| 3 | 浮游菌、沉降菌、表面微生物 | 检测 | |
| 4 | 室内静压值 | 不测 | 检测 |
| 5 | 气流组织 | 不测 | 必要时检测 |
| 6 | 单向流平均风速 | 检测 | 不测 |
| 7 | 单向流流线平行性 | 检测 | 不测 |
| 8 | 单向流气流均匀性 | 检测 | 不测 |
| 9 | 室内温度、相对湿度 | 检测 | |
| 10 | 恢复时间 | 必要时检测 | |
| 11 | HEPA(高效空气过滤器)完整性 | 检测 | |
| 12 | 室内噪声级 | 检测 | |
| 13 | 室内照度和均匀度 | 检测 | |
具体验证要求可参考《医药工业洁净厂房设计标准》(GB 50457-2019)标准附录C。
!
洁净室(区)运行管理和日常维护要求
洁净室(区)日常维护
1.定期进行空气净化系统设备的维护和保养:包括空气净化系统的检修、以及相关部件的维护管理,如可能的电机、传感器等。
2.定期对空气净化系统的功能进行检测和保养:对初、中、高效过滤器的保养,包括清洗、更换。
3.空气净化系统功效的维护:可通过送风量的大小(换气次数)进行监测。
4.配套空气净化系统使用的其他设备的管理:如空气净化器、臭氧消毒器等的管理。
5.洁净室(区)的排水:具体验证要求可参考《医药工业洁净厂房设计标准》(GB 50457-2019)中第10.3条。
注:采用无菌加工技术生产医疗器械的企业,在洁净室(区)管理方面除符合上述要求外,还应满足《医疗保健产品的无菌加工 第1部分:通用要求》(YY/T0567.1-2013)标准的相关要求。

























 1464
1464

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










