一、电极的极化:
1.电化学动力学:
反应速度与相关物理量的关系。

电化学反应速度与 1.电极材料相关 2.电极电位相关

2.极化现象:
电极体系偏离平衡状态而发生电极电位偏离平衡电位的现象。

过电位:
3.成因:
1.电荷转移的速度不够快。

2.即便电荷转移足够快,
电化学平衡被打破 净的物质消耗或生成
电极表面氧化和还原反应 不等于本体的氧化和还原反应 由此带入Nernst方程
根本原因:本体溶液中的反应物种的传质速度有限。
4.绝对电极电位的变化规律:
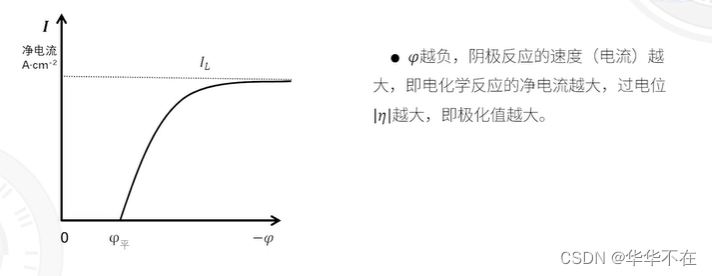
1.电极体系偏离平衡状态,发生净的阳极反应,则相应地电极电位偏离平衡电位往正向移动,反之亦然。
2.电极体系偏离平衡状态,发生净的阴极反应,则相应地电极电位偏离平衡电位往负向移动,反之亦然。
5.极化的意义:

二、电极过程的基本历程:
1.历程:


Faraday过程:
1.双电层充电步骤——双电层区内(charging)
2.电荷转移步骤——双电层区内(charge transfer)
3.反应物/产物从溶液本体/电极表面向电极表面/溶液本体的传质过程——电极表面-溶液本体间(mass transport)
4.反应粒子/产物在电极表面上的吸附或发生化学变化,前置/后置的表面转化步骤——电极表面(chemical conversion)
2.电极过程的特征:
1.电极反应发生在电子导体/离子导体界面
a.在双电层内进行
b.异相反应
c.电子导体导通电子,其表面又是反应地点。
2.双电层区的界面电场和强度可人为调整(通过调控电极电位),改变电极反应的反应速度。
3.任何电极过程都有如2,3,4等系列串联的Faraday步骤组成。
4.任一步骤受阻均导致整个电极反应受阻。
3.速控步骤:
Faraday过程中各串联步骤的某一或几个慢的步骤(历程),决定整个电极的反应速度,是整个电极过程的速度控制步骤(rate-determining step RDS)
1.反应潜能最小的步骤为速控步骤,反应潜能最大的其它步骤潜能 不能完全发挥。
2.当两个串联步骤的速度潜力相当,则两个步骤均可成为速控步骤(混合控制)。
3.速控步骤的类型 决定 电极的极化类型
常见的极化类型:
a.浓差极化 传质步骤为速控步骤
b.电化学极化 电荷转移为速控步骤
c.表面转化极化 表面转化为速控步骤
4.非速控步骤:

二、传质过程为速控步骤条件下的电极动力学:
1.传质的类型:
a.对流:部分溶液与另一部分溶液间的相对流动。

b.电迁移:

c.扩散:组分从浓度高的一侧向浓度低的一侧运动。

2.稳态扩散过程:
1.稳态扩散的基本特征:

























 1万+
1万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








