肿瘤微环境(Tumor Microenvironment,TME)在肿瘤发展和免疫治疗中扮演着至关重要的角色。尽管已有大量研究揭示了TME中免疫细胞和非免疫细胞的组成,以及他们如何通过分泌因子等方法进行通讯,但这些细胞在组织空间上的精确排列及其对肿瘤生长或抑制的功能依然未知。TME的动态性和复杂性让肿瘤研究变得复杂且困难,因此充分理解TME是开展全新治疗策略的关键一步。
近期来自厦门大学生命科学学院的团队在《Cancer Cell》(IF=48.8)发表的一项题为“Lymphatic-localized Treg-mregDC crosstalk limits antigen trafficking and restrains anti-tumor immunity”的研究采用了单细胞测序、空间多重成像、空间转录组等技术发现了Tregs在肿瘤基质的淋巴管周围区域的特异性富集,并与mregDCs相互作用,最终阻碍抗肿瘤适应性免疫反应启动的生物过程。

01 Treg在肿瘤基质的淋巴管区域富集
肠道结构的高度复杂性和异质性是肠道研究的难点之一,在结直肠癌中,肿瘤免疫微环境的研究显得尤为困难。在此研究人员通过使用空间多重成像对结直肠癌自发性小鼠的肿瘤组织进行了解析,研究了关键免疫细胞亚群在肿瘤中的分布情况。结果显示CD8+T细胞和B细胞在肿瘤组织中的浸润较少,相比之下,Tregs在肿瘤边缘间质中出现了特异性聚集(图1A)。同时巨噬细胞和DC细胞分布广泛。为了进一步探究Treg的空间位置,研究人员使用CD31和Lyve-1来识别血管和淋巴管的分布,结果显示Treg很少沿着血管聚集,而更多的与肿瘤基质区域的淋巴管共定位(图1B-C)。
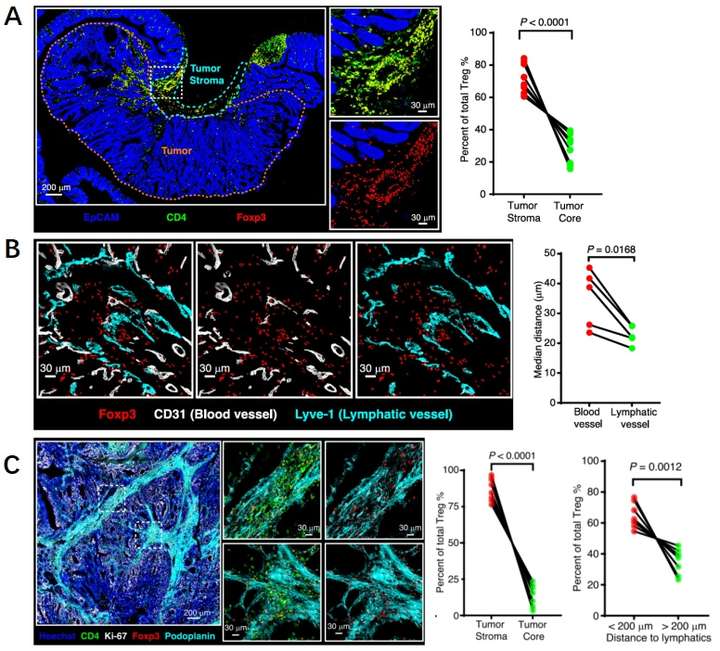
图1 Treg存在特殊的空间位置
02 Treg与mregDC的相互作用
Treg的特殊分布情况让研究人员不得不思考两个问题:
1.Treg为什么沿着淋巴管聚集?
2.Treg的特殊位置如何抑制抗肿瘤免疫?
研究人员使用单细胞测序对结直肠癌小鼠肿瘤组织和野生型小鼠结肠组织进行分析,共鉴定出了8个主要细胞群(图2A),研究人员在此发现Treg被特异性的招募到肿瘤中,因此研究人员进一步的对肿瘤部位Treg细胞进行了分析。根据以往研究内容,Treg的激活涉及TCR信号传递,从而响应DC上的抗原识别。因此研究人员尝试分析与Treg相关的DC亚群。肿瘤部位的DC亚群根据特征被分为4个亚群,与其他亚群相比,富含免疫调节分子的成熟树突状细胞(mregDC)显示出了更多与迁移和成熟相关的基因(图2B)。这预示着mregDC可能与肿瘤部位的Treg具有相关性,CellPhoneDC算法分析了Tregs与各种DC簇之间的相互作用,其中mregDC即便没有最多的配受体对,但是存在更特异性的趋化轴和表面分子互作的潜力。同时研究人员评估了Treg和DC细胞簇之间的特征基因,这些特征基因也证明两者存在高度相关性(图2C-E)。后续研究人员通过空间单细胞蛋白组验证了两者的互作生态位处于肿瘤基质中(图2F)。
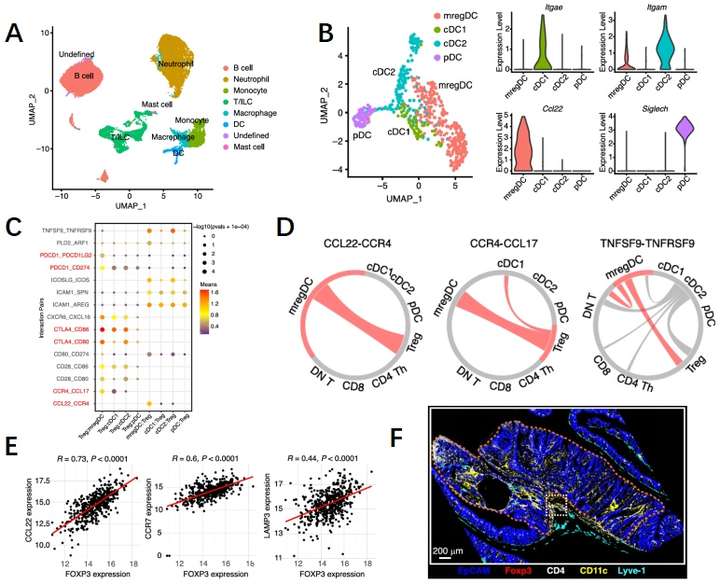
图2 Treg-mregDC存在相互作用
03 Treg和mregDC的互作激活Treg
单细胞测序显示出Treg存在激活和静止状态,为了进一步研究空间位置与Treg细胞激活的关系,研究人员使用PD-1、OX-40和FOXP3来描绘激活的Treg(图3A)。空间分析显示多数PD-1high和OX-40high的Treg位于mregDC附近。但是Treg的激活可能来自于招募前,在此研究人员构建了可以在原位观察到TCR信号的小鼠模型,通过空间分析研究人员发现,与mregDCs接近的Tregs表现出TCR激活,这个结果证明Tregs的激活需要与mregDCs存在较近的空间位置(图3B-C)。MHC-Ⅱ信号是T细胞活化的主要驱动因素,研究人员在此将靶向MHC-Ⅱ类分子的阻断抗体应用于肿瘤小鼠模型中,结果显示不仅Tregs的增殖和总数减少,并且PD-1、TIM-3等多个Treg细胞活化相关分子表达水平下降(图3D-G)。以上发现证明Tregs和mregDCs的互作促进了Tregs的高度激活状态,从而增强其在TME中的抑制能力。
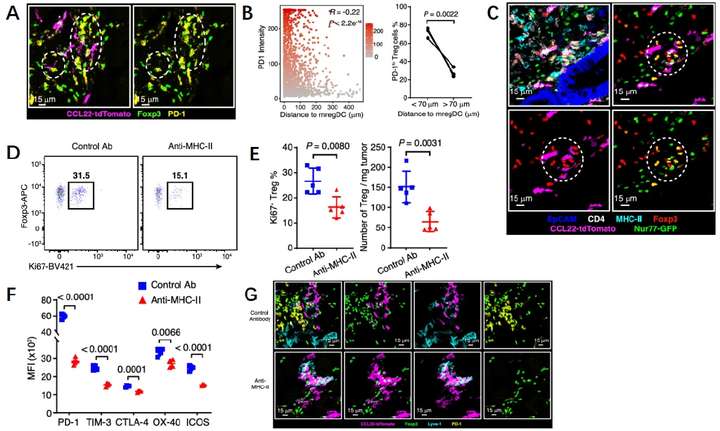
图3 Treg-mregDC互作激活Treg
04 Tregs和mregDCs的互作抑制抗肿瘤免疫
以往的研究表明,DCs在肿瘤病变时能够吸收瘤内抗原并获得成熟状态,随后通过淋巴血管迁移到淋巴结中,并在淋巴结中将抗原呈递给T细胞。在此研究人员猜测DCs与Tregs的密切作用可能会阻碍DCs向淋巴结的转移。与野生型小鼠相比,携带肿瘤的小鼠的淋巴结中成熟DCs显著减少,这表明DCs的迁移障碍是由肿瘤导致的(图4A)。因此研究人员使用荧光染料共轭卵白蛋白(FITC-OVA)与脂多糖(LPS)模拟肿瘤抗原,24小时后的检测发现DCs是迁移的主要细胞群体,但是这种迁移在荷瘤小鼠中明显受损。为了进一步探究Tregs是否与肿瘤抗原呈递受损有关,研究人员在小鼠中去除了Tregs后发现,Tregs的缺失会导致肿瘤抗原呈递的显著增加(图4B-D)。接下来研究人员尝试使用MHC-Ⅱ阻断剂和aCTLA4来破坏Treg和mregDCs的相互作用,结果显示两个抗体治疗均能改善肿瘤抗原的转运(图4E-F)。以上结果表明,TME中Treg和mregDCs之间的互作通过抑制肿瘤抗原向淋巴结的运输来抑制抗肿瘤免疫的启动。
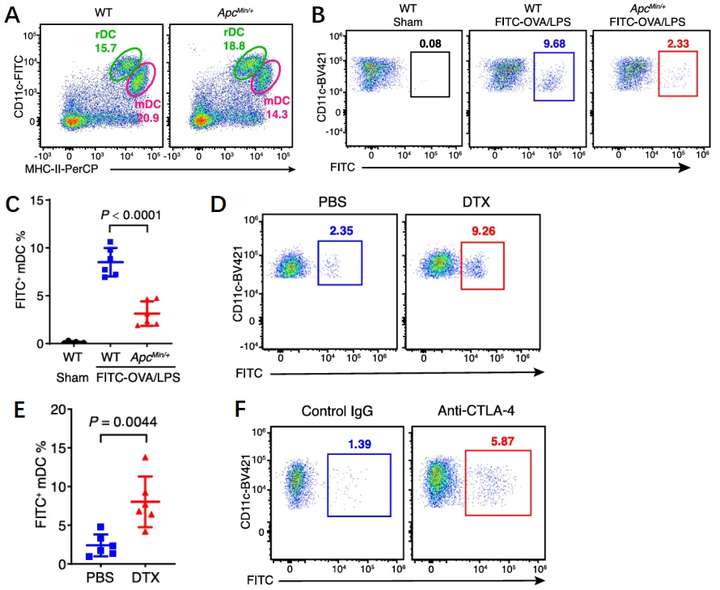
图4 Treg-mregDC互作干扰抗原运输
05 Treg-mregDC生态位建立预示着更差的结局
研究人员分析了最近发表的人类结直肠癌(CRC)的空间转录组数据库,发现肿瘤基质淋巴区有明显的活化Treg和mregDC聚集(图5A),这个结果验证了以上的发现。Treg-mregDC之间独特且显著的空间关系促使研究人员分析其空间位置与患者预后的关系。研究人员根据ssGSEA算法将患者分为两组,探究了活化Treg的表达情况对mregDC高表达患者的影响,结果显示与mregDChigh活化Treghigh患者相比,mregDChigh活化Treglow患者在总生存期、无进展生存期和无病生存期方面表现出明显改善(图5B)。最后为了评估Treg-mregDC的生态位是否在人类癌症中具有广泛意义,研究人员确定了10个TCGA队列,其中包含了多种癌症类型,结果与小鼠模型中的观察一致(图5C)。Tregs和mregDCs之间的互作构成了抑制抗肿瘤免疫的环境,并且与患者生存率降低相关。
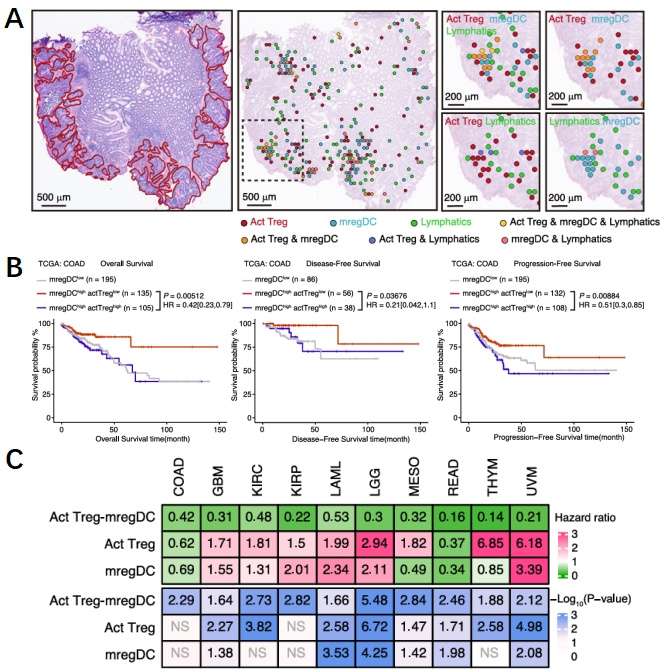
图5 Treg-mregDC生态位与患者生存相关
总结与讨论
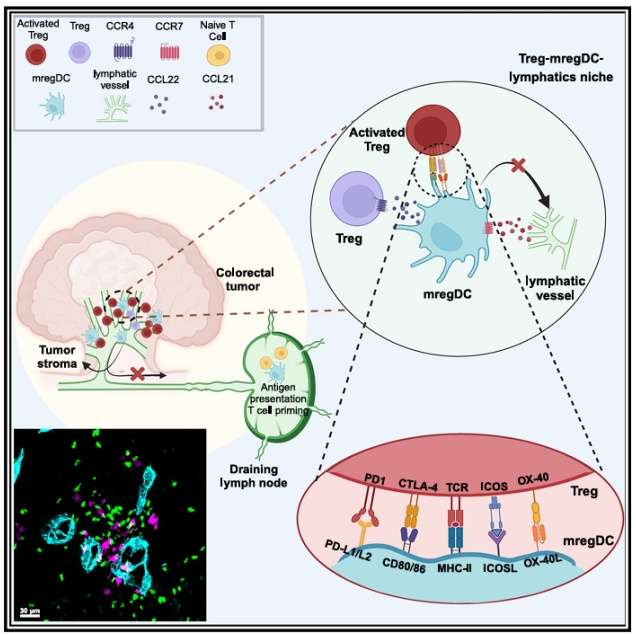
细胞间的互作是研究人员一直关注的问题,但如何发现并且直观的看到细胞间的互作关系,是细胞互作研究的难点。本文研究人员使用多种空间组学对肿瘤微环境中的免疫细胞进行了深入剖析,发现了Tregs和mregDCs两个细胞群体的特殊互作关系,不仅揭示了细胞的互作如何干扰癌症抗原传递,还建立了多种癌症患者的预后体系。空间组学不仅可以帮助我们最大程度的还原组织原位的细胞空间分布,还可以对细胞进行精准的分群,让所有的细胞无处遁形。
|空间多组学整合方案
| PCF空间单细胞蛋白组学优势

华盈生物PhenoCycler-Fusion单细胞原位空间蛋白组学技术资格证书

华盈生物是美国Akoya Bioscience公司的PhenoCycler-Fusion空间单细胞蛋白组学技术认证服务商,已经被纳入了该技术的全球CRO服务提供者体系。借助全球领先的PhenoCycler-Fusion空间单细胞蛋白组学技术平台的建立,华盈生物将为中国客户提供更具精准医学特色的服务与合作,推动中国团队在空间生物学领域的研究水平,加快构建符合中国人群的精准医学模式。


业务咨询400-869-2936或17316301592(微信同号)
相关文献
You S, Li S, Zeng L, et al. Lymphatic-localized Treg-mregDC crosstalk limits antigen trafficking and restrains anti-tumor immunity. Cancer Cell. 2024: S1535-6108(24)00239-3.
![]()
1)Nature | 重庆大学印明柱团队在单细胞尺度下解析肿瘤血管生成及互作微环境
2)Nature Commun|牙周病的全新视角:单细胞与空间技术解析牙龈上皮周围免疫微环境
3)Cancer Cell | 卞修武院士/时雨/平轶芳团队揭示胶质瘤巨噬细胞研究全新视角
4) Nature Medicine | 马骏院士团队解析鼻咽癌联合治疗后的肿瘤免疫微环境
5)Hepatology|中山一院于君/李晓星团队利用空间单细胞蛋白组揭示肝细胞癌的免疫微环境
6)Cancer Discovery | 非小细胞肺癌的空间蛋白组学研究再添新篇章
7) Cancer Cell| 樊嘉院士/张力烨团队解析转移性肝细胞癌的时空演变
8) Nat Commun|直捣黄龙!空间单细胞组学发现外周血靶细胞亚群的组织落脚点
9)Nat Genet|马丁院士团队利用单细胞和空间多组学描绘宫颈鳞癌免疫微环境图谱
10) Cancer Cell | 北大医院李航/张宁/薛瑞栋团队揭示肢端黑色素瘤空间细胞互作关系
| 工作邮箱:market@wayenbiotech.com
| 官网链接:www.wayenbio.com





















 1580
1580

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








