关于GB9706.1-2007,对于有源医疗器械,出厂检验,安规三项是每台必检的吗?
这个问题很常见,大家是否搞明白了呢?
有人说:有源器械出厂检验本来就是抽检的呀,但是那些好几天才生产1台或几台大型设备,一般都是全检的;
有人说抽检与全检的是看样品基数的,通常基数小的都是全检的
有人说根据风险来,比如像家用血糖仪之类的小产品,是可以抽检的。如果是CT之类的大设备,肯定要全检,你又是怎么看待这个问题的呢?
那么关于9706.1出厂检验,首先要考虑是不是需要全检?是的话是哪个标准规定的?另外大家会不会考虑设备的多少问题?一天一台或者一天几台的话可能可以全检,一天几百台甚至上千台的还可以全检嘛?是需要全检还是抽检?全检的话如何实现?抽检的话如何抽?
类似的关于这些问题的讨论,可能你处在一个模棱两可的状态,没关系,星球上放了这个问题以及各位大佬的看法,一件事只有当你参与其中,印象才会更深刻,切忌不懂装懂,一知半解,当然不懂时去积极的参与讨论也是会收获非常大的哦
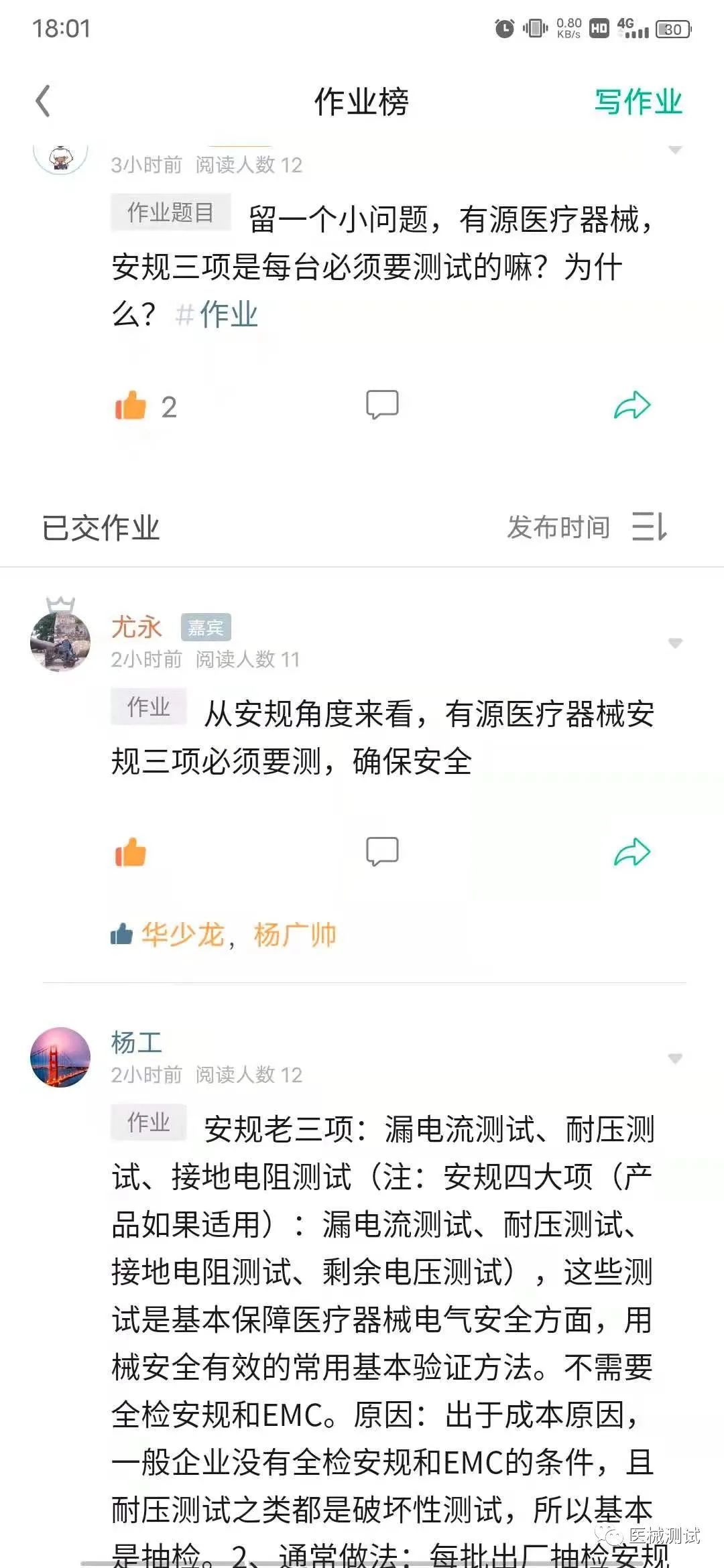
那么也是推荐一波星球,发现星球还有上传视频功能,后面也会把安规测试视频分阶段上传,供有需要朋友参考学习</








 最低0.47元/天 解锁文章
最低0.47元/天 解锁文章


















 8636
8636

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










