
Redirecting![]() https://doi.org/10.1016/j.cell.2018.01.029
https://doi.org/10.1016/j.cell.2018.01.029
The Human Transcription Factors-2018
1--如何识别TF?
1. 定义
TF即能够以序列特异性方式结合DNA并调节转录的蛋白质。
转录因子与特异性DNA结合通常概括为motif,即给定TF优先的相关短序列组的模型。可以用于扫描较长序列以鉴定是否存在潜在的TFBS。
2. 如何识别TF?
早期通常通过如DNA酶足迹法、迁移率变化法 鉴定结合位点,再使用N-末端肽测序、噬菌体文库、单杂交筛选 鉴定 特定结合蛋白。后续通过实验方法鉴定(单杂交测定、DNA亲和纯化-质谱、蛋白质微阵列)。
| DNA酶足迹法 DNase-footprinting | 鉴定特定蛋白质与特定DNA序列之间相互作用。 将标记的DNA片段与感兴趣的蛋白质混合,用DNase I轻微消化未被蛋白质结合的DNA区域,通过凝胶电泳分析消化产物,可以观察到一个足迹,即未被切割的DNA片段,表明蛋白质结合的位置。 |
| 迁移率变换 EMSA | 鉴定DNA与蛋白质的直接相互作用 将带标记的DNA与蛋白质混合,混合物通过凝胶电泳,如果蛋白质与DNA结合,复合物的迁移速度会因为其大小和形状的改变而减慢,从而在凝胶上形成可视化的带,表明结合发生。 |
| N-末端测序 | 鉴定与DNA结合的蛋白质的N-末端氨基酸序列,有助于确定蛋白质的身份,或修饰状态。 后续用Edman降解(顺序的从多肽链的N端移除氨基酸,每移除一个可以通过特定的化学反应检测)或质谱鉴定 |
| 噬菌体展示库 phage display | 利用噬菌体来展示大量的胎或蛋白质库。通过将噬菌体与特定的DNA序列接触,可以筛选出与该DNA序列具有高亲和力的蛋白质或肽,从而鉴定潜在的DNA结合蛋白。 |
| 单杂交筛选 Yeast One-Hybrid | 基于酵母的遗传筛选技术,用于鉴定能够结合到已知DNA序列的蛋白质。 DNA序列被用作诱饵,插入到一个报告基因的启动子区域之前,若有蛋白质能结合到该区域,他将激活一个报告基因(酵母细胞生长所需的营养 或 化学发光、变色可检测的标记物),从而可以通过筛选阳性克隆来鉴定结合蛋白。 |
| DNA亲和纯化-质谱 DAP-MS | 高通量技术,鉴定与特定DNA序列相互作用的蛋白质。 将带有生物素标记的DNA探针 与 细胞裂解物混合,允许DNA结合蛋白质吸附,通过亲和纯化,(利用生物素与链霉亲和素的亲和作用)来富集结合混合物,将与DNA结合的蛋白质从珠子上洗脱下来,用蛋白酶处理未较小的肽段。肽段送入质谱仪进行分析,鉴定蛋白质。 |
目前已知和推定的TF已经通过先前表征的 DNA结合结构域(DBD)的序列同源性来鉴定,也用于对TF进行分类。
大多数转录因子会有多个潜在结合位点,TF之间的协同性和协同作用,为这种特异性缺陷提供了解决方案。
2--TF的协同性
后生动物的TF一般需要共同作用才能与DNA结合,在效应功能中实现所需的特异性。
TF有多种合作方式,如帮助相互结合DNA(协同结合),或通过不同机制影响染色质状态或转录(协同调节),协同结合常常影响复合物中TF的序列偏好,并对两个结合位点之间的间隔序列产生限制。
不同的染色质重塑器(TFs)具有特定的DNA序列 和或 核小体构想的偏好,即核小体与核小体的定位机制 也赋予了TF功能上额外的DNA序列特异性。
3--TFs如何影响转录?
TF在与DNA结合时影响转录的方式有很多,一些可以直接招募RNA聚合酶,一些可以招募促进特定转录阶段的辅助因子。这些 共激活因子 和 辅阻遏物 通常是大的 多亚基蛋白质复合物,或多结构域蛋白质,涉及染色质结合、核小体重塑、组蛋白或其他蛋白质结构域的共价修饰。
特异性的效应结构域 通常可以介导TF特异性辅助因子的招募。
TF传统上被归类为 激活物 和 阻遏物,而许多TF根据所在序列的位置 和辅助因子的作用,可以招募具有相反作用的多种辅助因子。如MAX与MNT或MXD1以异二聚体形式与DNA结合时,起抑制作用,而作为异二聚体与MYC结合时 起激活作用。
4--人类TFs合集
该综述手工查询了2765种蛋白质(总结了文献和网站中 的 通过高通量、中通量、低通量等实验方法鉴定的TFs),上传到'HumanTFs'网站,每个TF有单独页面,以及每种DBD类型的已知motif 以及 序列比对。
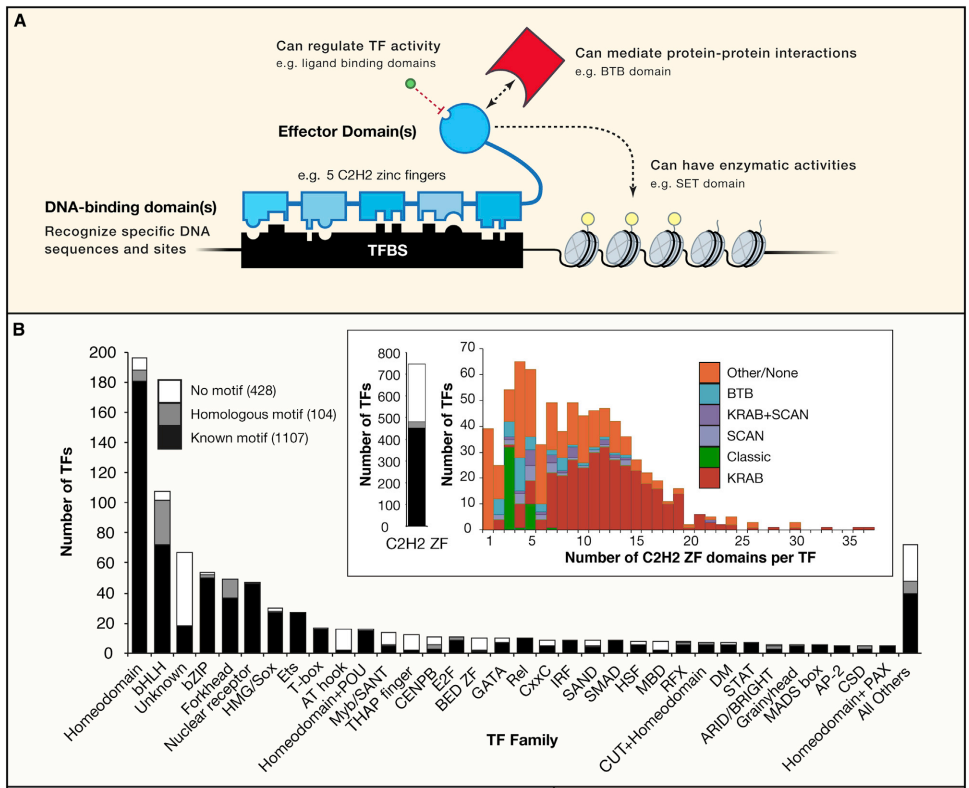
最终记录的 1639 个已知或潜在的 人类TFs,大约四分之三(1211)具有与其结合的motif。许多TF识别相似的motif,通常对应TF家族或亚家族。
TF的演变通常比它们的调控位点演变慢得多。尽管如此,TF的motif、结合物、表达模式 都在不停的改变着。
基因的组织细胞类型,包括TFs的特异性表达,通常对应着相应的特定功能。如SOX2、POU3F2几乎只在大脑皮层中表达。
TFs占所有人类基因的8%,与多种疾病和表型相关,TFs突变通常是高度有害的,这也解释了为什么TF编码位点富含 超保守的位点。
基因组中的大多数功能性DNA都是具有调节性的,TFs在其的识别和功能发挥中起着核心作用。面临的挑战包括 解决调节相同基因的多种元件之间的协同作用和冗余,预测E-P联系、沿染色体及其三维结构上大规模调控的模式探索、各种类型的表观遗传记忆。----以TF的方式解码基因组。
A transcription factor atlas of directed differentiation-2023

1. 单个TF的过表达就足以导致细胞命运的深刻变化,如改变TF的表达可以诱导多能干细胞向特定类型细胞的再分化。而多个TF组合的过表达,可以在基因调控网络中的产生更大的变化,如过表达四个TF(Oct4、Sox2、Klf4、c-Myc)就能将成熟细胞编码为多能干细胞。
这些发现强调了TF驱动cell state变化的能力,也强调了TF的过表达在理解调控细胞命运的基因表达程序方面的效用。
2. 人类基因组中有超过1800个TF基因,编码了超过3500个TF异构亚型,创造了一个巨大的基因调控景观。
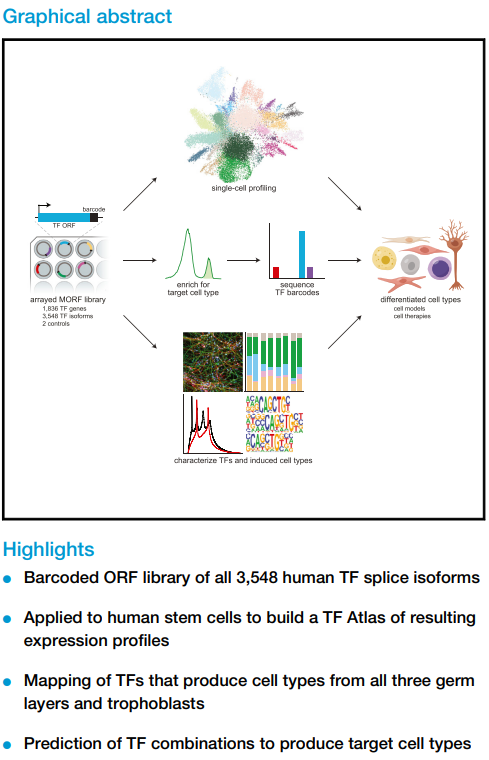
本研究创建了一个涵盖了人类所有TF异构亚型(3548个)的条形码文库,并将其用于构建TF图谱(TF Atlas),以单细胞分辨率绘制了每个TF过表达在人类胚胎干细胞(hESCs)中引起的表达谱变化。该TF Atlas既可以系统的识别 驱动细胞状态改变 的TF,也可以对TF分类,还可以用来预测和验证不同TF组合对细胞的影响。
3. 实现对TF的过表达有两种方法,①通过CRISPRa激活内源TF表达;②直接过表达TF的开放阅读框ORF。该文章在人胚胎干细胞hESCs验证了这两种方法的效果,结果显示,直接过表达NEUROD1或NEUROG2的ORF,可以诱导hESCs分化为神经元,而CRISPRa不行,可能是因为hESCs中存在转录后调控机制,能够缓冲蛋白质过表达。
4. 该团队构建了人类TF条形码文库,由1836个基因编码的3548个TF异构亚型组成。将这些TF条形码文库转导到hESCs中,对细胞进行scRNA-seq,获得了110万个单细胞RNA测序结果,以单细胞分辨率绘制了过表达每个TF的hESCs的表达谱。
通过scRNA-seq分析TF效应的方法 最大限度的扩大了TF诱导细胞状态的可能范围。
然后将TF诱导的表达谱 映射到参考细胞类型,验证用于生成不同细胞类型的候选TFs。基于此,可以创建定制的细胞疾病模型,并整合mRNA表达和染色质可及性数据,识别下游调控因子。预测不同TFs组合对细胞的影响,加速细胞工程研究。





















 626
626











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








