
英文题目: Peptostreptococcus anaerobius promotes colorectal carcinogenesis and modulates tumour immunity
中文题目:厌氧消化链球菌促进结直肠癌发生及调节肿瘤免疫
期刊名:Nature Microbiology
发表日期:2019-9-19
DOI:doi.org/10.1038/s41564-019-0541-3
影响因子:14.3
1
研究摘要
新的证据表明肠道微生物群在结直肠癌(CRC)中的作用。厌氧消化链球菌(P. anaerobius)是一种选择性富集在结直肠癌患者粪便和粘膜微生物群中的厌氧菌,但其促肿瘤发生的致病作用和分子机制尚不清楚。我们证明厌氧假单胞菌粘附在结直肠癌粘膜上,加速了Apc Min/+小鼠结直肠癌的发展。体外实验和透射电镜显示,与正常结肠上皮细胞(NCM460)相比,厌氧消化链球菌有选择性地粘附在结直肠癌细胞系(HT-29和Caco-2)上。我们鉴定了一种厌氧消化链球菌表面蛋白,即假定的细胞壁结合重复序列2(PCWBR2),它通过α2/β1整合素直接与结肠细胞系相互作用,α2/β1整合素是一种经常在人结直肠癌和细胞系中过表达的受体。PCWBR2与整合素α2/β1的相互作用通过磷酸化粘着斑激酶激活结直肠癌PI3K-Akt细胞通路,从而促进细胞增殖和激活核因子活化B细胞轻链增强子(NK-κB),NF-κB反过来会触发促炎反应,例如厌氧消化链球菌处理的Apc Min/+小鼠肿瘤中的细胞因子IL-10和INF-γ水平增加。对厌氧芽孢杆菌处理的Apc Min/+小鼠肿瘤浸润性免疫细胞群的分析显示,与慢性炎症和肿瘤进展相关的髓源性抑制细胞、肿瘤相关巨噬细胞和粒细胞性肿瘤相关中性粒细胞显著扩张。RGDS肽、小干扰RNA或抗体对整合素α2/β1的阻断均能在体内外抑制厌氧消化链球菌的附着,并消除厌氧消化链球菌介导的致癌反应。总之,我们发现厌氧消化链球菌通过PCWBR 2-整合素α2/β1-PI3K-Akt-NF-κB信号轴驱动CRC,并确定PCWBR 2-整合素α2/β1信号轴是CRC潜在的治疗靶点。
1
研究背景
结直肠癌是世界上最常见的癌症之一。它的发生和发展涉及遗传、表观遗传和环境因素之间的复杂相互作用,后者是结直肠癌的主要诱因。新的证据表明肠道微生物可能是促进结直肠癌发展的重要环境因素。大规模的宏基因组测序研究表明,结直肠癌患者的粘膜和粪便微生物群组成与健康人不同。微生物失调在结直肠癌的发病机制中起着重要的作用,已被证实能调节结直肠癌的病理功能,包括细胞增殖、凋亡和免疫反应。一些“驱动”细菌,如产肠毒素的Bacteroides fragilis和Fusobacterium nucleatum被发现与结直肠癌的发展有关。这些微生物可以通过与宿主癌细胞直接相互作用、分泌致癌毒性因子或产生致癌微生物代谢产物来促进肿瘤的发展。因此,对CRC相关致病菌的鉴定和解析具有重要的意义。
为了鉴定与结直肠癌相关的微生物种类,我们最近分别使用宏基因组测序和16S扩增子测序对结直肠癌粪便和粘膜微生物群的组成进行了两次大规模的鉴定,结果发现了结直肠癌或腺瘤富集的细菌菌株,包括已知的与结直肠癌相关的F. nucleatum和Peptostreptococcus stomatis。我们还发现厌氧消化链球菌(P.anaerobius)是一种选择性富集在结直肠癌患者粪便和粘膜中的细菌。厌氧消化链球菌是一种革兰氏阳性厌氧菌,通常生活在口腔和肠道。我们进一步证明厌氧假单胞菌能促进偶氮甲烷处理的小鼠结肠发育不良,并诱导胆固醇生物合成以支持结肠细胞增殖。然而,厌氧消化链球菌在自发性结直肠癌中的作用及其在肿瘤发生中的分子机制仍不清楚。
本研究探讨了厌氧消化链球菌对小鼠自发结直肠癌形成和发展的影响及其分子机制。我们发现厌氧消化链球菌促进ApcMin/+小鼠结直肠癌的发生。厌氧消化链球菌通过其表面蛋白,即假定的细胞壁结合重复序列2(PCWBR2)介导这种作用,它直接与上皮细胞受体整合素α2/β1相互作用,启动激活PI3K-Akt-NF-κB信号级联反应,进而促进细胞增殖和促进炎症的免疫微环境。阻断PCWBR2和整合素α2/β1之间的相互作用可消除厌氧消化链球菌介导的ApcMin/+小鼠结直肠癌。因此,本研究确定了厌氧消化链球菌(P. anaerobius)参与结直肠癌的机制,并确定了PCWBR2-整合素α2/β1相互作用作为结直肠癌潜在的药物靶点。
1
研究结果
厌氧消化链球菌促进ApcMin/+小鼠结肠肿瘤的发生
为了测试厌氧消化链球菌(P. anaerobius)对结直肠癌发生的影响,我们使用了ApcMin/+小鼠,一种自发性结直肠癌的基因小鼠模型。在使用抗生素耗尽微生物群2周后,每天给小鼠灌胃1×108c.f.u.的厌氧消化链球菌,连续灌胃10周。另外两组小鼠(阴性对照)接受非致瘤性肠道微生物灌胃,例如大肠杆菌(E.coli)MG1655(1×108c.f.u.)或PBS,另一组小鼠灌胃F. nucleatum(1×108c.f.u.)作为阳性对照。定量PCR(qPCR)证实接种后厌氧消化链球菌在结肠组织中定植。处理10周后检查结肠肿瘤的多样性和重量。与用大肠杆菌MG1655或PBS处理的模型小鼠相比,厌氧消化链球菌处理小鼠的肿瘤多样性和肿瘤重量显著增加(图1a)。厌氧消化链球菌(P. anaerobius)和F. nucleatum对结肠肿瘤的作用无显著性差异。所有结肠肿瘤均经组织学证实(图1b)。厌氧消化链球菌处理的模型小鼠也显示出显著高于用大肠杆菌MG1655(0%HGD)或PBS(12.5%HGD)处理的模型小鼠的高度不典型增生(63.6%HGD)(图1c)。与大肠杆菌MG1655或PBS组相比,厌氧消化链球菌还增加了模型小鼠小肠的肿瘤大小。这些结果表明厌氧消化链球菌加速了ApcMin/+小鼠结直肠癌的发生。
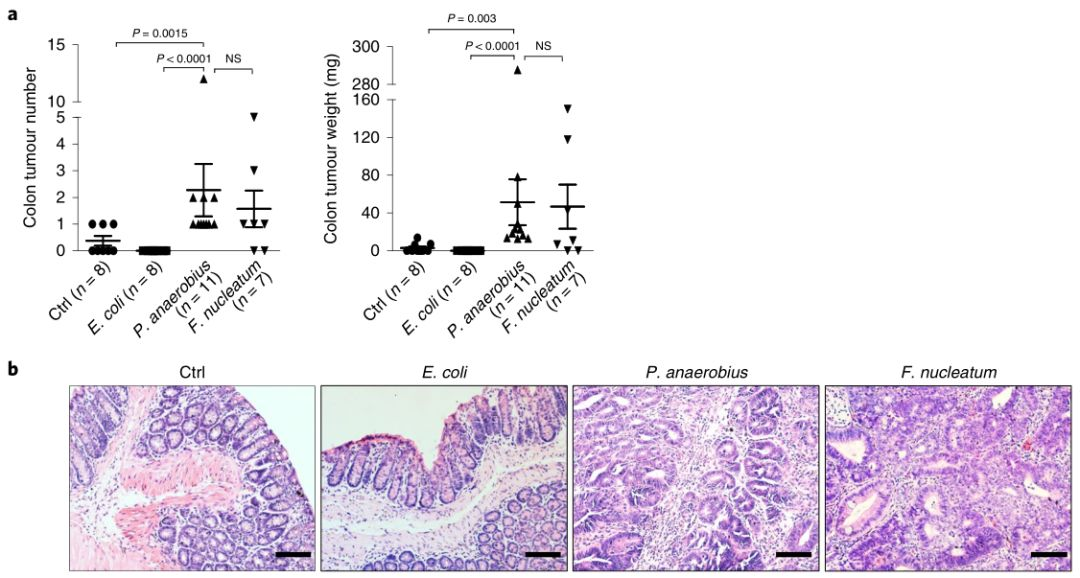
图1 厌氧消化链球菌促进ApcMin/+小鼠结肠肿瘤的发生
厌氧消化链球菌在ApcMin/+小鼠结肠肿瘤组织中定位和富集
鉴于厌氧消化链球菌在ApcMin/+小鼠的组织活检中富集并促进结肠肿瘤的发生,我们推测厌氧消化链球菌可能位于肿瘤或其微环境中。为了检测厌氧消化链球菌的组织定位,我们用厌氧消化链球菌寡核苷酸探针对ApcMin/+小鼠的结肠肿瘤和癌旁组织进行了荧光原位杂交(FISH)。如图1d所示,与相邻的正常组织切片相比,厌氧消化链球菌在结肠肿瘤中富集。此外,qPCR分析证实ApcMin/+小鼠结肠肿瘤中的厌氧消化链球菌水平高于癌旁组织(P=0.0098)(图1e)。

图1 厌氧消化链球菌促进ApcMin/+小鼠结肠肿瘤的发生
厌氧消化链球菌优先附着于结直肠癌细胞系
由于我们证明厌氧消化链球菌在ApcMin/+小鼠结肠肿瘤中定植,我们接下来使用两个结直肠癌细胞系(HT-29和Caco-2)和一个正常结肠粘膜上皮细胞系(NCM460)在体外研究厌氧消化链球菌的粘附特性。细菌附着试验显示厌氧消化链球菌附着在所有三种细胞系上;然而,与NCM460细胞相比,它显著增加了对两种CRC细胞系的附着(图2a)。相比之下,非肿瘤性大肠杆菌MG1655没有明显地附着在CRC细胞系或NCM460细胞系上(图2a)。接下来,我们用透射电子显微镜(TEM)观察厌氧消化链球菌的附着。透射电镜图像证实厌氧消化链球菌附着在所有三种结肠细胞系上(图2b)。大肠杆菌MG1655 作为阴性对照在所有三个细胞系中均未显示出附着(图2b)。此外,荧光标记厌氧消化链球菌的实时成像证实了其直接附着于Caco-2细胞。这些数据表明厌氧消化链球菌可能通过与结肠上皮细胞的直接相互作用发挥其致癌作用,特别是在转化细胞系中。

图2 厌氧消化链球菌通过其表面蛋白PCWbr2附着在结肠细胞上
厌氧消化链球菌表面蛋白PCWBR2与结直肠癌细胞上的整合素α2 /β 1结合。
由于厌氧消化链球菌优先附着于结直肠癌细胞系,鉴定能够与宿主细胞受体结合的表面蛋白对于理解厌氧消化链球菌的发病机制至关重要。利用Far-western blot方法我们从厌氧消化链球菌中鉴定出八种与HT-29细胞生物素化表面膜蛋白相互作用的候选蛋白(图2c),然后将相应的条带通过质谱进行候选互作蛋白质鉴定,在已鉴定的蛋白质中,PCWBR2是唯一的厌氧消化链球菌表面蛋白(图2d)。PCWBR2由762个氨基酸残基组成,预测分子量为81.6kda。在E. coli大肠杆菌和F. nucleatum中,用蛋白质-蛋白质基本局部比对搜索工具未发现具有显著序列相似性的蛋白质。为了验证厌氧消化链球菌PCWBR2蛋白与HT-29和Caco-2细胞系表面膜蛋白的结合,我们使用生物素pull-down实验拉下与生物素标记的HT-29和Caco-2细胞表面膜蛋白相互作用的厌氧消化链球菌表面蛋白,并通过质谱法确认其特性。如图2e所示,PCWBR2被鉴定为主要结合蛋白,总之,这些结果表明PCWBR2可能与HT-29和Caco-2细胞的表面受体结合。

图2 厌氧消化链球菌通过其表面蛋白PCWbr2附着在结肠细胞上。
接下来,我们试图鉴定与PCWBR2互作的HT-29细胞上的相应细胞表面受体。因此,我们在大肠杆菌中过表达谷胱甘肽S-转移酶(GST)标记的PCWBR2(GST-PCWBR2)重组蛋白,并对HT-29细胞膜蛋白进行GST pull-down实验。银染和质谱鉴定出16种与GST-PCWBR2相互作用的候选蛋白。其中,两种膜蛋白被鉴定为整合素α2(带1)和β1(带3)(图3a)。除整合素α2/β1外,anoctamin-1是另一种与PCWBR2相互作用并与结直肠癌相关的表面膜蛋白。然而,验证工作显在4小时共培养后厌氧消化链球菌不促进anoctamin-1的表达。为了验证PCWBR2与整合素α2/β1之间的相互作用,在4个结肠细胞系NCM460、HT-29、Caco-2和SW48中进行了GST pull-down实验。Western blot分析显示,PCWBR2特异性地拉下整合素α2和β1(图3b)。最后,使用纯化的整合素α2和β1蛋白GST pull-down实验证实了整合素α2和β1与PCWBR2的直接相互作用(图3c)。与正常结肠细胞系NCM460相比,整合素α2和β1在结直肠癌细胞(HT-29、Caco-2和SW48)中过表达。我们的研究结果表明厌氧消化链球菌表面蛋白PCWBR2可以通过整合素α2/β1与结肠细胞直接相互作用,尤其是在表达这些受体蛋白的结直肠癌细胞中。

图3 厌氧消化链球菌通过与上皮细胞表面受体整合素α2/β1相互作用附着在结肠细胞上
厌氧消化链球菌通过整合素α2/β1和PCWBR2附着于结直肠癌细胞
接下来,我们研究了PCWBR2-整合素α2/β1在结直肠癌细胞中的作用。由于细菌附着是结肠上皮定植的必要条件,我们首先探讨厌氧消化链球菌附着是否依赖于PCWBR2和整合素α2/β1之间的相互作用。为了研究厌氧消化链球菌在结肠细胞系中的附着是否依赖于PCWBR2与整合素α2/β1的互作,用整合素抑制剂RGDS肽对4株结肠细胞系(HT-29、Caco-2、SW48和NCM460)进行了细菌附着试验。在所有四种细胞系中,RGDS以剂量依赖的方式抑制厌氧消化链球菌附着(图3d)。与这些发现一致,小干扰RNA介导了HT-29、Caco-2、SW48和NCM460细胞中整合素α2和β1的敲除(图3f),并减少了厌氧消化链球菌的附着(图3e)。用抗体阻断整合素α2和β1也可减少厌氧消化链球菌对这些细胞系的附着(图3g)。这些结果表明,PCWBR2通过整合素α2/β1介导厌氧芽孢杆菌的粘附。

图3 厌氧消化链球菌通过与上皮细胞表面受体整合素α2/β1相互作用附着在结肠细胞上
厌氧消化链球菌通过PCWBR2-整合素α2/β1相互作用促进PI3K-Akt-NF-κB信号转导
厌氧消化链球菌增加了HT-29、Caco-2和SW48细胞系的细胞增殖。为了探讨整合素α2/β1下游的信号传导途径,我们对与厌氧消化链球菌共培养的HT-29和Caco-2细胞系进行了基因表达谱分析。厌氧消化链球菌处理后HT-29和Caco-2细胞的RNA测序(RNA-seq)结果显示,与厌氧消化链球菌共培养后,两个细胞系中244个基因(q<0.25)持续上调。在上调的基因中,Itga2和Itgb1被鉴定,进一步强调了它们在厌氧消化链球菌促肿瘤作用中的潜在作用。基因集富集分析显示厌氧消化链球菌介导的基因表达与活性氧途径、顶端连接途径、PI3K-Akt-mTOR信号和胆固醇稳态有关。整合素是顶端连接通路的关键成分,它通过诱导黏着斑激酶(FAK)磷酸化,进而使PI3K的p85亚基磷酸化。因此,我们假设厌氧消化链球菌通过PCWBR2-整合素α2/β1互作从而激活PI3K-Akt途径进而促进肿瘤的发生。为了验证这一点,我们检测了参与PI3K-Akt级联的基因的信使RNA表达,发现PI3K-Akt途径中关键基因包括Itga2、Itgb1、Pi3kr1、Akt1、Nfkb1在用厌氧消化链球菌处理的HT-29、Caco-2和SW48细胞中显著上调。相应地,通过western blot检测到整合素α2/β1、FAK、磷酸化FAK(P-FAK)、PI3K(p85)、P-PI3K(p85)、Akt、P-Akt、NF-κB p65(RelA)和p-p65的蛋白表达也增加(图4a)。增殖细胞核抗原(PCNA)是一种细胞增殖标志物,也被厌氧消化链球菌诱导。
而与整合素抑制剂RGDS肽(图4a)、整合素α2/β1小干扰RNA(图4b)或整合素α2/β1抗体(图4c)联合处理则可消除厌氧消化链球菌诱导的整合素α2/β1-PI3K-Akt-p65信号级联和PCNA蛋白表达。我们的研究结果表明,厌氧消化链球菌通过PCWBR2整合素α2/β1相互作用促进PI3K-Akt-NF-κB信号传导。

图4 厌氧消化链球菌介导整合素β1/α2信号激活Pi3K-Akt途径促进体外细胞增殖,这些作用在ApcMin/+小鼠模型中得到验证。
厌氧消化链球菌激活ApcMin/+小鼠的整合素α2/β1-PI3K-Akt-NF-κB信号级联
接下来,我们试图验证厌氧消化链球菌对模型鼠信号级联的影响。对用厌氧消化链球菌处理的模型鼠结肠肿瘤的qPCR分析显示厌氧消化链球菌处理的肿瘤中Itga2、Itgb1、Akt1和Nfkb1显著上调(图4d)。此外,整合素α2、整合素β1、PI3K(p85)、P-PI3K、Akt、P-Akt、NF-κB p65和P-NF-κB p65的蛋白表达均在厌氧消化链球菌处理的模型鼠的肿瘤中上调(图4e)。这些信号级联的激活是必然的,厌氧消化链球菌处理的模型鼠肿瘤显示细胞增殖增加,这一点可以从PCNA蛋白表达(图4e)和Ki-67+细胞(图4f)高于对照处理组肿瘤得到证明。这些结果与体外观察结果基本一致,从而证实厌氧消化链球菌在体内激活了整合素α2/β1-PI3K-Akt-NF-κB信号级联。

图4 厌氧消化链球菌介导整合素β1/α2信号激活Pi3K-Akt途径促进体外细胞增殖,这些作用在ApcMin/+小鼠模型中得到验证。
厌氧消化链球菌增加ApcMin/+小鼠促炎细胞因子的表达
我们研究了厌氧消化链球菌诱导结直肠癌发生的分子机制。我们用PCR技术分析了厌氧消化链球菌处理后模型小鼠结肠肿瘤炎症反应和自身免疫的84个关键基因的表达。厌氧消化链球菌上调了大多数炎症相关基因(60),只有2个基因被下调(图5a)。我们观察到在厌氧消化链球菌处理后模型小鼠结肠肿瘤中与骨髓源性抑制细胞(MDSCs)(Il10、Ifng、Csf1、Il6、Ptgs2和Nfkb1)、肿瘤相关巨噬细胞(TAM)(Ccl17、Ccl22、Il1r1、Il1a、Cxcl10和Tnf)和肿瘤相关中性粒细胞(TAN)(Cxcl1、Cxcl2、Cxcl5、Tnf、Il17a)相关的免疫标记基因的强烈上调,确认细胞因子上调,如Il10、Ifng(图5b)和Nfkb1(图4d)。综上所述,表明厌氧消化链球菌可以诱导结直肠癌的促炎症反应,这与特定肿瘤浸润免疫细胞群的富集有关。

图5 厌氧消化链球菌改变肿瘤免疫微环境促进结直肠癌。
厌氧消化链球菌改变肿瘤免疫微环境促进结直肠癌的发生
为了直接探讨厌氧消化链球菌对结直肠癌肿瘤免疫微环境的影响,我们使用多色流式细胞术(图5c)分析了从Apc Min/+小鼠结肠分离的肿瘤浸润性免疫细胞的组成。与qPCR结果一致,我们观察到,与对照PBS处理的Apc Min/+小鼠相比,厌氧消化链球菌处理的Apc Min/+小鼠中MDSCs、TAMs和粒细胞TANs显著富集(图5c)。MDSCs是具有免疫抑制活性的肿瘤容许性髓细胞,我们进一步分析了两个亚群的MDSCs,单核MDSCs(M-MDSCs)和粒细胞MDSCs(G-MDSCs);两个亚群在厌氧消化链球菌处理的小鼠中均比对照组增加(图5c)。M-MDSCs主要产生一氧化氮,是TAMs的前体,而G-MDSCs则产生活性氧,并能分化为GTANs,因此我们分析了TAMs,包括M2 like-TAMs和GTANs;结果表明,与对照组相比,厌氧消化链球菌处理的小鼠TAMs和GTANs都得到了富集(图5c)。厌氧芽孢杆菌处理的模型小鼠的肿瘤浸润性细胞毒性T细胞略有增加(图5c)。我们还观察到,与对照组相比,厌氧消化链球菌处理的模型小鼠的调节性T(Treg)细胞和辅助性T17(Th 17)细胞增加。Treg和T17细胞与肠道炎症和CRC以及IL-23和IL-10水平高度相关,这两种细胞在厌氧消化链球菌处理的模型小鼠中均上调(图5a)。
阻断整合素α2/β1可减弱厌氧消化链球菌对Apc Min/+小鼠的促肿瘤和信号传导作用
为了验证PCWBR2整合素α2/β1相互作用在厌氧消化链球菌对模型小鼠促肿瘤作用中的作用,我们通过腹腔注射RGDS肽(每只小鼠200微克,每周三次,持续10周)来阻断整合素α2/β1。结果发现RGDS肽显著降低了用厌氧消化链球菌处理的模型小鼠的结肠肿瘤数量和体重(图6a)。RGDS肽对对照小鼠无明显影响,提示整合素α2/β1在无厌氧消化链球菌的情况下不促进肿瘤的发生。

图6 阻断整合素β1/α2-减弱厌氧消化链球菌相关ApcMin/+小鼠结肠肿瘤的发生
在模型小鼠中厌氧消化链球菌上调的PI3K-Akt途径基因,包括Itga2、Itgb1、Akt1和Nfkb1则被RGDS肽处理(图6b)阻止。此外,RGDS肽下调了厌氧消化链球菌处理的模型小鼠肿瘤中整合素α2、整合素β1、PI3K(p85)、p-PI3K、Akt、p-Akt、NF-κB p65、p-NF-κB p65和PCNA的蛋白表达(图6c)。

图6 阻断整合素β1/α2-减弱厌氧消化链球菌相关ApcMin/+小鼠结肠肿瘤的发生
RGDS肽治疗逆转了厌氧消化链球菌对模型小鼠肿瘤细胞增殖(Ki-67)的影响(图6d)。除了肿瘤的内在反应外,RGDS肽还降低了厌氧消化链球菌相关的促炎因子水平,如Nfkb1(图6b)、Il10和Ifng(图6e)。为了证实炎症在厌氧消化链球菌促进结肠肿瘤发生中的作用,用环氧合酶-2抑制剂塞来昔布治疗小鼠,塞来昔布显著降低了Apc Min/+小鼠中厌氧消化链球菌诱导的结肠肿瘤数量和体重。总之,研究发现证实了整合素α2/β1-PI3K-Akt-NF-κB信号级联在厌氧消化链球菌介导的ApcMin/+小鼠结直肠癌发生中的潜在作用。

图6 阻断整合素β1/α2-减弱厌氧消化链球菌相关ApcMin/+小鼠结肠肿瘤的发生
Reference
Xiaohang Long, Chi Chun Wong, Li Tong, Eagle S. H. Chu, Chun Ho Szeto, Minne Y. Y. Go, Olabisi Oluwabukola Coker, Anthony W. H. Chan, Francis K. L. Chan, Joseph J. Y. Sung & Jun Yu. Peptostreptococcus anaerobius promotes colorectal carcinogenesis and modulates tumour immunity. Nature Microbiology, doi:10.1038/s41564-019-0541-3 (2019).
猜你喜欢
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature Cell专刊 肠道指挥大脑
文献阅读 热心肠 SemanticScholar Geenmedical
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流、快速解决科研困难,我们建立了“宏基因组”专业讨论群,目前己有国内外5000+ 一线科研人员加入。参与讨论,获得专业解答,欢迎分享此文至朋友圈,并扫码加主编好友带你入群,务必备注“姓名-单位-研究方向-职称/年级”。PI请明示身份,另有海内外微生物相关PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。

学习16S扩增子、宏基因组科研思路和分析实战,关注“宏基因组”
 点击阅读原文,跳转最新文章目录阅读
点击阅读原文,跳转最新文章目录阅读
























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








