虽然许多大脑的结构和生化变化以前与年龄增长相关联,但关于神经网络功能属性的研究结果,反映在其电生理特征中,仍然相当有争议。这些差异可能源于多个原因,包括决定α频段总体频谱减慢的多种因素以及节律性和非节律性参数之间的振幅混合。我们使用一个大型数据集(N = 1703,平均年龄70岁)全面研究了多种EEG生物标志物中与年龄相关的变化,同时考虑了节律性和非节律性活动及其对认知表现的个体贡献。虽然我们发现老年人的个体α峰频率(IAF)显著下降,但在控制IAF后,我们没有观察到θ功率与年龄之间的显著关系。IAF不仅随年龄下降,而且在工作记忆任务中的干扰抑制能力与右侧和左侧颞叶主要相关,这表明其在信息采样中的功能作用。关键的是,在控制1/f频谱斜率后,我们没有检测到α功率与年龄之间的显著关系,而后者显示出与年龄相关的变化。因此,这些发现表明,IAF减慢与θ频段功率的纠缠,以及1/f斜率与α功率的测量,可能解释了文献中先前报告的不一致性。最后,尽管没有发现与年龄相关的变化,α功率与右前额叶的处理速度呈负相关,而1/f斜率与认知表现没有一致的关系。因此,我们的结果表明,应考虑多种电生理特征及其相互作用,以全面评估年龄、神经活动与认知表现之间的关联。本文发表在Neuroimage杂志。
关键词:EEG、衰老、周期性、非周期性、认知
亮点
• 大型数据集揭示了与年龄相关的EEG生物标志物和认知变化。
• 个体α峰频率显著下降,主要发生在颞叶。
• 个体α峰频率与工作记忆呈正相关。
• 在控制PSD的1/f衰减后,未见与年龄相关的α功率下降。
• 在老年样本中,α功率与处理速度呈负相关。
1. 引言
老年通常与神经元脑信号的变化及随之而来的认知衰退相关联(Gaál et al., 2010;Meunier et al., 2014;Rossini et al., 2007),然而,许多相互矛盾的研究结果(如下所述)表明,这些参数之间的关联仍然相当不明确。这些差异可能源于多个原因,包括决定α频段一般频谱减慢的多种因素以及节律性和非节律性参数之间的振幅混合。我们使用一个大型数据集(N = 1703,平均年龄70岁)全面研究了多种EEG生物标志物中与年龄相关的变化,同时考虑了节律性和非节律性活动及其对认知表现的个体贡献。
同步放电的金字塔神经元细胞参与在不同频率范围内产生节律性振荡活动,这些活动可以通过头皮脑电图(EEG)(Biasiucci et al., 2019;Buzsáki and Draguhn, 2004;Niedermeyer and Lopes da Silva, 2005)测量,通常由功率、峰值频率和相位定义。尽管所有这些参数以前都与各种认知功能相关联(Buzsáki, 2006;Grandy et al., 2013;Klimesch, 2012, 1999),但不同振荡频段的功率和峰值频率的变化在衰老中的研究也非常广泛(Ishii et al., 2017;Knyazeva et al., 2018;Knyazev et al., 2015)。
先前的研究表明,θ和α振荡(大约4-7 Hz和8-12 Hz,分别)在认知功能中起着重要作用(Buzsáki and Draguhn, 2004;Palva and Palva, 2007;Puma et al., 2018)。它们在高级认知过程中的参与通过对信息处理的自上而下控制来解释:α和θ频段的振荡活动之间的相互作用能够抑制任务无关的信息,帮助将注意力引导到任务相关的刺激上(Jensen et al., 2002;Klimesch, 2012;Palva and Palva, 2007)。α振荡的功率和峰值频率与大脑的结构和神经化学变化相关联,这在老年人中尤为显著(Babiloni et al., 2006;Kumral et al., 2021;Stomrud et al., 2010)。尽管大多数研究一致显示个体α峰频率(IAF)随年龄显著减慢(Ishii et al., 2017;Knyazeva et al., 2018;Mizukami and Katada, 2018),但关于θ和α振荡功率变化的先前发现并不一致:有研究表明α功率随年龄下降(Lodder and van Putten, 2011;Rossini et al., 2007),也有研究表明α功率没有与年龄相关的变化(Caplan et al., 2015;Sahoo et al., 2020),而θ功率既有随年龄下降(Vlahou et al., 2015)的研究,也有随年龄上升(Babiloni et al., 2006;Ishii et al., 2017;Klass and Brenner, 1995)的研究。
一方面,这些不一致性可能是由于在典型的、严格预定义的频段中进行功率估计所致:如果未考虑可能的中心频率偏移(即频谱减慢以IAF下降表示的情况),那么在不同但相邻频段中的两个信号的功率估计可能会混淆。例如,有研究建议IAF的减慢可能会干扰传统的θ频段,从而由于存在低频α峰而导致虚假的功率增加(Finnigan and Robertson, 2011)。这可能潜在地解释了与θ功率随年龄变化相关的研究结果不一致的现象。
慢波功率估计不仅可能因中心频率偏移而混淆,还可能由于振荡性(即节律性)和非振荡性(即非节律性)活动之间的振幅混合而受到影响(Donoghue et al., 2020;Voytek et al., 2015)。非节律性活动源自神经元群体的不同步放电和突触后电位(Donoghue et al., 2020;Ouyang et al., 2020),可以通过功率谱密度(PSD)的1/f斜率进行估计。PSD的非节律性成分反映了兴奋性和抑制性输入之间的比例,分别由谷氨酸能和GABA能连接决定(Donoghue et al., 2020;Gao et al., 2017;Wang, 2020)。相比于抑制性连接数量的增加导致PSD斜率变陡,兴奋性连接数量的增加则与PSD斜率变平有关。这一关系进一步得到了药理学干预研究中改变意识状态的支持(Colombo et al., 2019;Lendner et al., 2020)。关于1/f斜率的年龄相关变化,少数先前的研究表明随着年龄的增长,斜率减小,表明兴奋性和神经噪声增加(Dave et al., 2018;Voytek et al., 2015)。然而,这一关系是在包括年龄相差多达50年的个体群体中观察到的,并未在例如更为同质的老年个体的较窄年龄范围内进行一致的研究。因此,需要在更为同质的老年个体样本中进一步研究与年龄相关的变化。
重要的是,在控制PSD的1/f衰减(分解PSD的振荡性和非振荡性估计)后,未发现慢波(<12 Hz)功率与年龄相关的变化(Caplan et al., 2015)。此外,只有少数研究探讨了通过1/f斜率估计的非振荡性活动与认知的关联:它与认知速度(Ouyang et al., 2020)、词汇预测(Dave et al., 2018)和视觉工作记忆(Voytek et al., 2015)相关联。
鉴于这些发现,本研究旨在解开节律性和非节律性静息态EEG(rsEEG)参数、年龄与认知之间的复杂关系。我们有独特的机会在一个由1700多名老年参与者组成的大样本中研究这一问题,这使我们能够在单一统计模型中估计所有上述测量的个体贡献,并包含更多的预测变量。我们假设,在仔细调整方法学混杂因素(如频谱减慢和节律性与非节律性PSD成分之间的振幅混合)后,不会观察到θ和α功率的与年龄相关的变化。此外,基于先前的文献,我们还假设IAF和1/f斜率会随着年龄的增长而下降,并且这两个参数都将与认知表现呈正相关。我们的目标是扩展先前的研究,并通过在年龄跨度连续的60至80岁老年个体群体中研究这一关系来做出贡献。
2. 材料与方法
2.1. 参与者
本研究所使用的数据来自基于人群的LIFE-Adult数据集(莱比锡文明疾病研究中心,莱比锡大学;Loeffler等,2015)。参与者随机从居住登记处选取,所有同意参加研究的参与者均提供了书面知情同意,并获得了金钱补偿。该研究获得了莱比锡大学医学院伦理委员会的批准。
共有3390名参与者提供了脑电图(EEG)数据。我们的研究纳入标准包括完成认知测试(详见第2.4.1节)、右利手、无脑出血、脑震荡、颅骨骨折、脑手术或脑肿瘤病史,以及未使用影响中枢神经系统的药物。我们还控制了静息状态记录的警觉性(详见第2.2节),以确保整个样本在唤醒和困倦水平上的均一性。在应用这些标准后,最终样本包括1703名受试者的数据集(平均年龄=70岁,标准差=4.7岁,女性880名)。
2.2. 静息态EEG记录与预处理
在电磁屏蔽和隔音的EEG房间内,使用31通道Ag/AgCl头皮电极(Brain Products GmbH)记录了20分钟闭眼的静息态EEG数据。电极根据国际标准10–20扩展定位系统安装在弹性帽(easyCAP,德国赫尔辛)上。信号通过QuickAmp放大器(Brain Products GmbH)进行放大。此外,两个电极记录了右眼上方和下方的垂直(vEOG)和水平(hEOG)眼动。一个双极电极连接到左右前臂记录心电图(ECG)。所有电极以共平均参考方式引用,AFz作为接地电极。电极阻抗保持在10kΩ以下,采样率为1000 Hz,数据经过280 Hz的低通滤波。更详细的描述可参见Jawinski等人的论文(Jawinski等,2017)。
EEG数据使用基于MATLAB的EEGLAB工具箱(版本14.1.1b)和自定义脚本进行预处理。首先,数据通过1至45 Hz的带通滤波器(4阶巴特沃斯滤波器前后应用)和50 Hz的陷波滤波器以去除任何残留的电源干扰。然后,数据下采样至500 Hz。我们从数据集中排除了vEOG、hEOG和ECG通道,并对所有受试者的多通道数据的功率谱密度(PSD)进行了视觉检查,以确定数据是否被噪声污染并识别损坏的通道。
使用半自动化流程标记并移除由肌肉活动或非生物噪声污染的片段。为此,我们在慢频(1–15 Hz)和高频(15–45 Hz)范围内设置了不同的幅度阈值水平用于噪声检测。对于慢频范围,个体噪声阈值定义为滤波信号平均幅度的三倍标准差。对于高频范围,我们设置了恒定的幅度阈值40µV。对于总坏段长度超过60秒的记录,进行了视觉检查以确认标记的片段确实被噪声污染。应用独立成分分析(ICA,Infomax算法(Bell和Sejnowski,1995))并移除了与眼动、心跳和肌肉活动相关的伪影。
静息态EEG记录会随着时间的推移从警觉状态转变为昏昏欲睡甚至入睡,这些不同的脑觉醒阶段导致参与者的觉醒和警觉性存在异质性。因此,我们仅使用根据莱比锡警觉性算法(VIGALL 2.0,Huang等,2015;Jawinski等,2017)分类为“清醒休息”的记录片段。VIGALL是一种自动算法,已在Brain Vision Analyzer 2(Brain Products GmbH)中实现,它将静息态EEG记录的每一秒段分类为七个类别,对应从高度警觉到入睡开始的估计脑觉醒水平。觉醒水平由不同频段的功率、EOG通道活动、睡眠纺锤波以及这些参数的拓扑分布共同决定。根据VIGALL分类,A阶段定义为清醒休息,这基于α频段的电流密度活动分布的存在(详细信息请参见手册)。VIGALL的各个阶段已成功与自评的入睡可能性(Jawinski等,2017)和自主神经系统活动(Huang等,2018)相关联。在本研究中,我们纳入了至少有5分钟被分类为A阶段的静息态EEG数据的参与者。基于这一标准,967名参与者的警觉静息态EEG记录时间不足。为了可比性,我们控制了参与者之间记录长度,并分析了每个记录的前5分钟数据。
2.3. EEG数据分析
2.3.1. 功率谱密度的节律性和非节律性成分
每个通道的数据的功率谱密度(PSD)是使用Welch方法,通过4秒汉明窗并以50%的重叠率从清理后的数据中计算得出的。我们在PSD上使用了FOOOF算法(Donoghue et al., 2020)的Python(版本3.6.7)实现,分别估计每个通道的1/f衰减斜率:在此,2至40 Hz的宽带PSD被建模为

,其中γ 是频谱斜率(见图1)。我们未使用knee参数。由于该算法在PSD的1/f衰减之上模拟高斯峰,并在原始数据的峰值非高斯时拟合两个高斯峰,因此我们未使用FOOOF算法提取的周期性成分特征。
从原始PSD中减去1/f部分后,我们在7至13 Hz之间进行了峰值搜索,以定位每个通道的α峰。当该频率范围内PSD的倾斜度(定义为大于其邻近数据点的数值点)超过0.05 μV²/Hz时,认为检测到一个峰值。如果在感兴趣的频率范围内发现多个峰值,我们总是选择最显著的峰值。为了定义峰宽,我们在峰值显著性(prominence)的10%处向左右两侧延伸一条水平线。如果峰宽超过6 Hz,我们将其设定为以峰值最大值为中心的3 Hz范围。如果未能检测到峰值,则不对该特定通道的功率进行估计。然后,我们将α功率计算为检测到的α峰起始点和结束点之间残余PSD下的面积。该测量值为每个参与者的每个通道计算,并用于与认知评分(详见第2.4节)进行进一步分析。在当前研究包含的整个样本(N = 1703)中,1名参与者在所有通道中均未检测到α峰,且13名参与者在超过15个通道中未检测到峰值。
我们还在4至7 Hz之间进行了峰值搜索,以使用与α峰检测相同的标准估计θ峰参数。仅约3%的参与者在此范围内具有振荡器类型的峰值。我们将此结果与FOOOF算法获得的结果进行了比较。基于FOOOF峰值参数化,在我们研究的1703名参与者中,781名在任何通道中均未检测到θ峰,1015名参与者在11个额前和额前中央通道中均未检测到可检测的θ峰。因此,我们在α峰的起始点和其前3 Hz之间的频率范围内估计了θ功率。由于减去1/f可能导致PSD残余部分出现负值,因此在该范围内的功率估计使用了包含非节律性成分的原始PSD。
我们基于四分位距范围(IQR)检查了数据中的异常值。我们将异常值定义为超过

的数据值,其中q3是α和θ功率的第三四分位数,并且对于1/f斜率值的负偏态数据,我们额外使用了
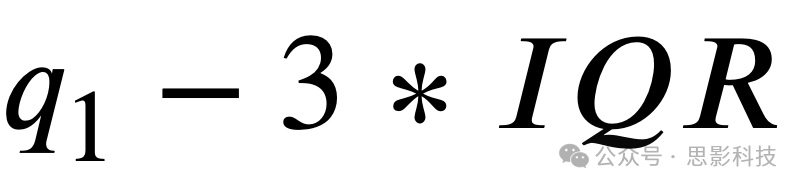
的区间,其中q1是第一四分位数。
2.3.2. EEG源重建
对于传感器层面上的每一个显著关系,我们进行了源定位。我们为那些接受过MRI扫描的参与者(约700人)构建了个体头模型,并为其余受试者使用了标准头模型。对于个体头模型,我们使用了通过3特斯拉Verio扫描仪(西门子,埃尔朗根,德国)获取的T1加权MPRAGE图像,并使用Freesurfer v.5.3.0软件(Fischl, 2012)进行了分割。利用Brainstorm(Tadel等,2011)构建了一个三壳层边界元模型,并使用OpenMEEG(Gramfort等,2010)计算了引导场矩阵。标准头模型基于Brainstorm中包含的ICBM152非线性平均头部解剖(版本2009)。电极位置根据10–20电极放置法注册到标准头部的头皮表面。对于个体头模型,电极位置使用SPM(Frackowiak等,1997)从标准解剖结构扭曲到个体解剖结构。在所有情况下,源空间由位于皮质覆盖层上的约2000个体素组成。我们将偶极源的方向限制为垂直于皮质表面。源重建使用精确低分辨率脑电磁断层扫描(eLORETA)(Pascual-Marqui, 2009)进行,正则化参数为0.05,并在汉堡的M/EEG工具箱(METH)中实现。由于EEG通道数量较少(N = 31),我们将皮质顶点分组为10个主要区域(ROI),这些区域基于Desikan-Killiany图谱的68个区域进行聚合(Desikan等,2006):我们对θ和α功率使用几何平均,对IAF使用众数,对1/f斜率使用中位数。其余分析方式与第2.3.1节中描述的方法相同。
2.4. 认知测验
2.4.1. 认知测试描述
我们使用了四项认知测试的数据:Trail Making Test(TMT;Reitan, 1956)、Stroop测试(Scarpina和Tagini, 2017)、韦克斯勒记忆量表(Wechsler, 2009)和词汇知识测试(原名Wortschatztest, WST;Schmidt和Metzler, 1992)。这些测试被用作处理速度、心理灵活性、干扰抑制、记忆和晶化智力的代理指标。为了便于解释,我们将反应时间分数(1/s)进行反转处理,使得较高的分数表示更好的表现。我们对认知分数进行了视觉检查,以排除可能的异常值,并在发现与输入错误相关的值时移除数据。随后,在移除异常值后,我们对所有分数进行了Z转换。
2.4.2. 认知测验的因子分析
我们使用探索性因子分析(EFA)提取认知量表背后的潜在因子(使用R统计软件包(版本3.4.4))。潜在因子的数量通过碎石图(Scree plots)以及经验凯撒标准(Empirical Kaiser Criterion, EKC;Braeken和van Assen, 2017)确定,根据EKC,只有特征值大于一的成分应被保留。碎石图和EKC均建议保留三个潜在因子,这三个因子解释了数据中67%的方差。这三个因子被用于进一步的统计分析。
2.5. 统计分析
2.5.1. 静息态EEG参数与年龄的关系
为了检验PSD成分与年龄之间的关系,我们采用了大规模双变量方法和基于簇的统计(Maris和Oostenveld, 2007),以校正跨通道的多重比较。对于每一个静息态EEG参数与每个通道中年龄之间的关系,我们使用了Pearson偏相关。我们控制了其他三个PSD变量以及性别(作为“男性”和“女性”二元选择)和教育水平的影响。然后,在传感器空间中形成簇,定义为几个相邻通道,其显著性阈值为p<0.05。如果发现簇,则将簇的t值(通过对形成簇的电极的t值求和估计)与使用蒙特卡洛方法生成的簇的零分布进行比较,该方法对年龄值进行了1000次置换。通过将原始簇的t值与随机生成的簇进行比较,我们确定了相应的簇p值(p_cluster)。如果p_cluster≤0.0125(Bonferroni校正),则认为该簇具有显著性。
在研究1/f衰减减去前(即从原始PSD)α功率与年龄的关系时,我们控制了IAF、性别和教育水平。然而,我们没有控制θ功率——由于θ频段缺乏振荡峰值,θ功率会捕捉到我们希望保留的1/f斜率的属性。我们还评估了两个簇的显著性,这两个簇描述了α功率与年龄之间的关系,以探讨大脑皮层的哪些区域可能最为敏感。
2.5.2. 静息态EEG参数与认知的关系
为了检验静息态EEG参数与三个认知因子之间的关系,我们使用了多元线性回归(MLR),并在回归模型中加入了年龄与感兴趣的静息态EEG参数的交互项,使用R中实现的lm函数。由于大脑区域之间存在高度多重共线性,我们为每个认知因子和10个ROI分别运行了独立的MLR。多重共线性可能会影响模型,因为独立变量对因变量的影响无法在孤立情况下可靠地估计。因此,每个MLR模型包含四个感兴趣的独立变量(θ功率、α功率、IAF和1/f斜率),以及它们与年龄的交互项。年龄、性别和教育水平作为协变量被添加到模型中。我们使用错误发现率(False Discovery Rate, FDR)在0.05水平上进行了多重比较校正(Benjamini和Hochberg, 1995)。
3. 结果
3.1. 描述性信息
我们分析了1703名参与者的数据(平均年龄=70岁,标准差=4.7岁,女性880名):人口统计信息和样本特征可见于补充材料的表1,分别针对男性和女性。静息态EEG特征的总平均拓扑图见图1。
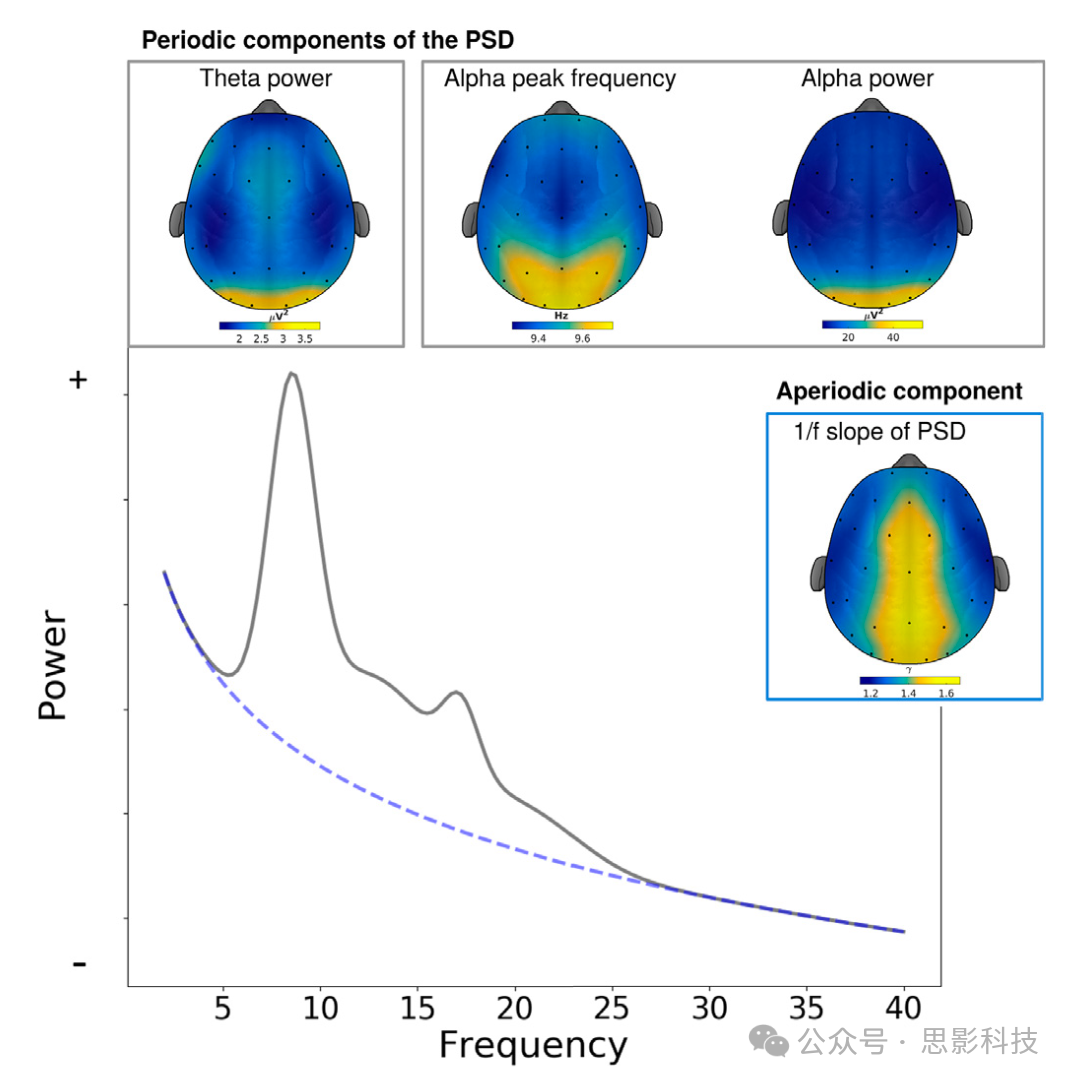
图1. 单个EEG通道的示例功率谱密度和静息态EEG参数的总平均拓扑图:θ和α功率、个体α峰频率(IAF)以及PSD衰减的1/f斜率(用虚线蓝线标出)。
θ和α功率、IAF以及PSD的1/f斜率之间显示出强相关性,且在整个大脑皮层范围内具有广泛的影响(所有p<0.001,rho值介于0.3到0.7之间,p值基于Pearson相关,电极簇通过簇统计法校正多重比较,见补充材料)。
3.2. 与年龄相关的静息态EEG频谱变化
我们采用大规模双变量方法和基于簇的置换检验(Maris和Oostenveld, 2007)来评估传感器空间中rsEEG参数是否存在与年龄相关的变化。重要的是,在控制1/f斜率之前,α功率显示出与年龄相关的下降(图2,A面板),在额叶(p_cluster=0.055)和枕叶(p_cluster=0.038)区域有两个簇。然而,当从去趋势后的PSD(即减去1/f衰减后)估计α功率时,没有观察到显著的簇,表明上述结果可能捕捉到的是1/f斜率的与年龄相关的变化,而非α振荡功率的变化。
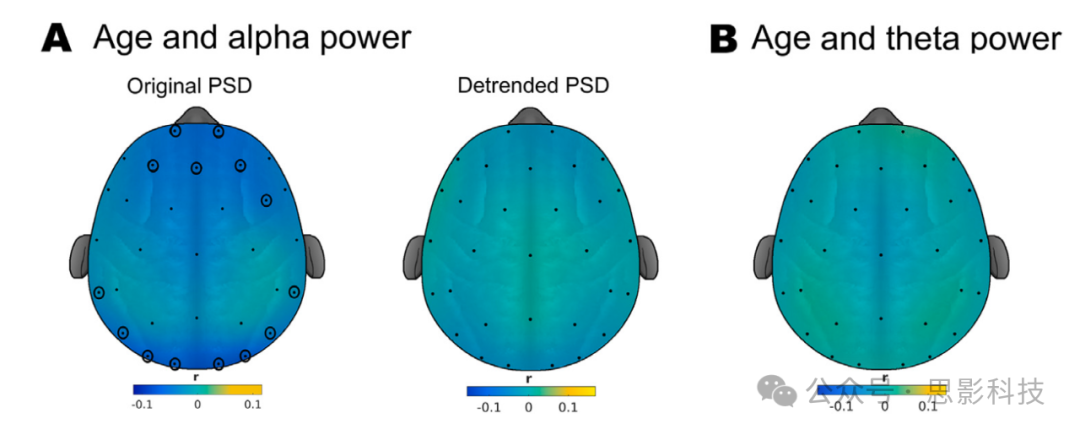
图2. α和θ功率的与年龄相关的变化。拓扑图显示了相关系数,显著的传感器用黑色圈点标出。(A)α功率主要在额叶和枕叶区域随年龄下降,然而,当控制1/f频谱衰减后(即在去趋势后的PSD上测量),这种关系消失。(B)θ功率未观察到显著的与年龄相关的变化。
IAF与年龄之间存在广泛的负相关关系(p_cluster<0.001,图3,A面板),在所有电极上均有表现。此结果在源层面得到了验证,在所有10个ROI中该关系均显著,其中左颞叶显示出最强的效应(p<0.001,r=−0.22)。另一个显示1/f斜率与年龄之间负相关关系的电极簇在传感器空间的额中央电极上被检测到(p_cluster=0.012,图3,B面板)。源重建显示,在右额叶检测到了显著的关系(p=0.001,r=−0.08)。
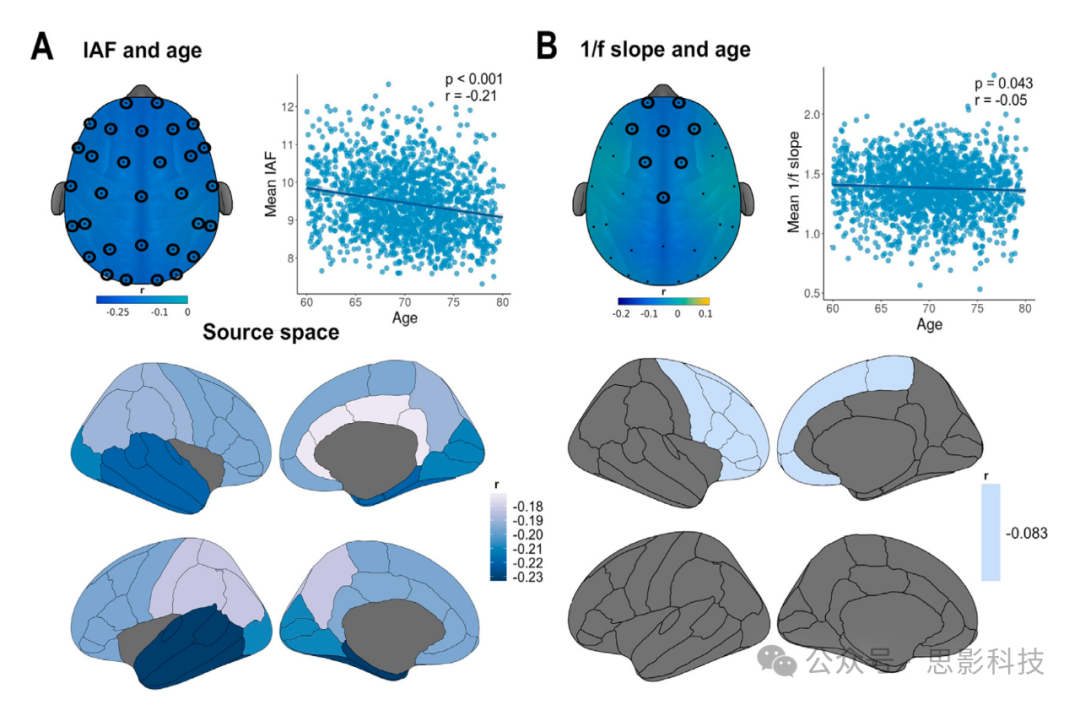
图3. 传感器空间和源空间中静息态EEG参数的与年龄相关的变化。形成显著簇的传感器用黑色圈点标出。散点图显示了显著EEG传感器的平均值。
(A)个体α峰频率(IAF)与年龄显著负相关,这一关系在传感器空间和源空间的整个皮质覆盖层上尤为显著。
(B)功率谱密度的1/f斜率在传感器空间的额中央通道和源空间的额叶与年龄呈负相关。
其他rsEEG参数(即θ功率和控制1/f衰减后的α功率,见图2)在传感器空间和源空间均未显示出显著的与年龄相关的变化。由于传感器空间的发现与源空间的发现一致,后续分析中使用了源空间数据。
3.3. 认知表现
3.3.1. 因子分析
基于因子载荷(>0.4),我们将三个因子解释为代表处理速度、情节记忆和干扰抑制。第一个因子——处理速度,正载荷于斯特鲁普任务中一致性和不一致性试验的反应时间。第二个因子,与情节记忆相关,正载荷于韦克斯勒记忆量表的逻辑记忆子量表。最后,第三个因子反映干扰抑制,正载荷于斯特鲁普任务中不一致性试验的准确率,负载荷于相同条件下反转的反应时间。将第三个因子解释为干扰抑制基于斯特鲁普干扰效应下认知需求增加,导致反应时间变慢但准确率提高(见图4,A面板)。识别出的三个因子分别对应注意力、记忆和执行功能的主要认知领域。
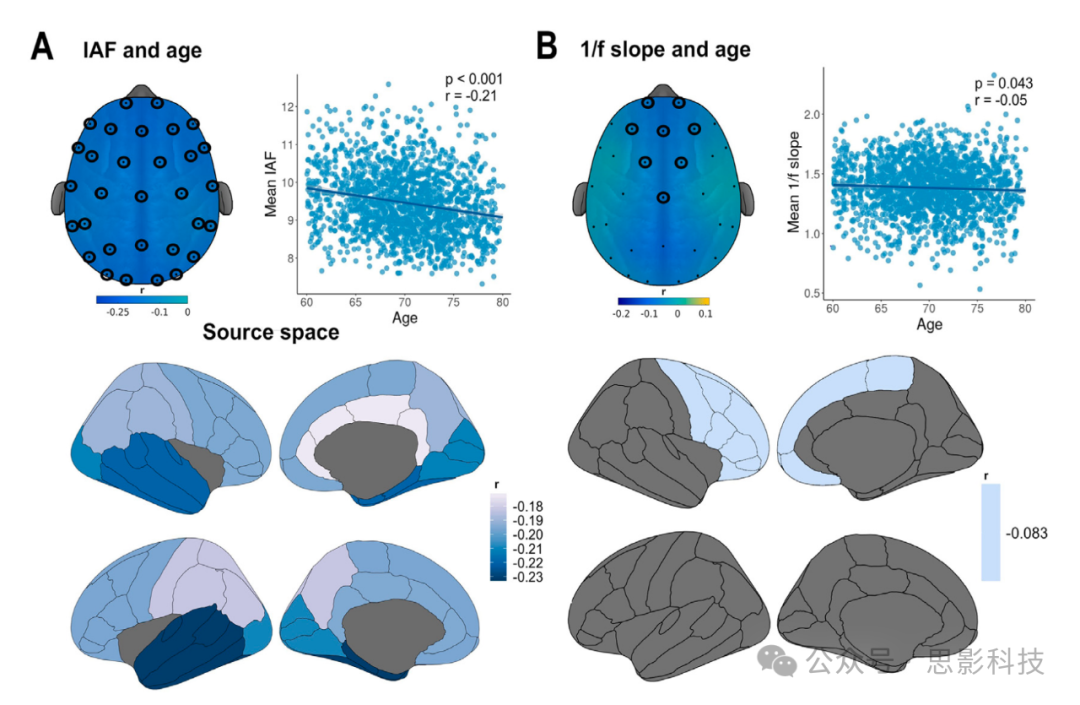
图4. 认知测验中提取的三个潜在因子,分别代表情节记忆、处理速度和干扰抑制。(A)相关矩阵显示认知测验中的大多数子量表彼此之间存在中等相关性。右侧的载荷强度表示特定量表对因子的贡献。(B)所有潜在因子均随年龄增加而下降。
3.4. 年龄与认知表现的关系
所有三个因子均表现出随着年龄增长显著下降(处理速度:p<0.001,rho = −0.12;情节记忆:p<0.001,rho=−0.1;干扰抑制:p<0.001,rho=−0.16;见图4,B面板),并被用于以下的多元线性回归(MLR)模型。
3.5. 静息态EEG参数与认知表现的关系
为简化报告,我们仅在此报告统计显著的区域的结果(所有MLR模型的输出可见于补充材料的表1–10)。评估干扰抑制因子与静息态EEG参数之间关系的模型(模型统计:调整后R²范围为0.03到0.04;F(1557)范围为5.1到7.1,p<0.001;见图5,A-B面板)显示在六个区域中,IAF与干扰抑制因子呈正相关:右额叶(p<0.01,β=0.07)、右顶叶(p<0.01,β=0.08)、左顶叶(p<0.01,β=0.07)、右颞叶(p<0.001,β=0.09)、左颞叶(p<0.01,β=0.08)和右扣带皮层(p<0.01,β=0.07)。此外,年龄与该因子呈负相关(p<0.001,β范围为−0.14到−0.15),教育水平与该因子呈正相关(p<0.01,β范围为0.07到0.08)。
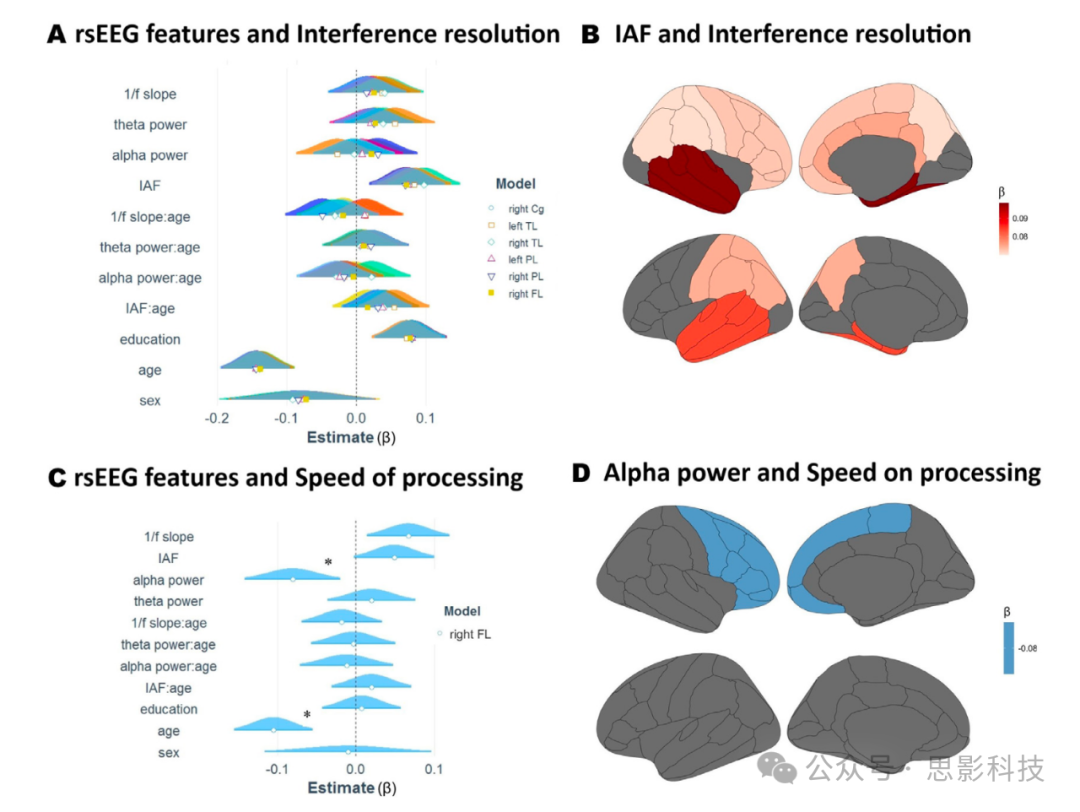
图5. 静息态EEG参数与认知之间的关系。
(A)基于线性模型,个体α峰频率(IAF)与代表干扰抑制的因子显著相关。图中显示了标准化预测变量的估计值及其在不同区域由颜色指示的置信区间分布。交互项以冒号表示,显著效应以星号标出。
(B)图(A)中观察到的IAF与干扰抑制之间的正相关关系在源空间的皮质覆盖层上进行了绘制。
(C)α功率与另一个代表处理速度的因子呈负相关。这一效应在右额叶显著,但在其他区域不显著。
(D)图(C)中显著关系在源空间上的绘制。
模型分析结果
代表处理速度因子的模型显示α功率与之呈显著负相关(p<0.01,β=−0.08;见图5,C-D面板),该效应主要存在于右额叶区域(模型统计:调整后R²=0.017;F(1557)=3.41,p<0.001)。在该模型中,年龄也与该因子呈负相关(p<0.001,β=−0.11)。其他自变量以及静息态EEG参数与年龄之间的交互项均未达到显著性。
代表情节记忆因子的模型显著(模型统计:调整后R²范围为0.061到0.068;F(1557)范围为10.35到11.36,p<0.001),然而,这些模型未显示与静息态EEG测量值的相关性。
4. 讨论
本研究调查了节律性(即θ功率、α功率、IAF)和非节律性(即1/f斜率)静息态EEG活动如何与老化和认知相关联,在一个由大量健康老年参与者组成的队列中进行。将周期性和非周期性成分分离后,我们有四个主要发现:
1.IAF随年龄下降:这一效应在整个皮质范围内稳健观察到,但在左颞叶最为显著;
2.1/f斜率的年龄相关变化:观察到PSD的1/f斜率随年龄变化,表明右额叶斜率趋平;
3.慢波功率未见显著变化:在慢波功率(α和θ频段)方面未见显著的与年龄相关的变化,这与之前的若干报告相反;
4.静息态EEG参数与认知表现的关联:将静息态EEG参数的个体贡献与认知表现相关联,右额叶的α功率与处理速度呈负相关,而多个皮质区域的较高IAF有助于更好的干扰抑制。
在当前研究中,我们使用了多种方法,仔细控制了非周期性和周期性成分的振幅混合、IAF的减慢以及EEG记录的警觉性,这在之前的研究中尚未得到一致控制。
4.1. 年龄相关的静息态EEG参数变化
在本研究中,我们显示了IAF随年龄显著下降,这与先前关于年龄相关频谱减慢的报告一致(Ishii et al., 2017;Knyazeva et al., 2018;Mizukami and Katada, 2018)。峰频率减慢可能反映了神经传递水平的变化以及轴突传导速度的降低(Dustman et al., 1993;Hong and Rebec, 2012)。这可能导致皮层内回路中的时间延迟延长,从而导致IAF减慢。尽管本研究的参与者没有任何神经系统疾病,α峰的减慢仍可能表明与年龄相关的神经退行性疾病早期亚临床阶段的神经过程,这些疾病的患病率随着年龄的增长而增加。这一发现与观察到较高的IAF可能有助于更好的认知,特别是干扰抑制形成对比。
神经元之间轴突连接的变化不仅可以影响IAF,还可以影响高频范围内神经放电率的补偿性增加(Hong and Rebec, 2012),从而导致1/f斜率趋平。与这些发现以及先前关于1/f斜率随年龄变化的报告一致(Dave et al., 2018;Voytek et al., 2015),我们的结果表明斜率趋平可能反映了皮层兴奋性的增加和老年额叶区域可能的过度招募(Davis et al., 2008;Nyberg et al., 2010)。重要的是,尽管分析的年龄范围不同,我们的发现与之前的报告一致。之前的研究比较了年轻(20–30岁)与老年(60–70岁)参与者,而我们在60至80岁较窄的年龄范围内观察到了相同的效应。
尽管有多项报告指出整个生命周期内(Rossini et al., 2007;Vlahou et al., 2015)以及仅在老年范围内(Lodder and van Putten, 2011)θ和α频段功率随年龄变化,但我们未观察到这些参数的显著变化。这些功率未变化可能是由于方法学上的差异:
1.基于中心频率的个体调整感兴趣频段;
2.PSD的节律性和非节律性成分之间的解离;
3.这些参数的独特贡献的估计。
事实上,我们还显示,当未控制PSD的1/f衰减时,在额叶和枕叶区域可以观察到α功率的下降,且显著性水平更为宽松。这一发现表明,先前关于α功率随年龄变化的报告可能是由于PSD的节律性和非节律性成分的混合。此外,θ功率未随年龄变化也可能表明,之前显示两者之间显著关系的报告可能与IAF减慢有关。与我们的发现一致,Caplan及其同事(Caplan et al., 2015)在控制非节律性活动(即1/f斜率)后,未观察到θ和α频段功率的任何与年龄相关的变化。虽然作者报告在α频段检测到节律性活动,但在控制非节律性活动后,其未随年龄变化。
4.2. 静息态EEG参数与认知的关联
针对第二个研究问题,我们旨在探索静息态EEG参数与老年认知之间的关联。我们发现右额叶的α功率降低与较高的处理速度有差异性关联。静息状态下,α功率被认为反映了注意过滤器的特性,这可能与在满足任务需求时抑制任务无关信息的能力相关(Händel et al., 2011;MacLean et al., 2012)。之前有研究将α频段的任务相关功率减少与兴奋性增加相关联(Iemi et al., 2019;Klimesch et al., 2007)。与这些先前研究一致,我们认为右额叶的α功率降低可能代表了一个允许自上而下控制的网络的兴奋性增加。该区域兴奋性的增加可能与对刺激的冲动和快速反应有关,而以牺牲准确性为代价(由处理速度表示),并可能作为老年额叶区域功能性“过度招募”的另一种支持(Davis et al., 2008;Nyberg et al., 2010)。此外,与我们的发现一致,先前的报告也建议老年期间抑制性活动减弱(Borghini et al., 2018;Dustman et al., 1993)。虽然本研究中使用的其他参数(例如IAF和PSD的1/f斜率)也与兴奋性相关,但我们已控制了它们对相应认知功能的可能影响。
研究表明,不仅α功率,而且瞬时IAF也与兴奋/抑制平衡和信息处理相关,特别是在视觉领域(Nelli et al., 2017;Samaha and Postle, 2015)。虽然我们发现IAF随年龄显著下降,但我们也观察到IAF与工作记忆任务中的干扰抑制相关。双侧扣带皮层、左右顶叶和颞叶以及右额叶的较高IAF与更好的干扰抑制相关,特别是依赖于斯特鲁普干扰效应的任务。此前有研究建议较高的IAF与视觉信息的更细致时间采样相关(Samaha and Postle, 2015),这一点也在跨模态领域得到证明(Cecere et al., 2015)。作者建议,在临近刺激的时间窗口内,α周期的数量有助于分离(与整合相对)离散感知(Samaha and Postle, 2015)。因此,我们的发现表明,较高的IAF对应于在给定刺激呈现时间窗口内的更多振荡周期,与较慢的IAF相比,它可能也促进了来自两个干扰域的信息分离——即斯特鲁普任务中词语的颜色和语义。考虑到老年IAF的下降及其与干扰抑制的显著关系,我们的观察结果与显示老年期间忽视和抑制干扰信息能力下降的研究一致(Li et al., 2001)。
5. 结论
综上所述,我们的结果证明,在估计静息态EEG中与年龄相关的变化时,需要考虑PSD的节律性和非节律性成分。这对于不同频段的功率估计尤为重要:我们显示,当未控制1/f频谱衰减时,α功率的变化可能是由于PSD的节律性和非节律性成分的混合所致。虽然在去趋势PSD后,我们未观察到θ或α频段功率的先前报告的减少,但我们确认了整个皮质覆盖层中IAF与年龄之间持续的负相关关系。此外,较高的IAF也与更好的干扰抑制相关:这一发现表明,较高的IAF可能促进老年期间干扰信息的分离。PSD的1/f频谱斜率的年龄相关变化以及静息态α功率与处理速度之间的关联可能表明右额叶兴奋性的增加,这可能导致对刺激的更冲动反应。在功能层面上,我们的发现因此支持了老年大脑功能重组的概念,右额叶区域可能出现过度招募(Davis et al., 2008;Nyberg et al., 2010)。值得注意的是,我们使用VIGALL算法控制了静息态EEG记录的警觉性,该算法已在本研究中使用的同一组老年参与者样本上开发和验证。
5.1. 局限性
在本研究中,我们调查了将静息态EEG数据PSD的周期性和非周期性成分分离对衰老文献中常见发现的影响。将这些发现扩展到任务相关的EEG数据以及其他频段将有助于进一步研究这些考虑因素。我们的数据集包含的参与者年龄范围相对较窄,需要进一步研究以在其他年龄组中调查这些发现。此外,鉴于我们选择的神经影像方法,我们无法将我们的发现与衰老文献中常见的其他神经生物学变化联系起来,这将有助于全面理解大脑随年龄变化的全貌。最后,我们使用VIGALL算法对参与者的警觉性进行了分类和控制,然而,之前的研究未对此进行控制,因此直接比较具有一定困难,因为这些研究中警觉性的影响尚未得到充分解答。





















 3192
3192

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








