Molecular cloning and characterization of three phenylalanine ammonia-lyase genes from Schisandra chinensis
五味子中三种苯丙氨酸解氨酶基因的分子克隆及特性分析

摘要
苯丙氨酸解氨酶(PAL)催化L-苯丙氨酸向反式肉桂酸的转化,是植物和微生物中苯丙烷类生物合成途径中一个重要的关键酶,也是初级代谢与次级代谢之间的连接步骤。五味子(Schisandra chinensis)是一种属于木兰科的木质藤本植物,其二苯并环辛烷木脂素含量丰富,并表现出显著的活性。然而,相较于PAL在木质素和黄酮类物质合成中的功能,PAL在木脂素合成中的功能研究相对有限。因此,克隆和鉴定该珍贵药用植物的PAL基因具有重要意义。在本研究中,我们对五味子中的三种PAL基因(ScPAL1−3)进行了分子克隆和特性分析。通过RACE PCR技术克隆了ScPALs基因,并对三种ScPALs基因的序列进行了基本特征分析,随后进行了分子对接分析。为了确定其催化活性,通过在大肠杆菌(BL21-DE3)中使用pCold-TF载体进行异源表达获得重组蛋白,并通过Ni亲和纯化技术进行纯化。使用反相高效液相色谱(RP-HPLC)与标准化合物对比验证了纯化后的重组蛋白的催化产物。此外,还确定了最适反应温度、pH值及不同金属离子的影响,并在最优条件下测定了Vmax、Kcat和Km值。还测定了三种ScPALs在不同组织中的表达情况。本研究为ScPALs的功能提供了重要的信息。
引言
五味子(Schisandra chinensis (Turcz.) Baill)是一种属于木兰科五味子属的药用藤本植物,主要分布在中国东北地区。五味子的干燥成熟果实被称为五味子,因其具有酸、苦、甜、辛、咸五种味道而得名。五味子一般通过大规模人工栽培生产,其中辽宁省是最重要的主产区。五味子最早记载于《神农本草经》,并被用于治疗慢性咳嗽、遗精、遗尿、慢性腹泻、自汗、盗汗、糖尿病、心悸和失眠等疾病【1】。根据现代化学和药理学研究,二苯并环辛烷木脂素是五味子中主要的有效成分,具有保肝【2】、抗抑郁【3】、抗癌【4】、抗炎【5】、抗溃疡【6】、抗氧化和解毒【7】等多种活性。由于其化学结构和药理作用,二苯并环辛烷木脂素被证明为一种强效的保肝剂,尤其是从其衍生物中筛选出的双环醇,已开发为保肝药物【2】。
二苯并环辛烷木脂素是苯丙烷类化合物的一员,通过苯丙烷途径合成【8】。在该途径中,L-苯丙氨酸首先被苯丙氨酸解氨酶(PAL)脱氨生成反式肉桂酸,随后通过CYP73A(C4H)羟化生成对香豆酸(如图1所示)。接着,对香豆酸通过对香豆酸-CoA连接酶(4CL)生成对香豆酰-CoA,并被C3H和CCoAOMT羟化为阿魏酰-CoA。生成的阿魏酰-CoA通过肉桂酰-CoA还原酶(CCR)和肉桂醇脱氢酶(CAD)转化为松柏醇【9】。经过一系列催化,最终合成二苯并环辛烷木脂素(如图1所示)。已有报道表明,在许多植物和微生物中,PAL是苯丙烷类化合物合成中的关键且限速酶【10】。自Koukol和Conn于1961年在大麦中发现第一个PAL基因以来【11】,越来越多的PAL基因在高等植物中被研究,如鼠尾草【12】、咖啡【13】、罗勒【14】和胡黄连【15】,甚至在一些苔藓植物【16】和真菌【17】中也有发现。在许多植物中,PAL蛋白通常由多基因家族编码【10】。例如,鼠尾草中发现了三种PAL基因【18】,在黑杨【8】和水稻【19】中分别发现了六种PAL基因,而在西瓜中发现了12种PAL基因【20】。

从L-苯丙氨酸酶促生产反式肉桂酸及其在木脂素生物合成中的作用
鉴于其在苯丙素类生物合成途径中的重要性,苯丙氨酸解氨酶(PAL)引起了越来越多的关注。在本研究中,采用cDNA末端快速扩增(RACE)PCR方法,克隆了来自五味子(S. chinensis)的三个PAL基因的全长cDNA序列。对推导出的氨基酸序列进行了生物信息学分析,包括同源性和系统发育关系、氨基酸序列、结构以及物理化学性质。通过分子对接,分析了五味子中三个PAL基因与L-苯丙氨酸的活性位点,并确定了优化的催化条件和催化动力学。同时,通过RT-qPCR评估了三个ScPAL基因在九种组织中的特异性表达。
结果与讨论
ScPAL基因的克隆与多重比对
五味子的三个PAL全长基因被命名为ScPAL1-3。多重序列比对结果表明,推导出的ScPAL1-3蛋白与其他物种的PAL蛋白最大同源性为74.8%,如拟南芥(NP181241.1)、博落回(OVA08384.1)、莲花(XP010261982.1)、罂粟(XP026414499.1)和五桠果树(KAF8393567.1)(图2)。此外,在红色矩形框中展示了三个ScPAL蛋白中一个保守的“GTITASGDLVPLSYIAG”基序(Ala-Ser-Gly)。已知Ala-Ser-Gly(ASG)基序在活性位点残基中有助于底物结合并催化MIO(3,5-二氢-5-亚甲基-4H-咪唑-4-酮)自催化结构域的形成【21】。另一个保守残基“FL”也在黄色矩形框中展示,该残基对PAL酶的底物特异性至关重要【22, 23】。在PAL蛋白中,ASG和FL残基对于以L-苯丙氨酸为唯一底物的消耗起着重要作用。因此,多重序列比对和保守残基分析表明,所有三个ScPAL可能具有催化L-苯丙氨酸生成反式肉桂酸的活性。

推导的ScPAL1-3氨基酸序列与其他PAL蛋白的多重比对。参与比对的序列如下:拟南芥(NP181241.1)、博落回(OVA08384.1)、莲花(XP010261982.1)、罂粟(XP026414499.1)、五桠果树(KAF8393567.1)。
蛋白质功能域和理化性质的预测
在推导的ScPALs氨基酸序列的生物信息学分析中,发现这三个ScPAL蛋白与已知功能的PAL蛋白具有高度的序列和结构保守性。InterProscan分析显示,三个ScPAL蛋白结构包含三个功能域,分别是延胡索酸酶/组氨酸酶(IPR024083)、L-天冬氨酸酶样(IPR008948)和苯丙氨酸解氨酶(IPR023144)。此外,分析表明这三个ScPAL蛋白具有将L-苯丙氨酸催化生成反式肉桂酸的活性。我们还在ExPASy网站上分析了这三种蛋白的理化性质,结果显示ScPAL1、ScPAL2和ScPAL3的分子量分别为77.26、84.15和78.61 kDa。这些蛋白的理论等电点(pI)在6.07到6.29之间,稳定性指数(II)在35.76到40.78之间,预计半衰期为30小时,表明推导的ScPALs是稳定的蛋白质。此外,平均亲水性值在−0.113到−0.217之间,表明ScPAL蛋白没有形成跨膜结构(表S1)。
推导的ScPAL蛋白的三维结构分析
为了明确推导的ScPAL蛋白的结构和功能,使用SWISS-MODEL在ExPASy上进行了ScPAL的三维模型比较分析。芹菜(Petroselinum crispum)PAL蛋白(PDB号:1w27)的三维结构被用作模板,并通过SWISS-MODEL(SWISS-MODEL)进行同源建模。通过PDB sum在线工具发现,推导的ScPAL1蛋白由α螺旋(54.69%)、β螺旋(6.57%)、γ转角和无规则线圈(31.19%)以及延展链(7.55%)组成。ScPAL2蛋白由α螺旋(53.65%)、β螺旋(5.93%)、γ转角和无规则线圈(31.40%)以及延展链(9.02%)组成。ScPAL3蛋白由α螺旋(57.36%)、β螺旋(5.83%)、γ转角和无规则线圈(30.00%)以及延展链(6.81%)组成。根据之前关于芹菜PAL蛋白的报道【24】,PAL蛋白的结构被假设为“海马”形状,由前体结合域(4-亚甲基咪唑-5酮;MIO)、核心域和插入屏蔽域组成。对接结果表明,推导的ScPAL1蛋白中有三个氨基酸残基(Gly-114、Asn-261和Asn-385)通过氢键连接;ScPAL2蛋白中有四个氨基酸残基(Asn-264、Tyr-355、Arg-358和Asn-388)通过氢键连接;ScPAL3蛋白中有四个氨基酸残基(Asn-264、Tyr-355、Arg-358和Asn-388)通过氢键连接在L-苯丙氨酸周围(图3)。这些对接结果与模型蛋白与L-苯丙氨酸相互作用的残基相似【24】。总体而言,这些结果表明推导的ScPAL蛋白具有与其他植物物种PAL蛋白类似的功能。

ScPAL1−3与L-苯丙氨酸的分子建模(A1, ScPAL1;A2, ScPAL2;A3, ScPAL3)
ScPAL蛋白的系统发育分析
为了探讨ScPALs与其他PAL蛋白之间的进化关系,使用了其他植物的PAL氨基酸序列,并通过MEGA 7.0程序中的邻接法构建了系统发育树(图4)。在这棵系统发育树中,大多数植物的PAL蛋白被分为四个分支,分别是双子叶植物、单子叶植物、裸子植物和苔藓植物。所有三个ScPAL蛋白聚集在双子叶植物组中。ScPAL1和ScPAL3聚集在一个节点中。在这一亚组中,ScPAL1和ScPAL3与已知功能性PAL基因的黄瓜(Cucumis sativus)的CsPAL具有更近的进化关系【25】。然而,ScPAL2与其他两个ScPAL蛋白的差异较大。

通过MEGA 7软件对S. chinensis和其他植物物种的PAL进行系统发育分析。系统树使用ClustalW比对结果,通过邻接法(neighbor-joining method)和p距离构建。每个内部分支上的数字表示百分比引导值(1000次重复)。
在大肠杆菌中的异源表达及重组ScPAL蛋白的活性
多重序列比对和三维模型分析表明,ScPALs具有与其他植物功能性PAL蛋白高度的序列一致性和结构相似性。为了探索它们的功能活性,将ScPAL基因构建入pColdTF载体中,并在大肠杆菌BL21 (DE3)中异源表达重组蛋白,在16°C、1 mmol·L⁻¹ IPTG的条件下培养24小时,通过Ni亲和层析进行纯化。为了增加重组蛋白的溶解性,在ScPAL的N端融合了TF标签。根据SDS-PAGE分析总粗蛋白,重组ScPAL主要存在于上清液中,分子量(包括48 kDa标签)约为125 kDa(图5A),与理论值一致。在酶活性检测中,ScPALs在保留时间约为24.5分钟处检测到反式肉桂酸的特征峰,该峰在对照组中未被监测到(图5B)。这些结果表明,重组ScPALs是功能性酶,能够将L-苯丙氨酸转化为反式肉桂酸。

ScPAL蛋白的异源表达及酶性质 (A) 三种粗酶和纯化酶的SDS-PAGE分析。M为蛋白质分子量标准;A1−A3分别对应三种粗酶;CON为空载体;a1−a3分别对应三种纯化酶,表示为ScPAL1−3。 (B) 三种ScPAL的酶促反应HPLC色谱图。
酶性质及动力学常数测定
研究了pH值对ScPAL活性(底物为L-苯丙氨酸)的影响,pH范围为3.0至11.0。如图6所示,A1−A3显示,当pH值从3.0升高到8.0时,ScPALs的特异性活性显著增加,而当pH值从9.0到11.0时,活性逐渐下降。所有三种ScPAL在碱性条件下(pH 7−11)的催化活性高于酸性条件下(pH 3−6)。当pH值从6增加到8时,三种ScPAL的催化能力急剧增强;当pH值进一步增加时,催化能力下降。ScPALs的最适pH范围为7.5−8.0,与近期报道的Pseudozyma antarctica的两种PAL的最适pH相同【26】。 同时,研究了金属离子对ScPALs解氨酶活性的影响。如图6所示,B1−B3显示,Cu²⁺、Ag²⁺和Fe²⁺对ScPALs的催化活性具有强抑制作用,而Mn²⁺和Mg²⁺表现出促进作用。这些结果表明,ScPALs的活性受到某些金属离子的影响。 通过使用纯化的重组ScPALs,评估了温度(15−65°C)对催化反应的影响(图6C1−C3)。ScPALs的最适催化温度分别为45°C、45°C和50°C。

ScPALs的酶性质 (A) pH值对重组ScPAL1 (A1)、ScPAL2 (A2)和ScPAL3 (A3)活性的影响。 (B) 金属离子对重组ScPAL1 (B1)、ScPAL2 (B2)和ScPAL3 (B3)活性的影响。 (C) 温度对重组ScPAL1 (C1)、ScPAL2 (C2)和ScPAL3 (C3)活性的影响。数据以平均值 ± 标准差表示(n = 3)。
为了进一步了解ScPALs的催化能力,表1列出了不同植物中已报道的PALs的催化参数。使用L-苯丙氨酸作为底物,研究了ScPAL催化氨消除的动力学特性(图7A1−7A3)。L-苯丙氨酸与ScPAL1(0.17 mmol·L⁻¹)、ScPAL2(0.25 mmol·L⁻¹)和ScPAL3(0.21 mmol·L⁻¹)的Km值与麻黄(Ephedra sinica)中EsPAL1(0.15 mmol·L⁻¹)【27】和肉苁蓉(Cistanche deserticola)中CdPAL1(0.10 mmol·L⁻¹)【28】的Km值相似,高于芹菜(P. crispum)中PsPAL1(0.017 mmol·L⁻¹)【29】和拟南芥(A. thaliana)中AtPAL1(0.068 mmol·L⁻¹)【30】,但低于红豆杉(Taxus chinensis)中TcPAL(1.10 mmol·L⁻¹)【31】和刚竹(Bambusa oldhamii)中BoPAL4(2.07 mmol·L⁻¹)【32】的Km值。
Table 1. The catalytic parameters of PALs in different plants
| Plant | Gene name | *K*m/(μmol·L−1) | *V*max/(μmol·mg−1·min−1) | *K*cat/(s−1) | *K*cat/*K*m (s−1·mmol·L−1) | Optimal pH | Optimal *T* | Ref. |
|---|---|---|---|---|---|---|---|---|
| Schisandra chinensis | ScPAL1 | 174.1 | 0.66 | 0.85 | 4.87 | 8 | 45 | This study |
| ScPAL2 | 253.8 | 0.52 | 0.67 | 2.65 | 7.5 | 45 | ||
| ScPAL3 | 212.6 | 0.77 | 0.99 | 4.65 | 8 | 50 | ||
| Arabidopsis thaliana | AtPAL1 | 68 | 1.80 | 26.47 | 8.4−9.2 | 46−48 | [30] | |
| AtPAL2 | 64 | 3.20 | 50.00 | 8.4−8.9 | 48 | |||
| AtPAL3 | 2560 | 0.10 | 0.04 | 8.7−8.9 | 31 | |||
| AtPAL4 | 71 | 3.00 | 42.25 | 8.4−8.8 | 46−48 | |||
| Nicotiana tabacum | NtPAL1 | 59.8 | 1.09 | 18.23 | [33] | |||
| NtPAL2 | 39.5 | 1.14 | 28.86 | |||||
| NtPAL3 | 36.4 | 0.78 | 21.43 | |||||
| NtPAL4 | 52.4 | 1.53 | 29.20 | |||||
| Petroselinum crispum | PsPAL1 | 17.2 | [29] | |||||
| PsPAL2 | 16.9 | |||||||
| PsPAL3 | 24.5 | |||||||
| PsPAL4 | 15 | |||||||
| Taxus chinensis | TcPAL | 1100 | 7.5–8.0 | [31] | ||||
| Bambusa oldhamii | BoPAL1 | 230 | 16.29 | 70.83 | [32] | |||
| BoPAL2 | 993 | 21.30 | 21.45 | |||||
| BoPAL4 | 2072 | 16.32 | 7.88 | |||||
| Lycoris radiata | LrPAL3 | 510 | 8.5−9.5 | 35−40 | [34] | |||
| Cistanche deserticola | CdPAL1 | 101.3 | 3.36 | 33.17 | 8.5 | 55 | [28] | |
| Ephedra sinica | EsPAL1 | 152 | 0.59 | 3.87 | [27] | |||
| EsPAL2 | 144 | 0.46 | 3.17 | |||||
| EsPAL3 | 112 | 0.36 | 3.23 | |||||
| EsPAL4 | 180 | 0.52 | 2.87 |

ScPAL1 (A1)、ScPAL2 (A2) 和 ScPAL3 (A3) 的酶动力学 根据米氏方程(Michaelis-Menten equation)计算。数据以平均值 ± 标准差表示,误差条表示三次平行实验的平均值。
ScPALs的组织特异性表达分析
为了检测ScPALs在不同组织中的表达情况,使用RACE PCR克隆了GAPDH基因作为内参基因,并使用基因特异性引物进行qRT-PCR分析(表S2)。在五味子的九种不同组织中,包括叶片、叶柄、茎木质部、茎韧皮部、根木质部、根韧皮部、果皮、果柄和种子,进行了定量PCR分析(图8)。结果表明,ScPAL基因在不同组织中的表达明显不同,每个基因具有其特定的组织表达模式。其中,所有三个PAL基因在茎木质部中的表达量最高,而在果皮中的表达量最低。众所周知,PAL是苯丙素类生物合成途径中的第一个酶,也是合成木质素的第一个酶,PAL在富含木质素的组织中表达最高。ScPAL基因在叶片和叶柄中的表达也较高。在三种ScPAL基因中,ScPAL1在九种组织中的表达量相对较低,ScPAL2和ScPAL3的表达量分别是ScPAL1的2.5倍和2.3倍。
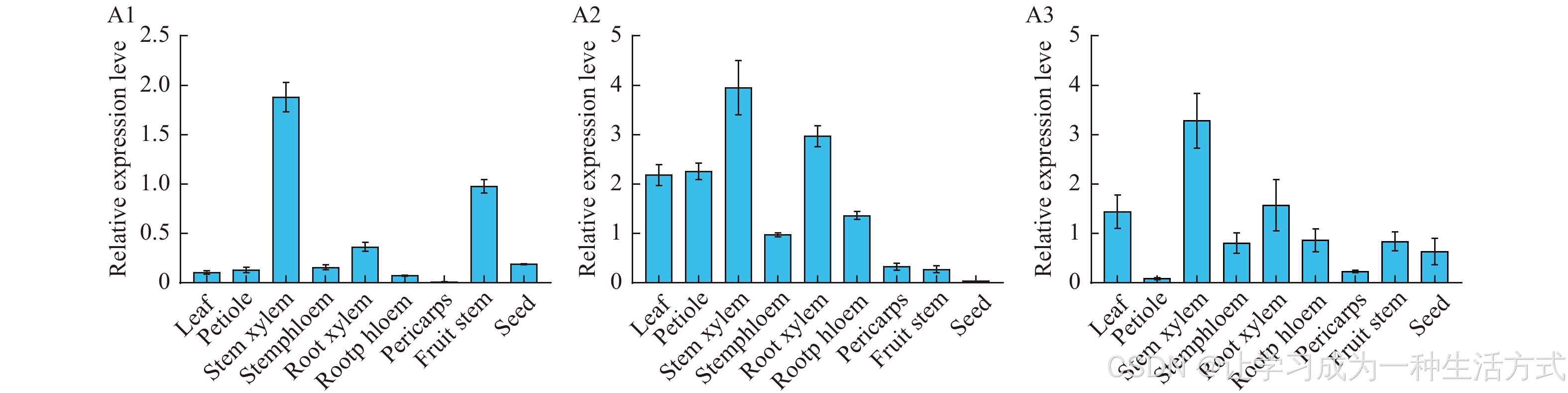
ScPAL1 (A1)、ScPAL2 (A2) 和 ScPAL3 (A3) 在不同组织中的相对表达水平 通过qRT-PCR确定。数据以平均值 ± 标准差(n = 3)表示。
结论
在本研究中,我们对来自五味子(S. chinensis)的三个全长PAL基因进行了分子克隆及其特征分析。通过多重序列比对、三维建模和系统发育树构建,结果表明ScPAL1−3可能具有PAL活性。ScPAL1−3的重组蛋白在大肠杆菌中进行了异源表达并纯化,RP-HPLC鉴定了催化产物,同时研究了温度、pH值和金属离子的影响。最后,确定了ScPAL1−3在不同组织中的转录水平。结果表明,ScPAL1−3能够催化L-苯丙氨酸转化为反式肉桂酸。重组ScPAL的最适温度为45−50°C,最适pH值为7.5−8.0。Cu²⁺、Ag²⁺和Fe²⁺显著抑制了ScPAL的活性,而Mg²⁺则提高了ScPAL的活性。L-苯丙氨酸与ScPAL1的Km值(0.17 mmol·L⁻¹)小于ScPAL2(0.25 mmol·L⁻¹)和ScPAL3(0.21 mmol·L⁻¹)。ScPAL基因在茎木质部中的表达量最高,在果皮中的表达量最低。
五味子(SCF)是一种著名的传统中药材,具有显著的药理活性和广阔的应用前景。然而,目前的研究主要集中在化学成分和药理活性上,关于其生物合成的报道较少。对五味子中PAL的研究不仅有助于进一步理解其生物合成途径,还将为未来该珍贵药用植物的药物和生物技术应用提供基石。
材料与方法
植物材料
植物样本采自辽宁省凤城县,由沈阳药科大学中药学院的贾敬明教授鉴定为五味子(Schisandra chinensis)。植物标本保存在沈阳药科大学中药学院,标本号为P-20200921。采集的植物材料被分为不同的组织组,包括叶片、叶柄、茎木质部、茎韧皮部、根木质部、根韧皮部、果柄、果皮和种子,立即冷冻于液氮中,并储存在−80°C直至使用。
ScPALs和GAPDH的cDNA克隆
根据厂家说明,使用Fruit-mate(Takara, 大连, 中国)和RNAiso Plus(Takara, 大连, 中国)从冷冻组织中提取总RNA。第一链cDNA合成使用PrimeScriptRT Master Mix(Takara, 大连, 中国)进行。ScPAL基因的全长cDNA序列通过SMARTer™ RACE cDNA扩增试剂盒和RACE-PCR方法扩增。然后,5′和3′基因特异性引物(表S2)在来自Gynura bicolor(AB550238.1)、Picrorhiza kurrooa(JQ996410.1)、Sparganium stoloniferum(KF633470.1)和Hevea brasiliensis(KX263324.1)等植物的PAL基因的保守区域设计。PCR产物被亚克隆至pbm16a载体,并转化至DH5α大肠杆菌菌株中,通过菌落PCR筛选阳性克隆,使用FastPure Plasmid Mini Kit(Vazyme, 南京, 中国)提取质粒DNA,随后进行测序(GENEWIZ, 天津, 中国)。基于新序列设计基因特异性引物,扩增ScPAL基因的全长序列,随后构建T载体,进行转化和序列验证。所有引物均使用Primer Premier 5.0软件设计,并将ScPAL1(OK357444)、ScPAL2(OK357443)和ScPAL3(OK357445)的序列提交至GenBank。ScGAPDH基因按照上述程序克隆。其他植物的GAPDH多重序列比对见图S2。引物列于表S2,基因序列提交至GenBank,登录号为OK467969。
ScPALs的测序、系统发育分析及分子建模
ScPAL基因的全长cDNA序列使用ORF Finder工具分析以生成ScPAL蛋白的完整编码区。推导的ScPAL与从NCBI数据库获取的其他PAL序列进行ClustalW多重序列比对。使用MEGA 7.0中的邻接法(NJ)构建系统发育树。通过SWISS-MODEL(SWISS-MODEL)预测ScPALs的三维结构,并使用P. crispum的苯丙氨酸解氨酶(PDB: 1w27)作为模板进行L-苯丙氨酸配体的建模。为了预测ScPALs与L-苯丙氨酸之间的结合位点和结合能量,还使用Schrodinger 11.1程序进行了对接分析。蛋白质结构通过PDBsum程序分析。ScPALs蛋白的理化性质、蛋白质功能位点和疏水性指数通过ProtParam、InterProscan和ProtScale等在线工具进行分析。
ScPALs在大肠杆菌BL21 (DE3)中的异源表达与纯化
ScPALs的编码序列通过同源引物(表S2)扩增后,使用ClonExpress Ultra One Step Cloning Kit(南京,Vazyme,中国)插入通过Kpn I和BamH I酶切的pCold-TF表达载体(Novagen, Madison, WI, USA)。通过测序确认阳性重组质粒pCold-TF-ScPALs后,将其转化到大肠杆菌BL21 (DE3)菌株中进行蛋白表达。转化菌在37°C的LB培养基中培养至OD600约为0.6时,加入终浓度为1 mmol·L⁻¹的异丙基-β-D-1-硫代半乳糖苷(IPTG)诱导蛋白表达,表达条件为16°C培养24小时。通过在4°C下5000 g离心5分钟收集细胞,重悬于PBS缓冲液(50 mmol·L⁻¹,pH 7.4)后在冰浴中超声裂解5分钟。裂解后的总蛋白进行10% SDS-PAGE电泳并通过考马斯亮蓝R250染色以评估诱导表达的重组蛋白。使用带有6×His标签的Ni亲和层析柱纯化重组ScPAL蛋白。具体操作是用20倍柱体积的PBS平衡1 mL Ni柱(GE Healthcare, Pittsburgh USA),然后上样。使用20倍柱体积的PBS清洗柱子,并用洗脱缓冲液(PBS, 500 mmol·L⁻¹咪唑, pH 7.4)洗脱目标蛋白。通过SDS-PAGE检测纯化蛋白的纯度,并使用Bradford法测定纯化重组蛋白的浓度(Solarbio, 北京, 中国)。
酶活性检测
酶促活性通过修改后的方法【26】进行测定。具体的反应体系包含1 mL 0.01 mol·L⁻¹ PBS(pH 7.5),100 μL粗蛋白提取物和0.02 mol·L⁻¹ L-苯丙氨酸,且粗酶溶液在沸水浴中灭活5分钟作为对照。反应在30°C孵育30分钟后,加入等体积的冰冷乙腈终止反应。反应产物通过0.45 μm孔径的滤膜过滤。使用反相高效液相色谱(Agilent 1260仪器,配有光二极管阵列检测器,Palo Alto, CA, USA)分析反应产物。10 μL样品通过柱层析(C18,5 μm,4.6 mm × 250 mm;Agilent, Palo Alto, CA, USA)进行洗脱,梯度如下:溶剂A为甲醇,溶剂B为0.1%甲酸水溶液:0分钟10% A;30分钟90% A;30-40分钟90% A;40-50分钟10% A。流速为0.8 mL·min⁻¹,检测波长为220 nm。通过与反式肉桂酸和L-苯丙氨酸标准化合物的保留时间进行比较,确认反应产物和底物。
ScPALs的酶性质及动力学常数
通过测量ScPAL在不同温度(15−65°C)下的活性,研究了温度对酶活性的影响。使用三种缓冲体系(50 mmol·L⁻¹柠檬酸-柠檬酸钠pH 3.0−6.0,50 mmol·L⁻¹ PBS pH 6.0−8.0,50 mmol·L⁻¹碳酸钠-氢氧化钠pH 9−11)确定酶活性的最适pH值。为评估金属离子(Na⁺, K⁺, Ca²⁺, Mg²⁺, Zn²⁺, Al³⁺, Fe²⁺, Fe³⁺, Cu²⁺, Ag²⁺和Mn²⁺)对ScPAL活性的影响,将ScPAL溶液与这些金属离子(1 mmol·L⁻¹)在4°C下孵育24小时。随后向反应体系中加入终浓度为0.1 mmol·L⁻¹的L-苯丙氨酸。通过使用底物L-苯丙氨酸(0.05−0.5 mmol·L⁻¹)在30°C孵育30分钟,并在290 nm波长下用分光光度计(Varioskan Flash, Thermo Fisher Scientific, Massachusetts, USA)检测催化产物,测定动力学常数。根据米氏方程(Michaelis-Menten equation)计算Km和Vmax。使用反式肉桂酸的系列稀释液绘制标准曲线,X为浓度,Y为在290 nm处的吸光度,方程为:Y = 5.7614X + 0.0323。在PBS中于30°C孵育30分钟后,测定重组ScPALs催化反应产物的产率。
定量实时PCR(qRT-PCR)
为了分析ScPALs在五味子不同组织中的转录水平,使用Primer5软件设计了每个ScPAL基因的引物。定量引物和用于本研究的内参基因引物列于表S2中。qRT-PCR扩增试验在实时PCR系统(Bio-Rad, CF96)上进行,最终20 μL的反应体系中包含8 μL EvaGreen Master Mix(GENEWIZ, 南京, 中国)、1.5 μL稀释的cDNA、0.25 μmol·L⁻¹的每个引物,最后加入双蒸水。qPCR温度程序为:95°C 5分钟,96°C 15秒,特定引物的退火温度下20秒,72°C 20秒,循环35次。PCR完成后,使用相对转录水平分析法分析结果。每组进行了三次重复实验。


























 603
603

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








