多组学研究揭示高肠内淀粉饮食通过微生物-宿主相互作用介导青年反刍动物结肠生态失调的机制
Multi-omics reveal mechanisms of high enteral starch diet mediated colonic dysbiosis via microbiome-host interactions in young ruminant

Article,2024-2-24,Microbiome,[IF 15.5]
DOI:https://doi.org/10.1186/s40168-024-01760-w
原文链接:https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-024-01760-w
第一作者:Chunjia Jin (靳纯嘏) ;Shengru Wu (武圣儒)
通讯作者:Shengru Wu (武圣儒) ; Junhu Yao (姚军虎) ;Le Luo Guan(管乐珞)
主要单位:
西北农林科技大学动物科技学院 (College of Animal Science and Technology, Northwest A&F University, Yangling, Shaanxi 712100, China)
加拿大阿尔伯塔大学 (Department of Agricultural, Food and Nutritional Science, University of Alberta, 116 St. and 85 Ave., Edmonton, AB T6G 2P5, Canada)
西北农林科技大学家畜生物学重点实验室 (Key Laboratory of Livestock Biology, Northwest A&F University, Yangling 712100, Shaanxi, China)
2024年2月24日,西北农林科技大学姚军虎教授、武圣儒副教授及加拿大阿尔伯塔大学Le Luo Guan团队在Microbiome在线联合发表了题为 “Multi-omics reveal mechanisms of high enteral starch diet mediated colonic dysbiosis via microbiome-host interactions in young ruminant” 的研究文章。
本研究解析了高肠内淀粉日粮引起的青年奶山羊结肠微生态失调的潜在机制,揭示了青年奶山羊后肠道微生物、代谢物和宿主基因表达的内在联系,为调控青年反刍动物消化道健康,开发新的营养调控措施提供了理论依据。
- 摘要 -
尽管瘤胃发育至关重要,但后肠道在反刍动物的生长发育中起着重要作用。高淀粉日粮通常用于促进反刍动物瘤胃发育,但往往导致后肠道内淀粉过量和后肠道生态失调。这一现象的机制尚不明确。本研究以青年奶山羊为模型,结合转录组、代谢组和宏基因组,以及组织形态学分析,旨在解析幼龄反刍动物因淀粉过量而导致后肠失调的潜在机制。结果表明,与低肠内淀粉日粮(LES)相比,高肠内淀粉日粮(HES)组奶山羊的结肠病理评分和血清二胺氧化酶活性显著升高,结肠黏膜MUC2蛋白表达和粪便评分显著降低,表明HES日粮引起了奶山羊结肠炎症。利用宏基因组技术在HES组结肠内容物中分别富集到4种细菌和5种真菌,以及相关微生物免疫通路。综合分析宏基因组和结肠转录组数据发现,HES日粮增强了结肠微生物致病性,提高结肠黏膜抗原加工和递呈,以及促进TH2细胞介导的结肠炎症过程。结肠内容物代谢组学分析显示,HES组奶山羊结肠食糜中鹅去氧胆酸(CDCA)和去氧胆酸(DCA)的相对含量升高,次黄嘌呤的相对含量降低,有助于增强TH2细胞介导的炎症相关细胞因子的表达。采用线性混合效应模型计算组学对表型的组学可解释性,结果显示结肠细菌、细菌功能、真菌、真菌功能和代谢物对MUC2生物合成变化的组学可解释性分别为21.92%、20.76%、19.43%、12.08和44.22%。结肠细菌功能、真菌功能和代谢物对病理评分的影响分别为15.35%、17.61%和57.06%。我们的研究结果表明,肠道内淀粉过量可触发后肠宿主-微生物组稳态破坏,导致粘膜受损,结肠吸水破坏和TH2介导的炎症过程。除了结肠代谢物主要导致粘膜受损外,真菌的贡献不可忽视,需进一步研究真菌在青年反刍动物后肠道生态失调中的作用。
- 引言 -
反刍动物在生命早期,由于营养和生理的剧烈变化,消化道发育不全的青年反刍动物可发生胃肠道功能障碍,严重影响其生长和健康。这一时期约14.17%的反刍动物患有胃肠功能障碍和免疫抑制(中国),而在死亡的反刍动物中约32%的动物死于胃肠功能障碍(美国),给畜牧业造成了巨大的经济损失。因此,促进消化道的成熟已成为应对这一问题的主要策略。在断奶前,由于新生反刍动物和幼龄反刍动物的消化和免疫系统尚不成熟,结肠是微生物定殖和发酵的主要生态位,易受外界刺激。在这一时期,结肠在幼龄反刍动物的能量代谢、免疫系统和生理发育中起着重要作用。采用淀粉饲喂幼龄反刍动物和青年反刍动物以促进其生长和瘤胃发育已成为一种被广泛接受的做法。大量未完全降解的淀粉绕过瘤胃流入后肠,引发后肠过度发酵,往往伴有微生物生态失调、后肠酸中毒、结肠黏膜损伤和炎症。虽然后肠免疫在维持这一时期反刍动物的健康方面发挥着重要作用,并直接影响反刍动物的生长和生产性能。有关这一现象的机制尚不明确,阻碍了有效干预措施的开发。
后肠微生物在动物健康、营养物质吸收代谢、胃肠道发育和免疫功能等方面发挥重要作用。这些在人类、小鼠和其他单胃动物中得到了充分研究,但对反刍动物应对后肠生态失调的免疫调节功能的理解仍然有限。一些研究通过影响短链脂肪酸、胆汁酸等微生物代谢物证明了反刍动物肠道微生物的变化与胃肠道功能障碍之间的联系。然而,大多数关于早期宿主-微生物的研究都集中在瘤胃发育和小肠免疫功能。最近的研究表明,结肠微生物不同于瘤胃和小肠,结肠微生物发酵在幼龄反刍动物能量代谢方面发挥重要作用。此外,结肠微生物组和转录组也会受到早期饲喂方法(如延迟初乳摄食)的显著影响。然而,这些研究只调查了2日龄犊牛的结肠微生物和/或宿主转录组,缺乏对结肠微生物-宿主相互作用的长期和全面评估。
在这项研究中,我们假设在青年反刍动物中,肠内淀粉可以通过影响宿主与微生物的相互作用导致结肠稳态破坏,改变结肠微生物群及其代谢,在基因和蛋白水平上影响结肠黏膜屏障和免疫功能,进而导致幼龄反刍动物全身性炎症。因此,我们利用山羊模型饲喂高肠内淀粉日粮,通过多组学分析,基因和蛋白质表达对幼龄反刍动物的结肠微生物组、代谢组和宿主转录组进行整合分析,并评估它们对宿主表型的贡献。
- 结果 -
肠内淀粉改变山羊后肠的表型
Enteral starch altered the phenotypes of hindgut in goats
我们发现HES显著降低奶山羊的粪便评分(P = 0.001;图1A)。根据粪便评分,选择8只LES山羊(体重= 19.77±2.73 kg,粪便评分= 4.42±0.13)和8只HES山羊(体重= 17.69±5.55 kg,粪便评分= 3.42±0.30)屠宰和取样。瘤胃后食糜淀粉含量(0.05 < P < 0.1)、结肠食糜淀粉含量(0.05 < P < 0.1)、结肠病理评分(P < 0.05;图1B)在HES山羊中较高。免疫荧光和免疫组化结果显示,HES山羊MUC2蛋白表达较低(图1C)。此外,HES山羊血清DAO (P < 0.05)和LPS (0.05 < P < 0.1)水平高于LES山羊(图1D)。两组间瘤胃pH、总短链脂肪酸浓度以及乙酸、丙酸、丁酸比例均无显著差异(P > 0.05)。
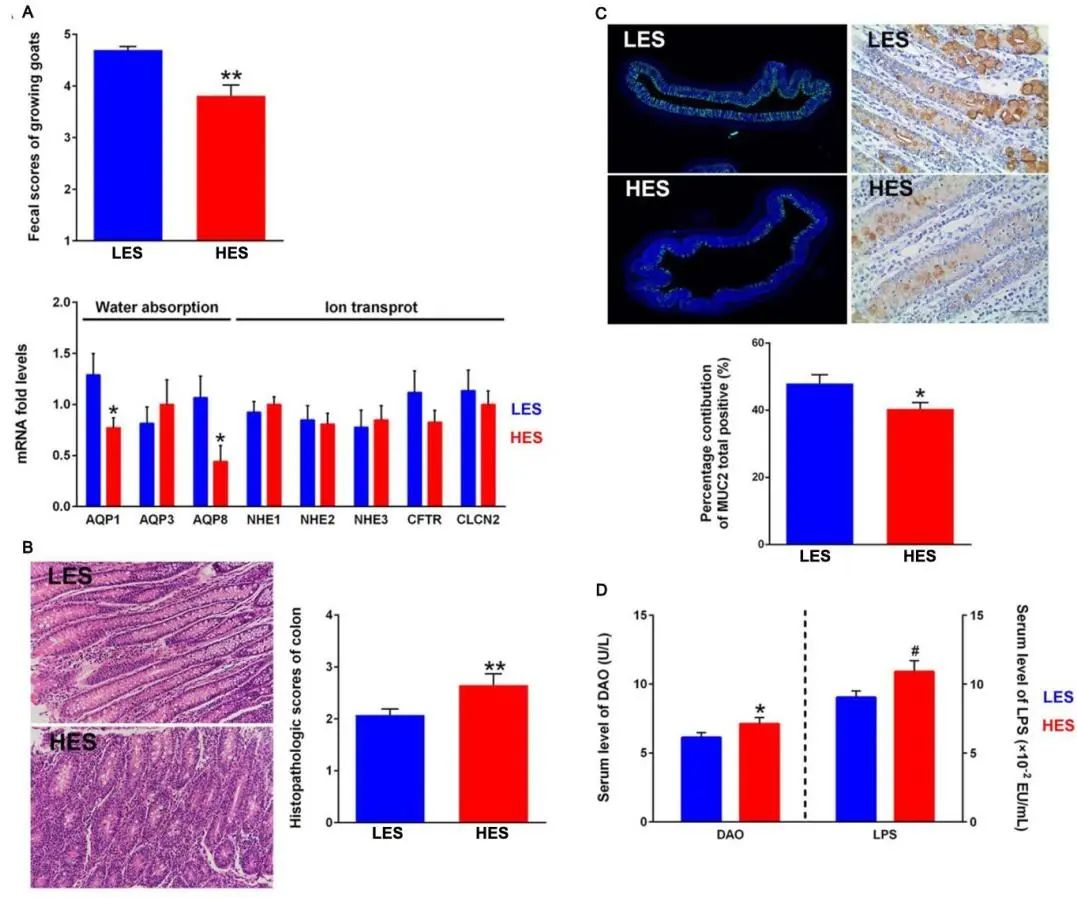
图1 低肠内淀粉(LES)和高肠内淀粉(HES)饲粮对两组山羊宿主表型及相关基因表达的影响。
(A)奶山羊粪便评分及水分吸收和离子转运基因表达。
(B)结肠组织病理学评分。
(C)结肠粘膜MUC2生物合成。
(D)奶山羊血清LPS和DAO水平。
宏基因组分析显示HES改变结肠微生物种群及其功能
Metagenome analysis revealed HES led changes in the colonic microbiome and its functions
每个样本获得约5-6 Gb的宏基因组测序数据。经过质量控制、去除宿主基因、重新组装,共获得5980331个contigs (N50长度为672±15 bp),每个样本498361±19272个。在菌种水平上,HES山羊体内减少了3种细菌,分别是Fibrobacter succinogenes、Clostridium sp. CAG:557和Anaeromassilibacillus sp. An172 (LDA > 2, P < 0.05),而Bacteroides sp. CAG:927、Prevotella sp. PINT、Prevotella sp. P4-67和Muribaculaceae bacterium (LDA > 2,P < 0.05;图2A)。在真菌种类水平上,Batrachochytrium dendrobatidis、Anncaliia algerae、Bipolaris maydis、Smittium culicis、Fusarium coffeatum、Pyricularia oryzae和Venturia nashicola在HES组减少(LDA > 2,P < 0.05),而Fusarium vanettenii、Neocallimastix californiae、Fusarium sp. AF-8、Hypoxylon sp. EC38和Fusarium pseudograminearum在HES组增加(LDA > 2,P < 0.05;图2A)。
对细菌和真菌的功能进行KEGG富集,共鉴定出333条KEGG通路,其中代谢通路140条,人类疾病通路67条,有机体系统通路54条,细胞过程通路27条,环境信息处理通路24条,遗传信息处理通路20条。如图2B所示,在HES组富集到8条细菌通路和10条真菌通路(KEGG Level 3)。此外,还鉴定出503个编码CAZymes的基因,包括16个辅助活性基因(AA)、64个糖结合模块(CBM)、15个糖酯酶(CE)、231个糖苷水解酶(GH)、72个糖基转移酶(GT)和62个多糖裂解酶(PL)。在这些基因中,HES组中CBM35、CE2、GH43_20、GH161、GT92和PL11下调,CBM66和GH89上调(图2C)。
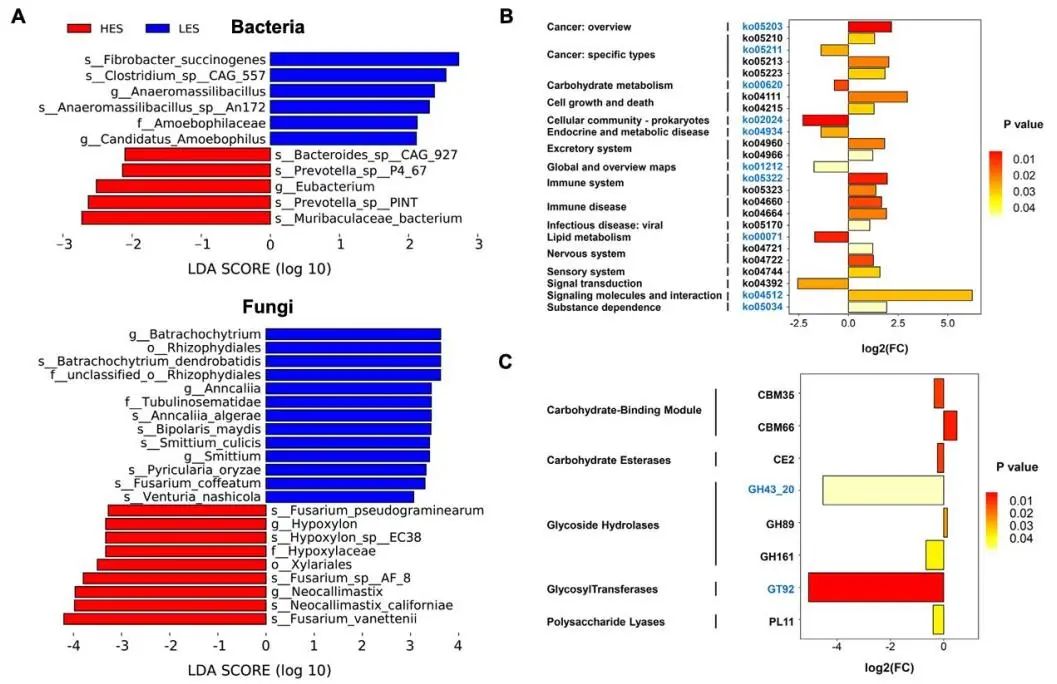
图2 肠内淀粉含量对结肠微生物群和微生物功能的影响。
(A)LES组和HES组结肠细菌和真菌种类的差异。
(B)显著富集的细菌和真菌功能。黑色字体表示细菌功能,蓝色字体表示真菌功能。
(C)显著富集的CAZymes基因。黑色字体表示细菌基因,蓝色字体表示真菌基因。
肠内淀粉改变结肠底物代谢
Enteral starch also altered metabolism in the colon
HES组奶山羊的结肠SCFAs浓度[尤其是丙酸盐(0.05 < P < 0.1)和丁酸盐(0.05 < P < 0.1)]呈上升趋势(图3A),两组之间食糜pH值无差异(图3B)。我们还发现HES组奶山羊的结肠食糜LPS浓度较高(P < 0.05;图3C)。结肠食糜代谢组学分析显示,两组共鉴定出554种代谢物(图3D)。基于MetOrigin数据库,共鉴定出296种代谢物,其中宿主代谢物2种,微生物代谢物77种,共代谢物172种。胆碱(共代谢物,P < 0.05)、别嘌呤醇核糖甙(食物相关,P < 0.05)、次黄嘌呤(共代谢物,P < 0.05)、1-myristoyl-sn-glycero-3-phosphocholine (未知来源,P < 0.05)、1-palmitoylglycerol (未知来源,P < 0.05)、N-acetyl-d-glucosamine (共代谢物,P < 0.05)、腺苷(共代谢物,0.05 < P < 0.1)、thioetheramide-PC (未知来源,0.05 < P < 0.1)、indole-2-carboxylic acid (未知来源,0.05 < P < 0.1)和鸟苷(共代谢物,0.05 < P < 0.1)在HES组中减少;adynerin (未知来源,0.05 < P < 0.1)、鞘氨醇(共代谢物,0.05 < P < 0.1)、鹅去氧胆酸(宿主代谢物,CDCA, P < 0.05)、6 k-PGF1α-d4 (未知来源,P < 0.05)和去氧胆酸(食物相关,DCA, P < 0.05) 在HES组中增加(图3E)。此外,基于宏基因组数据,我们研究了与胆汁酸(BA)代谢相关的微生物功能(KO terms)以探索结肠中BA的微生物生物转化(图3F和G)。然而ko00120(初级胆汁酸生物合成)、ko00121(次级胆汁酸生物合成)和与BA代谢相关的KO terms无组间差异,表明DCA和CDCA的增加与结肠BAs的微生物转化无关。

图3 肠内淀粉对结肠底物代谢的影响。
(A)结肠食糜中SCFAs浓度。
(B)奶山羊结肠食糜pH值。
(C)结肠食糜中LPS的绝对浓度。
(D)结肠食糜代谢组OPLS-DA分析。
(E)结肠食糜差异代谢物热图。
(F)HES山羊与LES山羊胆汁酸微生物转化相关的微生物KO terms。
(G)HES组结肠胆汁酸的微生物转化。
肠内淀粉影响结肠黏膜基因表达
Enteral starch altered the mucosal transcriptome in the colon
转录组分析显示,共鉴定出27,137个基因,其中145个是差异表达基因(DEGs)。与LES组相比,HES山羊的结肠黏膜中64个DEGs上调,81个DEGs下调(图4B)。通过富集分析确定了几个功能类别(图4C):HES组富集的前10条通路包括抗原加工和递呈(P < 0.05)、肾素-血管紧张素系统(P < 0.05)、内分泌及其他因子调节的钙重吸收(P < 0.05)、色氨酸代谢(P < 0.05)、细胞粘附分子(CAMs,P < 0.05)、补体和凝血级联(P < 0.05)、炎症性肠病(IBD,P < 0.05)、疟疾(P < 0.05)、ECM受体相互作用(P < 0.05)、蛋白质消化和吸收(0.05 < P < 0.1)。
获得了10个主要富集在免疫相关通路中的DEGs,并利用qPCR验证了这些DEGs的表达(图4E)。T细胞受体α链V区(TRAV)、转录因子Maf (c-Maf)和α -1抗胰蛋白酶(A1AT)在HES组中显著上调(P < 0.05)。HES组Cadherin26 (CDH26)、v-set和免疫球蛋白结构域1 (VSIG1)、甘露聚糖结合凝集素丝氨酸蛋白酶1 (MASP1)显著下调(P < 0.05)。杀伤细胞免疫球蛋白样受体3DL (KIR3DL)、补体成分4结合蛋白α (C4BPA)和Claudin 4 (CLDN4)的表达趋势与转录组结果一致(0.05 < P < 0.1)。此外,考虑到HES山羊结肠中CDCA和DCA的上调,我们还检测了结肠胆汁酸受体的基因表达,发现顶端钠依赖性胆汁酸转运体(ABST)、ATP结合盒亚家族C成员3 (ABCC3)和有机溶质转运体α- β (OSTα-OSTβ)无组间差异。
由于c-Maf在HES山羊结肠中表达上调,我们进一步检测了结肠黏膜中与TH1和TH2细胞相关的关键基因的表达水平(图4F),发现HES山羊中TH1细胞IL-2的表达显著下调(P < 0.05)。HES组TH2细胞中主转录因子GATA3、c-Maf诱导蛋白(CMIP)、IL-5、IL-13的表达显著上调(P < 0.05)。同样,使用qPCR评估黏膜屏障和细胞因子的基因表达(图4A)。结果显示,HES组结肠DUOX2表达上调(P < 0.05), Claudin4和Occludin表达下调(P < 0.05)。HES提高了结肠黏膜IL-6 (P < 0.05)、IL-22 (P < 0.05)、IFN-γ (0.05 < P < 0.1)、C3 (P < 0.01)的表达。此外,我们还发现HES降低了AQP1和AQP8的表达(P < 0.05;图1A)
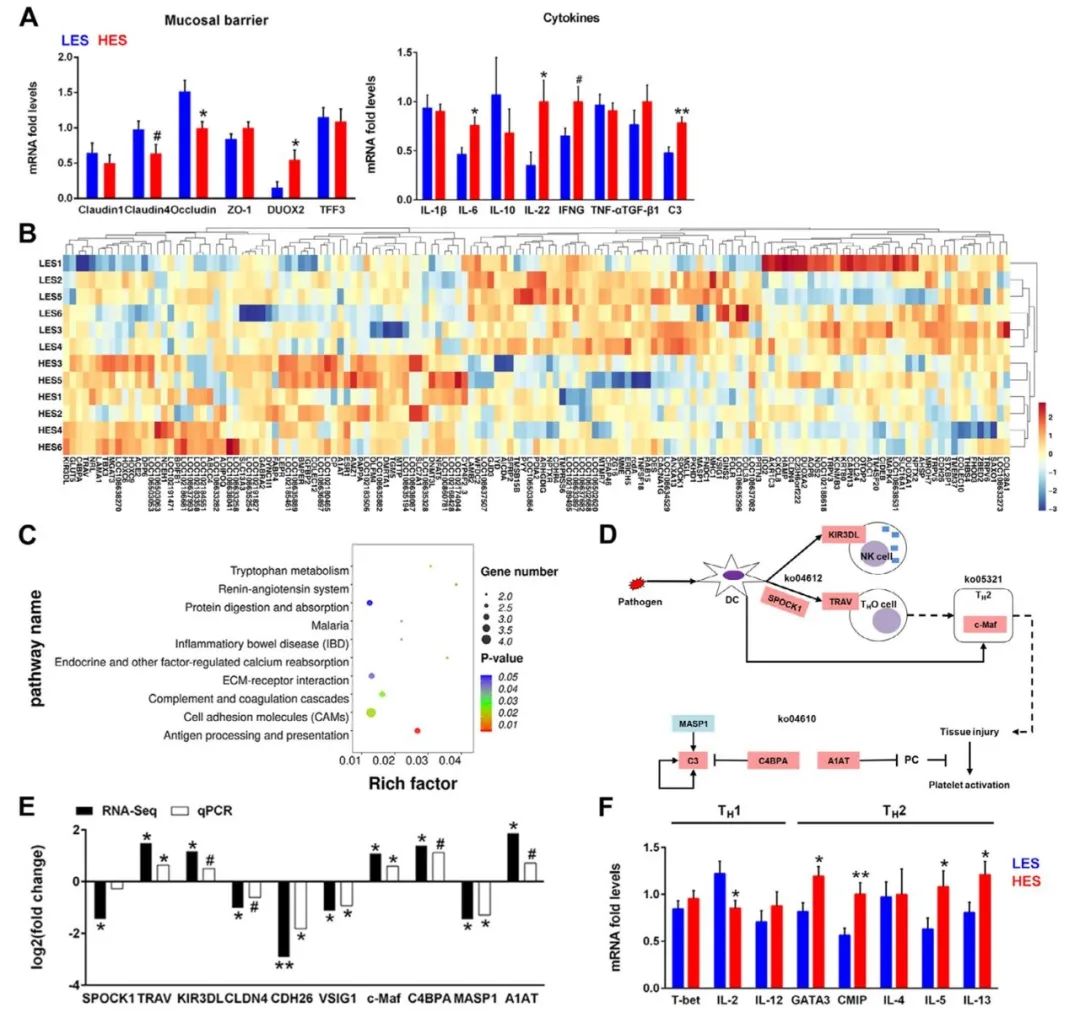
图4 肠内淀粉含量对结肠粘膜屏障和转录组的影响。
(A)结肠黏膜屏障功能相关基因的表达。
(B)结肠黏膜差异基因热图。
(C)DEGs的KEGG富集分析(top10)。
(D)HES组结肠差异通路相关的基因。
(E)结肠黏膜免疫通路相关DEGs的验证。
(F)肠内淀粉对结肠黏膜辅助性T细胞相关基因表达的影响。
多组学整合分析及表型的组学可解释性评估
Multi-omics integration analysis and phenotypic omics contribution assessment
表型、微生物种类、功能、代谢物和/或宿主基因表达之间的关系通过Spearman相关性分析来确定。结果显示,Bacteroides sp. CAG:927、Fusarium pseudograminearum和Neocallimastix californiae与淀粉含量呈正相关, Prevotella sp. P4-67和Bacteroides sp. CAG:927与病理评分呈正相关(R > 0.50, P < 0.05)。MUC2生物合成及病理评分的变化与细菌功能密切相关(|R|> 0.50, P < 0.05)。
代谢物与细菌、细菌功能之间存在92个显著相关关系 (|R|> 0.50, P < 0.05;图5A)。5种细菌(Anaeromassilibacillus sp. An172、Bacteroides sp. CAG:927、Clostridium sp. CAG:557、Prevotella sp. P4-67和Prevotella sp. PINT)与ko04664、ko05323、ko05170、GH47呈正相关(0.65 < R < 0.80, P < 0.05),与ko05170、GH5_39、GH47呈负相关(- 0.87 < R < - 0.66, P < 0.05)。Fibrobacter succinogenes和Muribaculaceae bacterium与ko05170、ko05323、GH47和PL21的相关性分别为0.50 <|R|< 0.65, P < 0.05)。代谢物与真菌、真菌功能之间存在94个显著相关关系(|R|> 0.50, P < 0.05;图5B)。Fusarium vanettenii和Fusarium sp. AF-8与ko05203和ko05322分别呈显著正相关(0.60 < R < 0.75, P < 0.05)。CDCA和DCA与Prevotella sp. PINT呈正相关,与Venturia nashicola和Fusarium coffeatum呈负相关。
我们还在图5C中观察到宿主表型、DEG、肠道代谢物、细菌和细菌功能之间的相关性(|R|> 0.50, P < 0.05)。病理评分和粪便评分与TH2细胞因子表达存在显著相关性。表型与代谢物之间的Spearman相关性显示MUC2生物合成与CDCA和DCA呈负相关(- 0.87 < R < - 0.74, P < 0.05)。CDCA、DCA和LPS与CAMs (CDH26和VSIG1)和上皮紧密连接(Occludin)基因表达呈负相关。Prevotella sp. P4-67、Prevotella sp. PINT和Bacteroides sp. CAG:927显著影响参与TH2介导的细胞因子模式的c-Maf、GATA3和IL-5的表达。Fibrobacter succinogenes和Anaeromassilibacillus sp. An172分别通过抑制抗原加工和递呈基因(TRAV和KIR3DL)和TH2介导的细胞因子模式(GATA3, IL-5)的表达来维持结肠内稳态。细菌功能(ko04721、ko04660、ko04966、ko05323、ko05210、ko05170、ko04215、ko04664)与宿主免疫途径相关基因表达呈显著正相关(|R|> 0.50, P < 0.05)。此外,Fusarium vanettenii、Fusarium sp. AF-8、Hypoxylon sp. EC38、Neocallimastix californiae、ko05034、ko05203和ko05322分别与TH2相关基因c-Maf、GATA3、IL-5和IL-13表达相关(|R|> 0.50, P < 0.05;图5D)。Batrachochytrium dendroatitis、Bipolaris maydis、Fusarium coffeatum、Smittium culicis、Pyricularia oryzae和Anncaliia algerae与抗原加工和呈递基因(TRAV和KIR3DL)表达和TH2介导的细胞因子模式(GATA3、IL-5)表达呈负相关(|R|> 0.50, P < 0.05;图5D)。
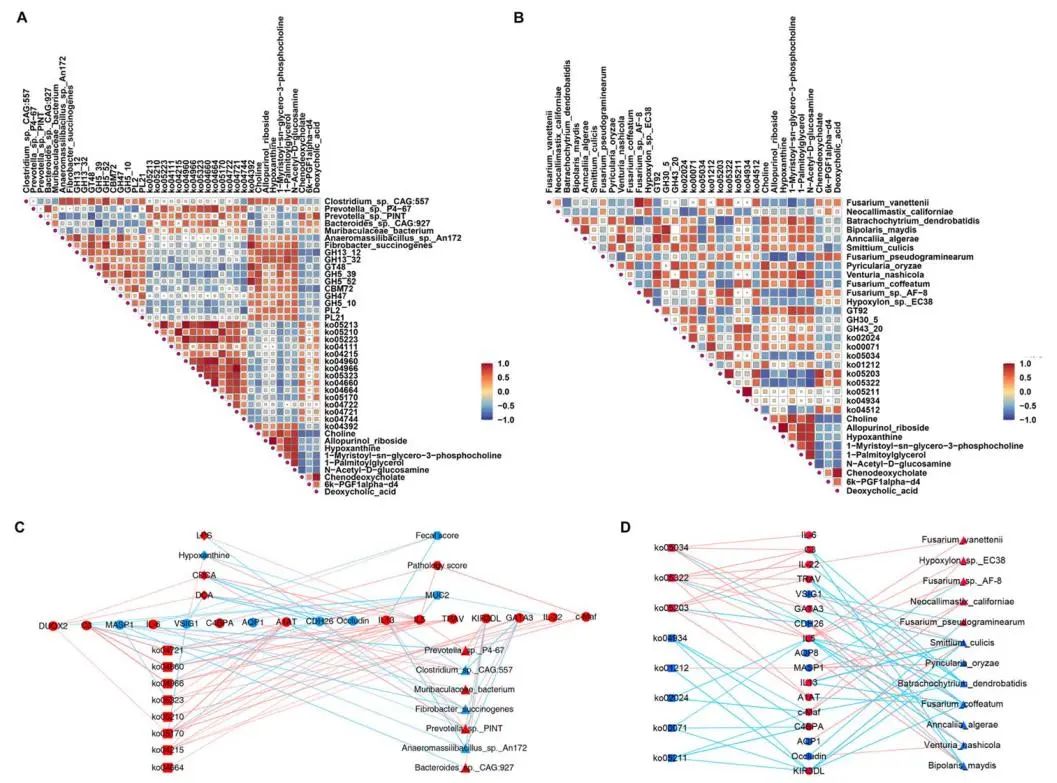
图5 多组学整合分析。
(A)代谢物、细菌和细菌功能之间的Spearman相关性热图。
(B)代谢产物、真菌和真菌功能之间的Spearman相关性热图。
(C)宿主表型、DEG、代谢物、细菌组成和细菌功能之间的Spearman相关性网络。
(D)宿主DEG、真菌和真菌功能之间的Spearman相关性网络。
根据线性混合效应模型,我们发现由结肠微生物组成、微生物功能和代谢物对表型的组学可解释性如图6所示。细菌组成和真菌组成对粪便评分的组学可解释性分别为40.51%和28.12%。结肠细菌组成、细菌功能、真菌组成、真菌功能和代谢物对MUC2生物合成的组学可解释性分别为21.92%、20.76%、19.43%、12.08和44.22%。结肠细菌功能、真菌功能和代谢物对病理评分的组学可解释性分别为15.35、17.61和57.06。结肠细菌组成对血清LPS组学可解释性为33.56%。
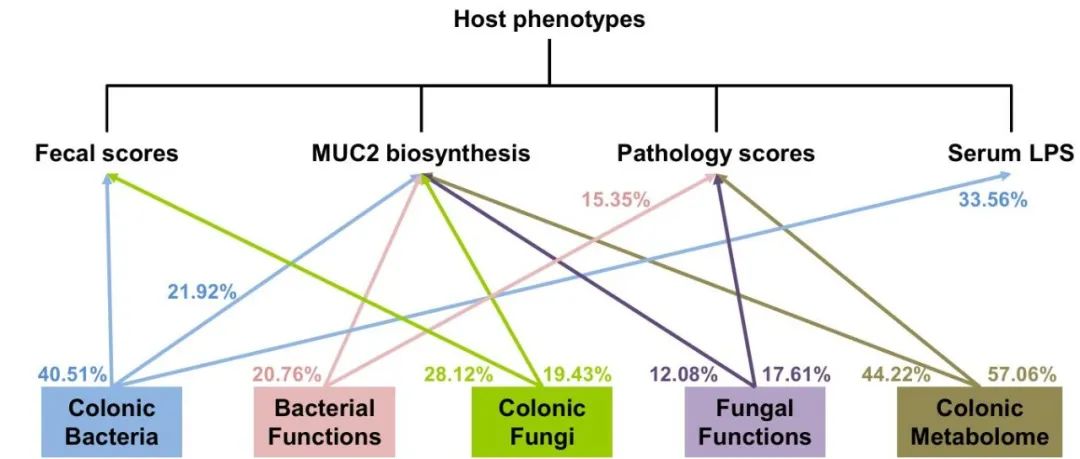
图6 宿主表型的组学可解释性。
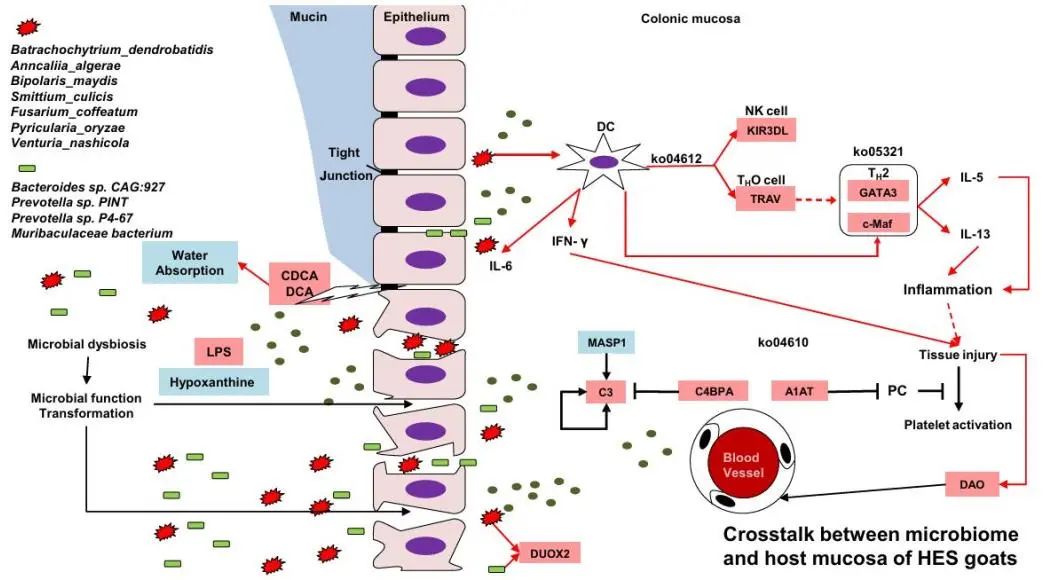
图7 肠内淀粉介导的奶山羊结肠生态失调的潜在机制。
- 结论 -
本研究系统地阐明HES饮食导致青年奶山羊结肠生态失调的潜在机制。我们的研究表明HES引起BA积累,下调了结肠黏膜MUC2的生物合成和上皮屏障功能,导致肠腔内大分子物质易位。结肠微生物及其代谢物通过抗原呈递和TH2介导的炎症过程促进结肠炎症反应和组织损伤。此外,结肠吸水能力也受到抑制。真菌在后肠道微生物-宿主互作中的作用需要进一步研究,这将有助于制定新的营养策略以缓解青年反刍动物的肠道功能障碍和后肠道生态失调。
参考文献
Jin, C., Wu, S., Liang, Z. et al. Multi-omics reveal mechanisms of high enteral starch diet mediated colonic dysbiosis via microbiome-host interactions in young ruminant. Microbiome 12, 38 (2024). https://doi.org/10.1186/s40168-024-01760-w
- 作者简介 -
第一作者

西北农林科技大学
靳纯嘏
博士
靳纯嘏,博士毕业于西北农林科技大学,主要研究方向为反刍动物营养调控技术和反刍动物消化道微生物与消化道健康互作机制。在Microbiome、Animal Nutrition和Animal Feed Science and Technology等期刊发表第一作者论文3篇。
团队简介
西北农林科技大学动物营养与健康养殖科研创新团队聚焦畜禽营养调控与低碳健康养殖,先后主持国家重点研发计划项目3项、国家自然科学基金35项、其他国家级和省部级科研项目40余项,制定陕西省地方标准7项,授权国家专利30余件,相关研究成果在Journal of Animal Science and Biotechnology、Animal Nutrition、Nature Communications、Advanced Science、The ISME Journal、Microbiome、Gastroenterology、npj Biofilms and Microbiomes及iMeta等期刊发表高质量论文200余篇,获得省部级以上科技进步奖6项、教学成果奖4项。团队教师队伍中,国家“万人计划”教学名师1人、教育部“长江学者”特聘教授1人、国家重点研发计划项目首席科学家3人、国务院政府特殊津贴专家1人,陕西省杰出青年科学基金获得者2人、陕西省“中青年科技创新领军人才”2人、陕西省“青年科技新星”5人、“仲英”青年学者2人、陕西省高校“青年杰出科学家”1人,陕西省高校科协青年人才托举计划1人。通过多年努力沉淀,团队围绕“饲料资源开发、饲料加工工艺、机体营养干预、健康精准调控、畜产品质量安全、资源环境保护”等畜牧产业链全过程,建立了一套西北地区畜禽健康养殖个性化解决方案,相关成果在20多个省市超过150家饲料和养殖企业进行示范推广,为西北地区乃至全国特色优质动物源食材走向世界提供了坚强保障。
通讯作者

西北农林科技大学
武圣儒
副教授
通讯作者:武圣儒,西北农林科技大学动物科技学院副教授,硕士生导师。现主要利用个人在微生物组、培养组、表观遗传研究、瘤胃菌群移植、以及3D细胞培养组的研究积累,围绕反刍动物胃肠道健康调控与碳水化合物高效利用的宿主-微生物互作机制开展研究。以第一作者和通讯作者在《Microbiome》、《iMeta》、《npj Biofilms Microbiomes》、《JCI insight》、《mSystems》、《Proceedings of the Royal Society B: Biological Sciences》、《Journal of Animal Science and Biotechnology》、《Animal Nutrition》、《Journal of Dairy Science》等Top期刊发表论文30余篇。先后主持国家自然科学基金青年基金、中国博士后基金面上项目;入选陕西省青年人才托举计划;曾获中国畜牧兽医学会奖、中国畜牧兽医学会动物营养学分会青年学者论坛优秀奖等荣誉。受邀担任申请人受邀担任《iMeta》杂志执行副主编和青年编委,《Frontiers in Endocrinology》和《Frontiers in Nutrition》杂志编辑,《Gut Microbes》、《Journal of Agricultural and Food Chemistry》、《Animal Nutrition》等20余本SCI杂志审稿人。

不列颠哥伦比亚大学
管乐珞
教授
通讯作者:管乐珞教授任职于不列颠哥伦比亚大学土地与粮食系统学院,同时也是加拿大阿尔伯塔大学农业、食品与营养科学系荣誉教授,是研究牛肠道微生物组及其与宿主相互作用的先驱之一,研究方向包括:1)采用宏基因组学和宏转录组学等方法研究宿主-微生物相互作用,以及采用功能基因组学方法研究宿主基因表达;2)肠道微生物组与饲料效率、甲烷排放、肉/奶质量和安全、肉牛和奶牛肠道发育与健康的关联;3)牛转录组、蛋白质组和非编码RNA及其在重要经济性状中的作用研究。累计研究经费逾3500万加元,共发表学术论文270余篇,编著书籍章节8篇,H指数71.0。截至2023年共培养研究生63名、博士后23名。获得多项荣誉,包括2013年加拿大动物科学学会“提高安全实惠食品生产技术创新奖”、2017年Killam教授奖、2021年ADSA Zoetis生理学奖和加拿大动物科学学会奖。

西北农林科技大学
姚军虎
教授
通讯作者及团队负责人:姚军虎,二级教授,国务院享受特殊津贴专家,国家“万人计划”教学名师,宝钢优秀教师,现任中国动物营养学分会副理事长,国务院第七、八届畜牧学科评议组成员,中国动物营养指导委员会委员,“十四五”国家重点研发计划重点专项指南编写组成员及总体专家组成员,陕西省饲料饲草产业技术体系首席科学家,动物科技学院教授委员会主任,学校“双一流”学科群动物营养与低碳养殖创新团队负责人。聚焦奶畜饲料转化率低的产业难题,持续研究奶畜能量高效利用的营养调控机理,主持“十三五”国家重点研发计划项目、国家自然科学基金等国家和省部级项目35项,主持获陕西省科技进步一等奖,授权发明专利6件,发布国家团体标准1项,研究成果在全国10多个省市推广,经济和社会效益显著。主持建成《动物营养学》国家一流课程,主持获批教育部虚拟教研室建设项目,主编、副主编“十三五”国家规划教材各1部,获陕西省教学成果特等奖(7/10)。带领团队获教育部“全国百个研究生样板党支部”、“全国五四红旗团支部”、陕西省“动物营养与健康养殖科技创新团队”等荣誉称号。
宏基因组推荐
本公众号现全面开放投稿,希望文章作者讲出自己的科研故事,分享论文的精华与亮点。投稿请联系小编(微信号:yongxinliu 或 meta-genomics)
猜你喜欢
iMeta高引文章 fastp 复杂热图 ggtree 绘图imageGP 网络iNAP
iMeta网页工具 代谢组MetOrigin 美吉云乳酸化预测DeepKla
iMeta综述 肠菌菌群 植物菌群 口腔菌群 蛋白质结构预测
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature
一文读懂:宏基因组 寄生虫益处 进化树 必备技能:提问 搜索 Endnote
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流快速解决科研困难,我们建立了“宏基因组”讨论群,己有国内外6000+ 科研人员加入。请添加主编微信meta-genomics带你入群,务必备注“姓名-单位-研究方向-职称/年级”。高级职称请注明身份,另有海内外微生物PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。
点击阅读原文,跳转最新文章目录阅读























 1695
1695

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








