2024年度国自然医学部50大科研热点中标数统计排名出炉,免疫调控以中标书985项依旧是稳居第一。此外,同样值得我们关注的是巨噬细胞,较2023年度中标数激增,以706项中标数名列第二名。事实上,第一名的“免疫调控”与第二名的“巨噬细胞”有着紧密的联系。
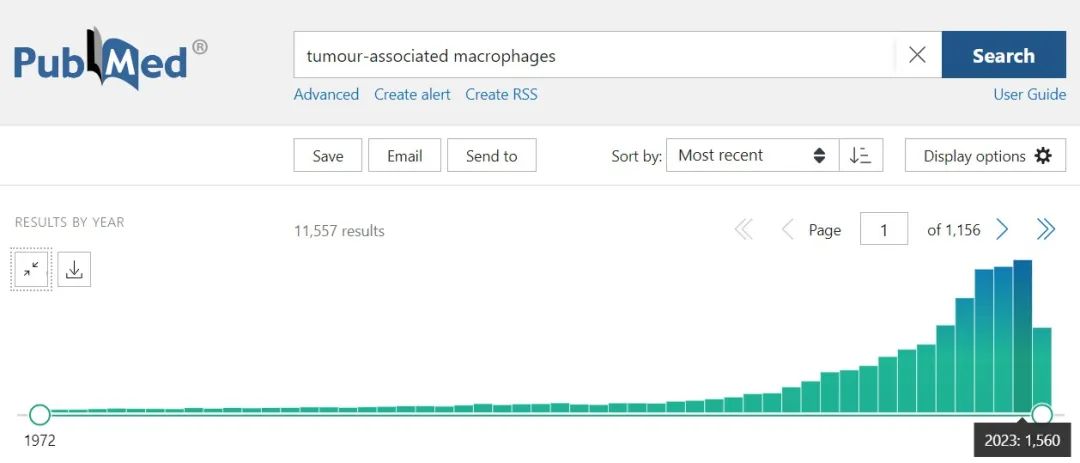
现阶段,巨噬细胞可谓是“炙手可热”的科研话题,热度非常高,重要性也很强。其中,关于肿瘤相关巨噬细胞(TAMs)结合肿瘤微环境的研究更是势不可挡,在pubmed中搜索关键词“tumour-associated macrophages”,仅2023年就有1560篇文章发表,其中有多篇为顶级期刊高分文章,可见肿瘤巨噬细胞的研究已经强势来袭!
除此之外,T细胞是当前国自然申请的热点Top6,2024年中标数高达316;代谢重编程是当前国自然申请的热点Top12,2024年中标数高达218;脂代谢作为近年来新兴的研究热点,相关高分文献如井喷般涌现,已成为国家自然科学基金的新宠。
那么,如何结合多个最强热点发表高分文章?Nature这套“组合拳”强强联合,道尽了最新研究思路👇
近日,来自美国的研究员们在Nature发表了题为“Obesity induces PD-1 on macrophages to suppress anti-tumour immunity”的研究论文,确定了肥胖在癌症中发挥着类似于“双刃剑”的功能——肥胖相关的代谢信号和炎症信号导致肿瘤相关巨噬细胞(TAM)诱导PD-1表达,进而驱动TAM特异性负反馈机制,损害肿瘤免疫监视,增加癌症风险;但同时,有助于改善肥胖癌症患者对PD-1免疫治疗的反应。

一、研究背景
肥胖与13种以上癌症的进展和转移相关,在PD-1阻断免疫疗法中具有独特表现,即肥胖悖论。当前研究大多关注肥胖对T细胞表型的影响,却忽略了肿瘤微环境和脂肪组织中巨噬细胞的作用。本研究深入探索肥胖相关癌症中TAM(肿瘤相关巨噬细胞)的作用,将有助于更全面地理解肥胖与癌症之间的关系,为未来的治疗策略提供新的思路。
二、研究思路方法与结论
结论1:肥胖会削弱肿瘤的免疫功能
研究思路:探讨饮食诱导的肥胖(DIO)对肿瘤生长及其免疫环境的影响,以及对抗PD-1免疫检查点阻断的疗效。
研究方法:
(1)建模:通过MC38细胞系建立同基因小鼠肿瘤模型。将小鼠分为两组,分别给予LFD(10%卡路里来自脂肪)和HFD(45%卡路里来自脂肪),喂养20周。
(2)观察肿瘤生长:在小鼠适应饮食后,皮下注射癌细胞并观察肿瘤生长情况。比较LFD和HFD组小鼠的肿瘤生长速度和大小。
(3)免疫治疗:给予小鼠抗PD-1治疗或IgG同种型对照治疗。评估其肿瘤抑制疗效。
(4)细胞分析:通过单细胞RNA测序(scRNA-seq)分析肿瘤中CD45+和CD45-细胞的差异表达。评估HFD对CD8+T细胞、CD4+T细胞、巨噬细胞等影响。并通过流式细胞术进行验证。
(5)功能分析:利用Compass分析CD8+T细胞和TAMs的代谢状态,评估HFD对细胞代谢的影响以及抗PD-1治疗后的变化。并深入表征HFD条件下以及抗PD-1治疗后TAMs的功能(如吞噬能力和抗原呈递功能)变化。
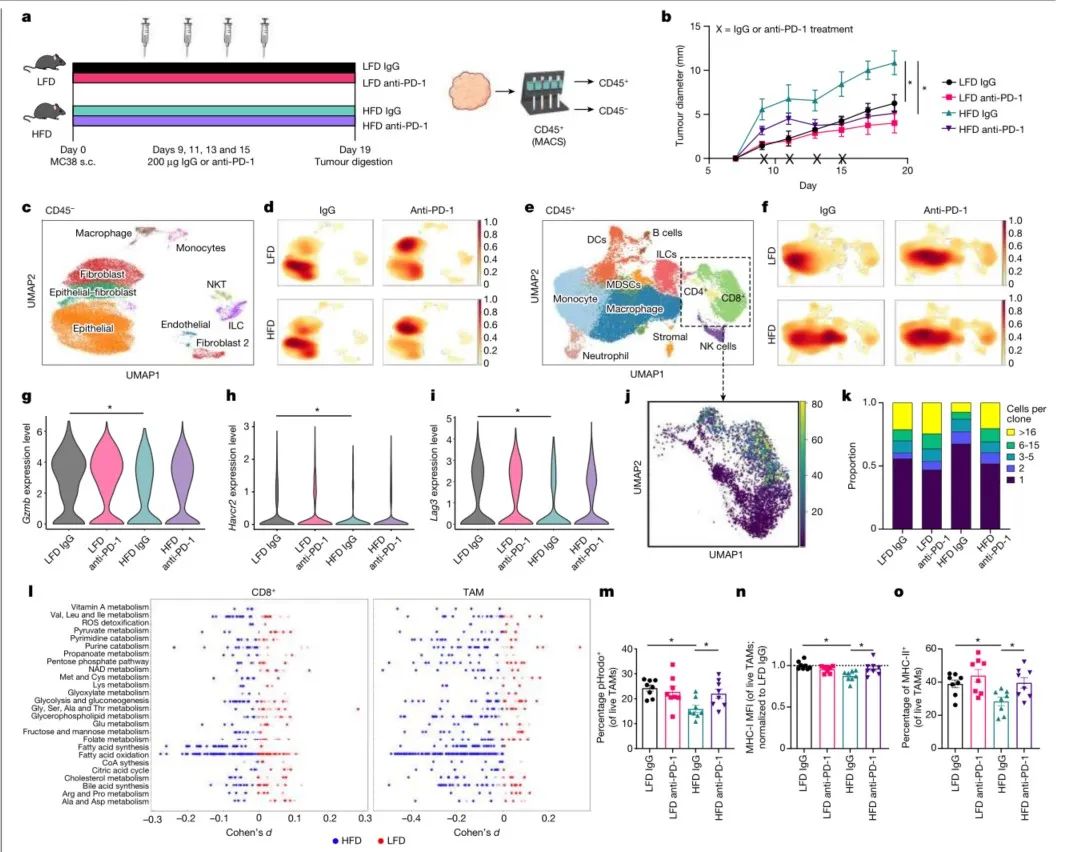
结论2:肥胖诱导TAMs上PD-1的表达
研究思路:探讨了肥胖对免疫治疗的影响(肥胖如何通过改变T细胞活化和PD-1敏感性来影响疗效);以及可能诱导TAMs中PD-1表达的潜在炎症机制。
研究方法:
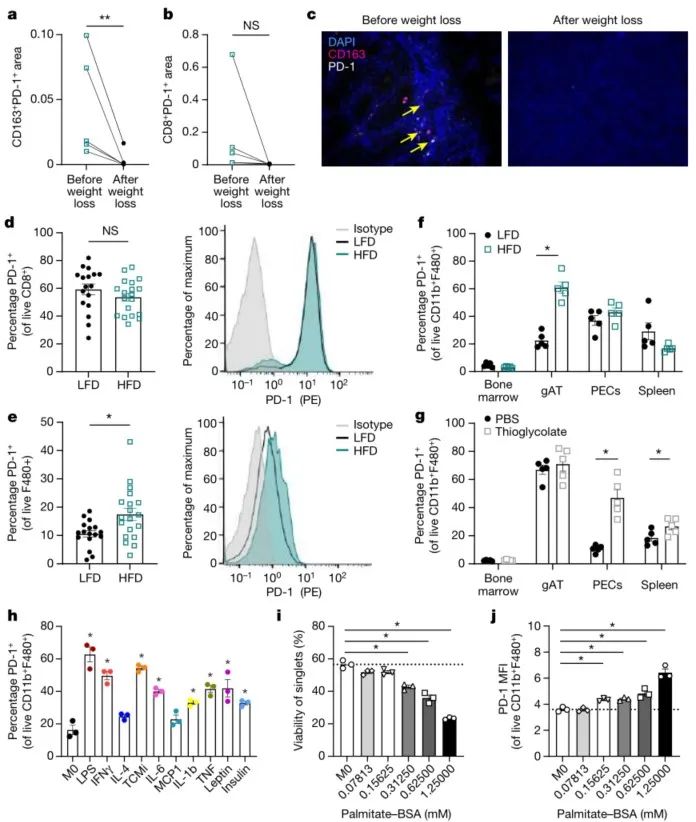
(1)细胞分析:通过scRNA-seq、流式细胞术和免疫组化等技术,比较分析肥胖与正常状态下CD8+T细胞和TAMs的PD-1表达水平。
(2)动物实验:通过建立多个同源模型,探究肥胖对PD-1+TAMs比例的影响,以及PD-1表达对TAMs功能和免疫疗效的影响。并利用BMDM(骨髓源性巨噬细胞)模拟TAMs,探究多个细胞因子(如IFNγ、IL-6、IL-1β等)对PD-1表达的影响。并观察抗PD-1治疗后肿瘤的生长变化及T细胞和TAMs的功能变化。
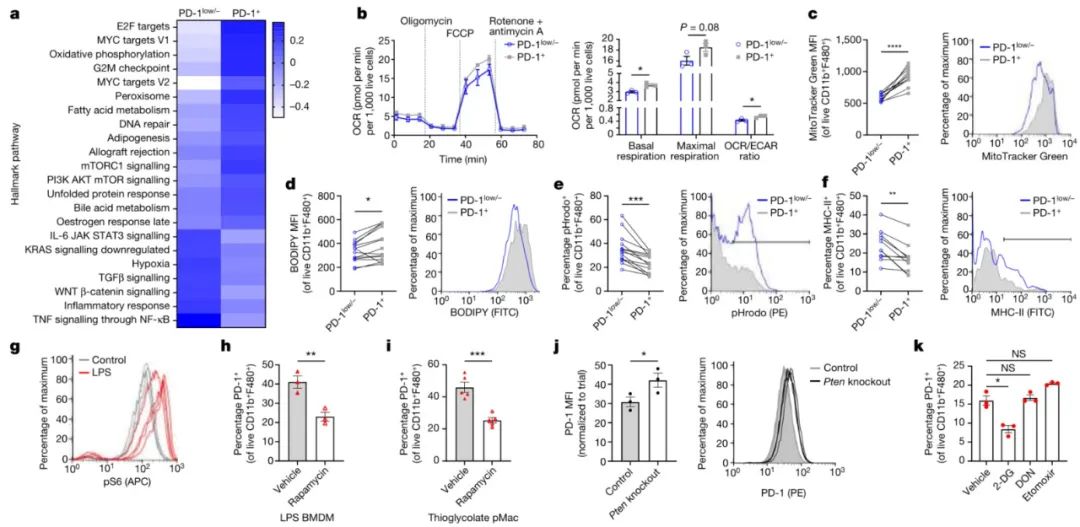
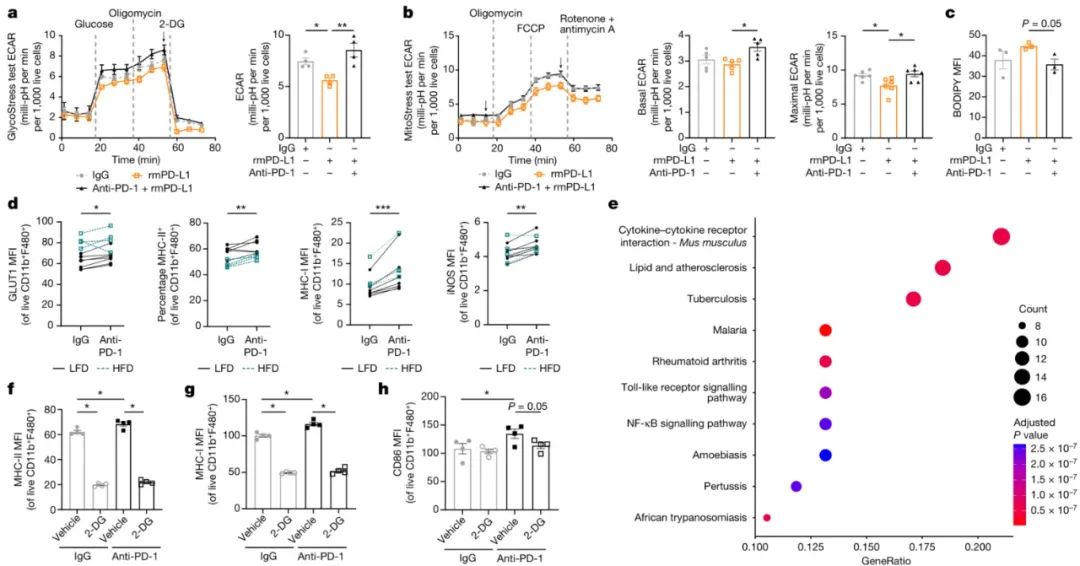
结论3:PD-1削弱巨噬细胞功能,促进脂质摄取和代谢
研究思路:探究PD-1在巨噬细胞中的调控机制及对巨噬细胞代谢、增殖和免疫应答功能的影响,并分析MYC、NF-κB和mTORC1等信号通路在PD-1表达调节中的作用。
研究方法:
(1)基因表达分析:通过scRNA-seq数据集,比较PD-1+和PD-1-巨噬细胞的基因表达模式,利用基因集富集分析(GSEA)与PD-1相关的基因和信号通路。
(2)细胞分类测序:采用荧光激活细胞分选(FACS)技术,从肿瘤样本中分离PD-1+和PD-1low/−巨噬细胞,进行RNA测序,以验证特征基因表达水平。
(3)功能分析:通过流式细胞术分析PD-1+和PD-1low/−巨噬细胞在氧化磷酸化水平、线粒体质量、脂质摄取、吞噬和免疫应答(如MHC-II表达)方面的差异。
(4)通路分析:在细胞实验中对比分析MYC、NF-κB和mTORC1信号通路中PD-1表达水平。动物实验中,通过mTORC1抑制剂和CRISPR基因编辑技术,验证mTORC1在PD-1表达中的调控作用。
(5)基因敲除验证:使用Pdcd1−/−小鼠模型,验证PD-1缺失对巨噬细胞吞噬能力、MHC-II和CD80表达水平、葡萄糖摄取能力等的影响,从而评估PD-1在巨噬细胞功能中的作用。
(6)细胞实验验证:通过培养野生型骨髓来源的巨噬细胞(BMDMs),添加PD-1配体(rmPD-L1)或PD-1阻断抗体,探究PD-1对巨噬细胞糖酵解、脂质摄取、炎症相关分子表达等的影响。并检测胞外酸化率(ECAR)、耗氧量(OCR)等指标,评估巨噬细胞的糖酵解和氧化磷酸化水平。
(7)基因水平验证:通过RNA测序技术,比较PD-1阻断的巨噬细胞与对照组之间的基因表达差异,分析PD-1对巨噬细胞代谢和炎症相关基因表达的影响。并通过流式细胞仪分析巨噬细胞表面标记物(如MHC-II、MHC-I、CD80等)的表达水平,评估巨噬细胞的免疫应答状态。
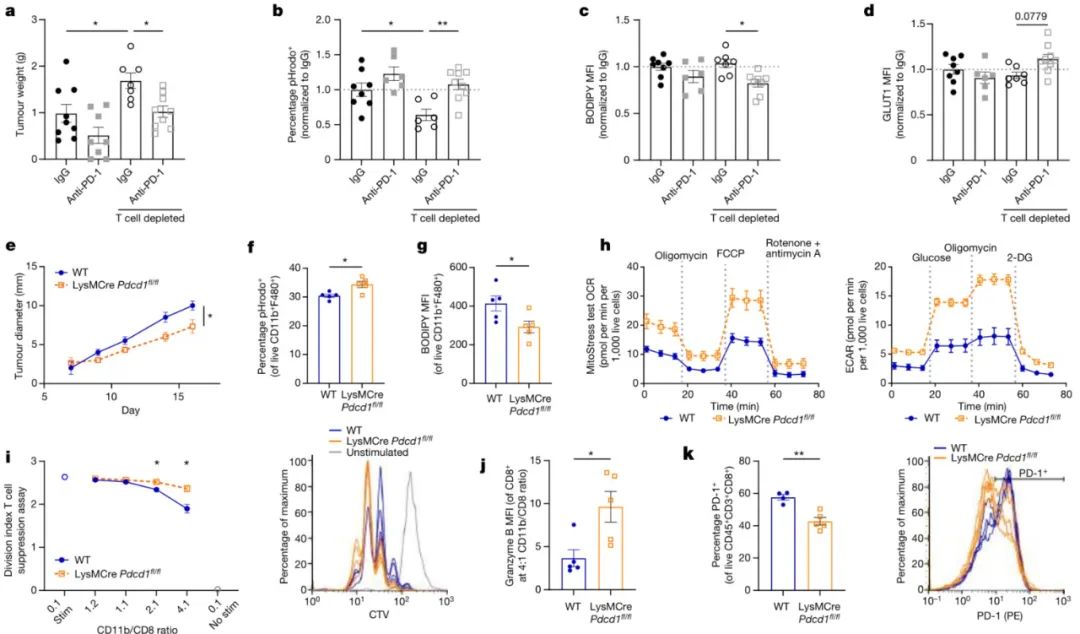
结论4:髓系PD-1削弱抗肿瘤免疫
研究思路:探讨TAM中PD-1对其功能的调控作用,并评估这种作用是否依赖于T细胞
研究方法:
(1)建模:通过药物或基因编辑技术构建T细胞耗竭的肿瘤模型,以评估PD-1治疗在缺乏T细胞参与下的疗效。并建立LysMCrePdcd1fl/fl小鼠模型,在骨髓细胞中特异性敲除PD-1基因,探究PD-1对骨髓来源巨噬细胞功能的影响。
(2)细胞实验:通过将PD-1缺陷的肿瘤髓系细胞与未形成肿瘤的脾脏OVA特异性CD8+T细胞及其抗原OVA肽共培养,观察T细胞的活化和增殖情况。并加入完整的OVA蛋白,评估巨噬细胞抗原呈递能力的变化。最后通过流式细胞仪对比分析巨噬细胞吞噬能力、脂质摄取水平、代谢活性(如GLUT1表达)以及T细胞活化标记物(如PD-1、LAG3、TIM3和CD69)的表达水平。
(3)基因表达分析:通过RNA测序、WB等技术,对比分析PD-1缺失或阻断后巨噬细胞中关键基因的表达,以揭示PD-1调控巨噬细胞功能的分子机制。
结论5:髓系PD-1促进肥胖悖论
研究思路:假设肥胖通过细胞因子和代谢物直接影响癌细胞,通过调节免疫细胞(如巨噬细胞)的功能来影响肿瘤免疫微环境,探究PD-1在肥胖相关炎症和代谢中的作用。
研究方法:
(1)建模:通过建立肥胖模型(如DIO模型)和肿瘤模型(如MC38肿瘤模型)来模拟肥胖与癌症的关系,分析肥胖如何影响肿瘤生长和免疫治疗。
(2)表型分析:通过流式细胞仪等技术来分析巨噬细胞、T细胞等免疫细胞的表型和功能变化(特别是PD-1和TREM2等关键分子的表达情况)。
(3)功能分析:通过共培养、抗原呈递等功能实验,评估巨噬细胞的功能变化(如吞噬能力、抗原呈递能力等)。
(4)分子机制探究:利用RNA测序、WB等技术来分析肥胖对巨噬细胞PD-1表达调控的分子机制(如mTORC1等信号通路),以及PD-1如何影响巨噬细胞功能和代谢。
三、小结
肥胖可选择性诱导肿瘤相关巨噬细胞(TAM)表达PD-1。与肥胖症相关的I型炎症细胞因子和分子(包括干扰素-γ、肿瘤坏死因子、瘦素、胰岛素和棕榈酸)以mTORC1和糖酵解依赖的方式诱导巨噬细胞表达PD-1,PD-1随后向TAM提供负反馈,抑制糖酵解、吞噬作用和T细胞刺激潜力。
相反,PD-1阻断可增加巨噬细胞糖酵解水平,这对于PD-1抑制增强TAM表达CD86和主要组织相容性复合物I和II分子以及激活T细胞的能力至关重要。髓样细胞特异性PD-1缺陷可减缓肿瘤生长,增强TAM糖酵解和抗原呈递能力,并导致CD8+T细胞活性增加,同时减少衰竭标记物水平。
研究结果表明,肥胖相关的代谢信号和炎症信号导致TAM诱导PD-1表达,进而启动TAM特异性反馈机制,从而削弱肿瘤免疫监控。这可能会增加肥胖人群患癌的风险,但提高他们对PD-1免疫疗法的反应。





















 145
145

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








