1 蛋白质的基本概念
蛋白质是由氨基酸组成的生物聚合物。氨基酸通过肽键连接在一起,形成了多肽链。一条或多条多肽链扭曲成三维结构后,形成了蛋白质。蛋白质具有复杂的形状,包括各种折叠、环和曲线。蛋白质的折叠是自发进行的。多肽链各部分之间的化学键帮助蛋白质保持其结构并赋予其形状。蛋白质分为两大类:球状蛋白和纤维状蛋白。球状蛋白通常呈紧凑、可溶、球形状。纤维状蛋白则通常呈细长形且不溶于水。球状蛋白和纤维状蛋白可以表现出四种类型中的一种或多种蛋白质结构。
蛋白质的结构可以分为四个层次:一级结构(Primary structure)、二级结构(Secondary structure)、三级结构(Tertiary structure)、四级结构(Quaternary structure)。复杂的三维蛋白质是通过简单的一级和二级蛋白质结构折叠而形成的。

1.1 蛋白质是如何组成的?
蛋白质是聚合物,这意味着它们是由许多较小分子组成的大分子。这些构成蛋白质的小分子被称为氨基酸。每个氨基酸都包含一个碳原子、一个氨基(Amino Group)、一个羧基(Carboxyl Group)和一个侧链(也称为R基)。
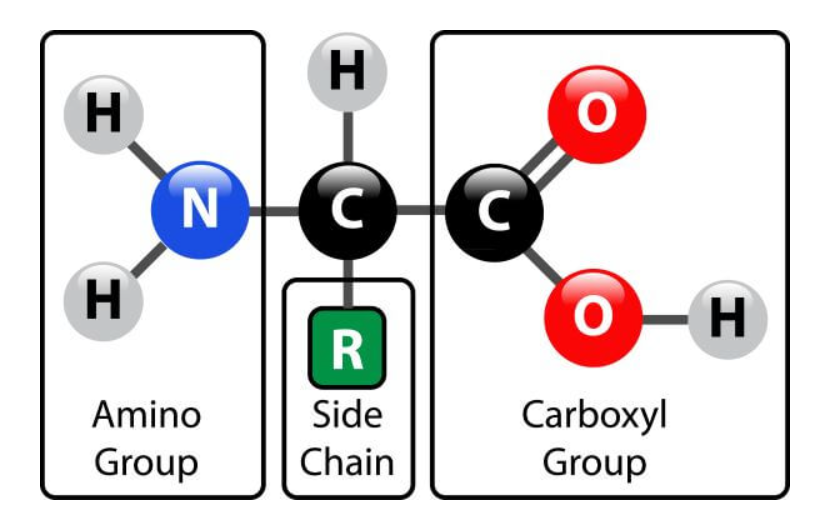
侧链是氨基酸中唯一可变的部分。侧链的类型决定了氨基酸的种类,并影响其特性(如大小、pH值和极性)。人体中只有大约20种不同类型的氨基酸,但它们可以组合形成大约20,000种独特的蛋白质。天然存在的20种氨基酸可以通过三个字母或者单个字母代码表示。
| 氨基酸 | 3-字母 | 1-字母 |
|---|---|---|
| 丙氨酸 (Alanine) | Ala | A |
| 精氨酸 (Arginine) | Arg | R |
| 天冬酰胺 (Asparagine) | Asn | N |
| 天冬氨酸 (Aspartate) | Asp | D |
| 半胱氨酸 (Cysteine) | Cys | C |
| 谷氨酸 (Glutamic acid) | Glu | E |
| 谷氨酰胺 (Glutamine) | Gln | Q |
| 甘氨酸 (Glycine) | Gly | G |
| 组氨酸 (Histidine) | His | H |
| 异亮氨酸 (Isoleucine) | Ile | I |
| 亮氨酸 (Leucine) | Leu | L |
| 赖氨酸 (Lysine) | Lys | K |
| 甲硫氨酸 (Methionine) | Met | M |
| 苯丙氨酸 (Phenylalanine) | Phe | F |
| 脯氨酸 (Proline) | Pro | P |
| 丝氨酸 (Serine) | Ser | S |
| 苏氨酸 (Threonine) | Thr | T |
| 色氨酸 (Tryptophan) | Trp | W |
| 酪氨酸 (Tyrosine) | Tyr | Y |
| 缬氨酸 (Valine) | Val | V |
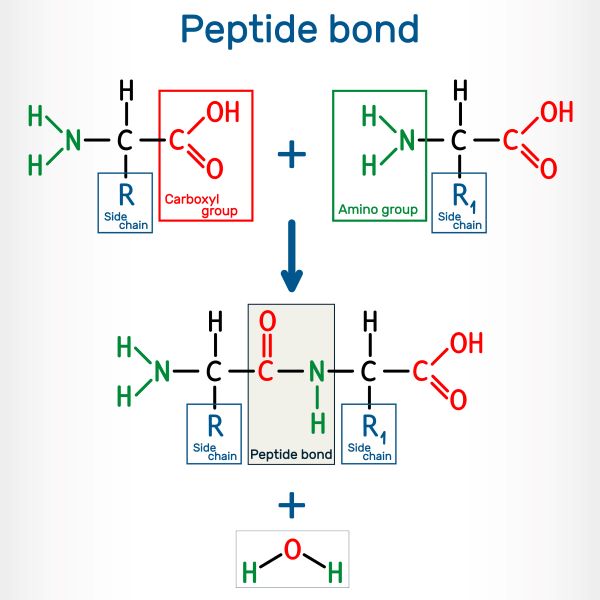
氨基酸通过肽键(Peptide Bonds)连接在一起,肽键形成于一个分子的氨基和另一个分子的羧基之间。两个氨基酸连接在一起称为二肽;由多个氨基酸组成的链被称为多肽。
1.2 蛋白质的多层次结构
一级结构
最基本的蛋白质结构称为一级结构(Primary Structure)。一级蛋白质是一条简单的氨基酸线性链(即多肽链)。
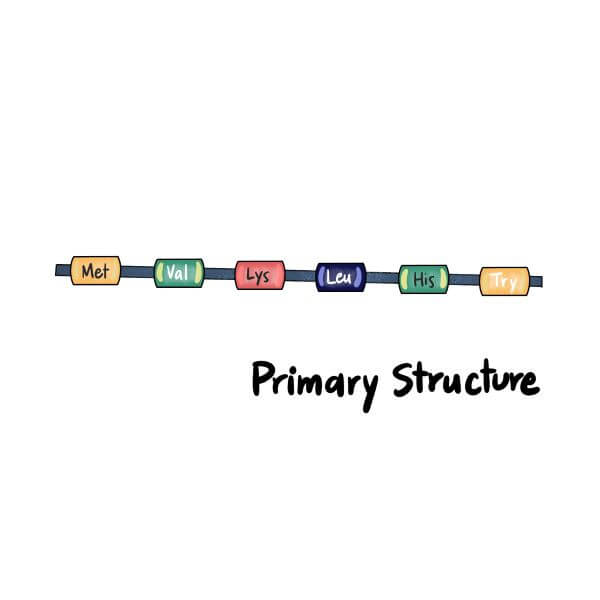
多肽链中氨基酸的顺序由编码它的基因的核苷酸顺序(DNA序列)决定。即使是多肽链中氨基酸序列的微小变化,也可能会改变蛋白质的整体结构和功能。
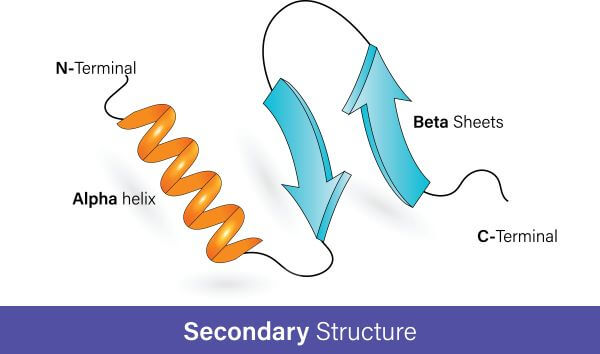
二级结构
二级蛋白质结构(Secondary Structure)是由多肽链折叠形成的。多肽链折叠后,在多肽链的原子之间形成氢键,维持二级结构的稳定。
二级蛋白质结构主要有两种类型:α螺旋(α-helix)和β折叠片(β-pleated sheet)。
三级结构
蛋白质在具备三维结构之前并不完全具备功能。蛋白质的三维结构称为三级结构(Tertiary Structure),由二级蛋白质进一步折叠形成。
氨基酸侧链之间的相互作用导致了三级结构的形成,并在蛋白质折叠过程中产生了各种键。这些键包括氢键(hydrogen bonds)、离子键(ionic bonds)和二硫键(disulfide bonds)。
二硫键是存在于含硫侧链之间的共价键,比其他类型的键更强。正是这些二硫键将蛋白质的三级结构固定住。
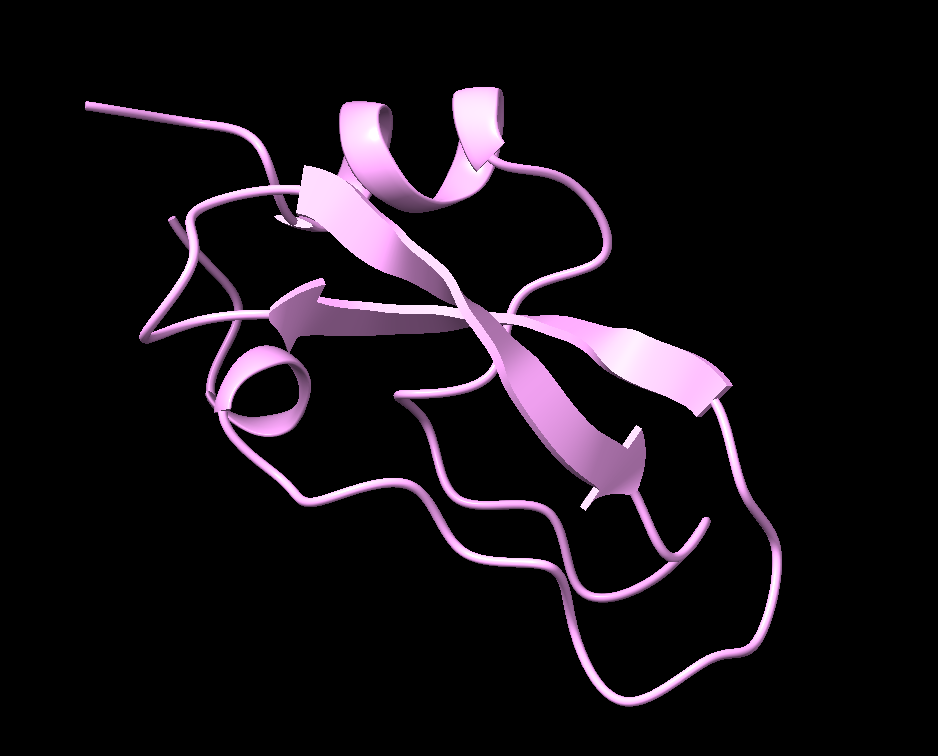
四级结构
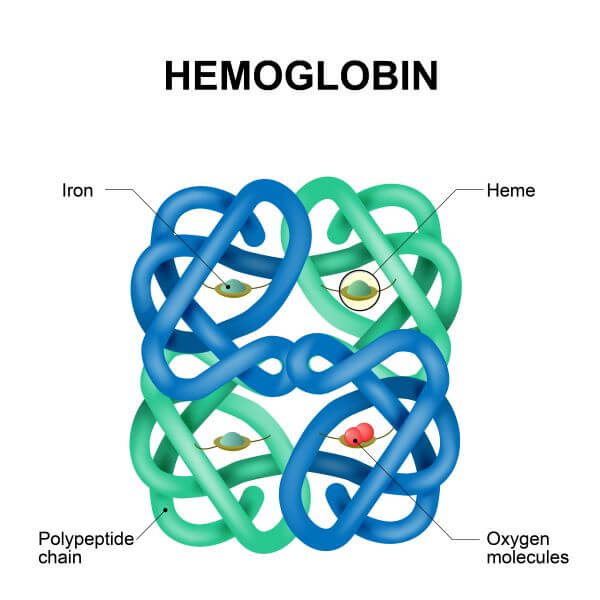
许多蛋白质由单条多肽链组成,其复杂程度仅达到三级结构。然而,有些蛋白质由多条多肽链组成。当几条多肽链(也称为亚基,subunits)结合在一起时,它们可以形成一种称为四级结构(Quaternary Structure)的蛋白质。
一个四级结构蛋白质的例子是血红蛋白(hemoglobin)。血红蛋白由四条多肽链组成,专门适应于在血液中结合氧气。
1.3 蛋白质结构的类别
蛋白质的功能在很大程度上依赖于其最终结构。三级和四级蛋白质都是具有三维结构的功能性蛋白质。然而,不同蛋白质的结构类型可能会有显著差异。
蛋白质的三维结构主要分为两类:球状蛋白质(Globular Proteins)和纤维状蛋白质(Fibrous Proteins)。
球状蛋白质:球状蛋白质通常是圆形或球形的。它们通常具有代谢功能,例如,它们可能是酶或抗体。血红蛋白是球状蛋白质的一个例子。
纤维状蛋白质:纤维状蛋白质是长而窄的,通常具有结构功能。纤维状蛋白质的例子包括胶原蛋白(存在于骨骼、肌肉和皮肤中)和角蛋白(构成头发、指甲和羽毛的物质)。
1.4 什么是蛋白质变性?
蛋白质只有在保持其三维结构时才具有功能。如果它们展开并失去形状,它们将不再具有功能。如果保持蛋白质结构的氢键被破坏,蛋白质就会失去其三维结构。
这种情况可能发生在蛋白质受到压力时,例如加热、pH值变化、脱水或剧烈震动。当变性剂被移除时,蛋白质可能会恢复其原始形状,但在某些情况下,变性是不可逆的。一个不可逆变性的例子是鸡蛋清中的蛋白质,在烹饪过程中失去形状后变得不透明。
2 配体的基本概念
配体(Ligand)是指能够与生物分子(如蛋白质、DNA、RNA等)结合的小分子、离子或其他分子。配体与这些生物分子的相互作用在调节生物功能方面起着关键作用。配体分子在生物大分子研究中尤其重要,例如在药物设计、信号传导、酶活性调控等领域。
2.1. 配体的定义
配体是一种能与蛋白质等靶标分子结合的化学物质。配体可以是:
- 小分子:如药物分子、激素、神经递质等。
- 离子:如金属离子(Ca²⁺、Mg²⁺等),常与酶或蛋白质结合。
- 生物大分子:如DNA片段或RNA。
通常研究蛋白质的配体大多是小分子,尤其在药物设计和生物化学研究中,这些小分子在调节蛋白质功能方面起着至关重要的作用。小分子配体包括药物分子、代谢产物、激素、神经递质等,它们通过与蛋白质的结合调节细胞过程和生物功能。但并不是所有配体都是小分子。有些配体也可以是大分子配体,如蛋白质-蛋白质相互作用,某些蛋白质能够作为配体与另一种蛋白质的结合位点结合。例如,抗体和抗原之间的结合就是典型的大分子配体与靶标的相互作用。
配体小分子图示
2.2 配体的分类
配体根据其特性和作用可以分为以下几类:
- 激活剂(Agonists):配体与靶标结合后,激活其功能。例如,激素作为配体与受体结合后可以激活细胞信号传导。
- 抑制剂(Antagonists):与靶标结合后,抑制其功能。例如,许多药物作为配体可以抑制酶或受体的活性。
- 竞争性配体:与天然配体竞争相同的结合位点,通过阻断天然配体的结合来调节靶标活性。
2.3 配体与蛋白质的相互作用
配体与蛋白质的结合通常是通过非共价键(如氢键、范德华力、疏水相互作用、离子键)来实现的。配体与蛋白质的结合位点决定了结合的稳定性和特异性。
- 结合位点:配体通常会与蛋白质的一个或多个结合位点相结合,这些位点是蛋白质结构中相对凹陷或口袋状的区域。
- 结合模式:根据配体的大小、形状和化学性质,配体与蛋白质的结合可以是多种模式,如嵌入、夹持等。
3 蛋白质口袋与配体的关系
-
什么是蛋白质口袋?
蛋白质的三维结构中通常存在一些凹陷或空腔,这些区域被称为结合口袋(Binding Pocket)。这些口袋通常位于蛋白质的活性位点上,是配体与蛋白质结合的主要位置。口袋中包含特定的氨基酸,这些氨基酸可以通过不同的方式与配体相互作用,包括氢键、离子键、疏水作用等。
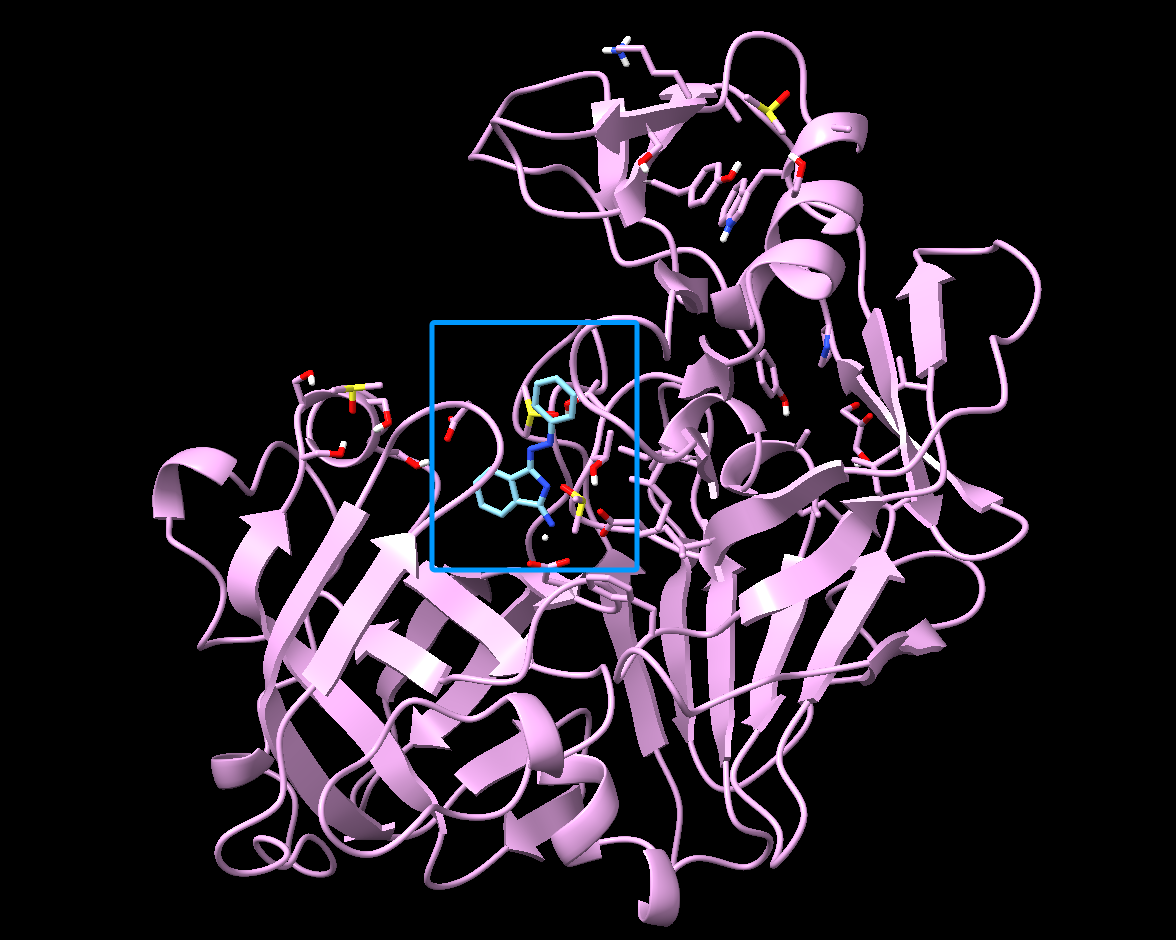
蛋白质与配体小分子结合图示
-
口袋的特性
每个蛋白质的口袋都有独特的形状、大小和化学环境,这决定了它能够与哪些配体结合。以下是口袋的主要特性:
-
形状:口袋的三维形状决定了配体能否与之匹配。类似于钥匙与锁的关系,配体的形状必须与口袋的几何形态兼容。
-
化学环境:口袋中氨基酸的化学性质(如亲水性、疏水性、酸碱性)影响配体的结合方式。例如,带有极性或带电的氨基酸残基可以通过氢键或离子键与配体结合,而疏水残基则倾向于与非极性配体结合。
-
柔性与刚性:有些口袋可能较为刚性,适合特定配体的结合;而另一些口袋则具有一定的柔性,能够调整自身以适应不同形状的配体。
-
-
配体与口袋的结合方式
配体与蛋白质的结合口袋通过多种相互作用来稳定结合:
-
氢键:氢键是蛋白质与配体之间常见的相互作用之一。口袋中的氨基酸可以通过氢键与配体的极性基团相互作用。
-
离子键:某些口袋含有带电的氨基酸残基,可以与配体上的带电基团形成强烈的离子相互作用。
-
疏水相互作用:配体与口袋中的疏水氨基酸相互作用时,这种非极性区域会通过排斥水分子形成较强的结合力。
-
范德华力:这些较弱的相互作用在较近的距离下稳定蛋白质与配体之间的结合。
-
配体与口袋的动态性
虽然口袋在蛋白质的三维结构中通常被认为是相对固定的,但许多口袋具有一定的柔性。这种柔性允许蛋白质在配体结合时进行小幅度的构象变化,增强配体的结合。另一方面,配体本身也可能发生构象变化,以适应口袋的形状,从而形成更加稳定的结合。 -
蛋白质-配体结合的“诱导契合模型”
传统的“锁钥模型”认为,配体与蛋白质的结合就像钥匙与锁的关系。然而,现代研究表明,蛋白质和配体结合时会发生诱导契合(Induced Fit),即当配体接近蛋白质时,蛋白质口袋的形状会进行一些调整,以更好地包裹配体。这个模型解释了蛋白质与不同配体的高特异性结合,也反映了口袋的柔性和动态性。 -
蛋白质口袋与药物设计
在药物设计中,研究蛋白质的结合口袋是寻找潜在药物分子的关键步骤。通过计算机模拟(如分子对接技术),可以预测特定小分子(配体)如何与蛋白质的口袋结合。药物设计中,科学家会根据口袋的形状和化学特性,设计或筛选能够紧密结合的配体分子,这有助于提高药物的有效性和特异性。
蛋白质的口袋是配体结合的核心区域,决定了蛋白质与配体的相互作用特异性。通过理解口袋的结构和化学特性,可以为配体设计和功能预测提供理论基础。蛋白质的柔性和配体的动态性也极大影响了结合的稳定性和效果,这对药物设计有着重要的应用价值。

























 4万+
4万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










