De novo biosynthesis of the hops bioactive flavonoid xanthohumol in yeast
在酵母中de novo生物合成啤酒花活性类黄酮黄腐醇
酿酒酵母表达系统与毕赤酵母表达系统的比较--实验操作系列-8-CSDN博客
小檗碱的酵母代谢工程生物合成-文献精读78_delft培养基-CSDN博客
建立高效生产胆固醇硫酸的酵母细胞工厂-文献精读91-CSDN博客

摘要
类黄酮黄腐醇是啤酒酿造工业中的重要风味物质,具有多种生物活性。然而,其不稳定的结构导致其在啤酒中的含量较低。微生物生物合成被认为是一种可持续且经济可行的替代方法。本研究利用酵母Saccharomyces cerevisiae,通过平衡三条并行的生物合成途径、工程化修饰异戊二烯转移酶、增强前体供给、构建酶融合和过氧化物酶体工程,实现了黄腐醇从葡萄糖的de novo生物合成。这些策略将黄腐醇关键前体——去甲基黄腐醇(DMX)的产量提高了83倍,并成功在酵母中实现了黄腐醇的de novo合成。研究还揭示,DMX合成中的异戊二烯基化是限制性关键步骤,并通过设计的代谢调控策略提高了DMAPP的可用性和异戊二烯基化效率。本研究为系统性工程化酵母细胞工厂以de novo合成复杂天然产物提供了可行的策略。
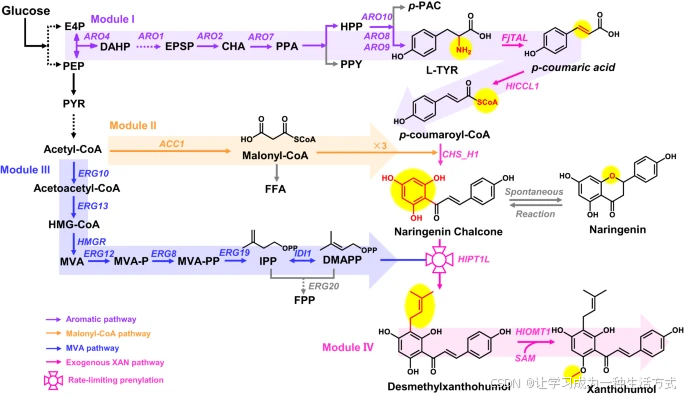
DMX 的生物合成途径来源于三个内源模块化途径,包括芳香族途径(模块I,紫色标注)、丙二酰辅酶A途径(模块II,橙色标注)*和*MVA途径(模块III,蓝色标注)。随后,DMX 被甲基化形成黄腐醇(模块IV,粉色标注)。外源酶用粉色标注,竞争性代谢途径用灰色标注。虚线箭头表示多步反应。
代谢物缩写:
-
E4P:赤藓糖-4-磷酸
-
PEP:磷酸烯醇丙酮酸
-
DAHP:3-脱氧-D-阿拉伯庚酮酸-7-磷酸
-
EPSP:5-烯醇丙酮基莽草酸-3-磷酸
-
CHA:莽草酸
-
PPA:前苯酸
-
PPY:苯丙酮酸
-
HPP:对羟基苯丙酮酸
-
p-PAC:对羟基乙醛
-
L-TYR:L-酪氨酸
-
FFA:游离脂肪酸
-
PYR:丙酮酸
-
HMG-CoA:3-羟基-3-甲基戊二酰辅酶A
-
MVA:甲瓦龙酸
-
MVA-P:甲瓦龙酸-5-磷酸
-
MVA-PP:甲瓦龙酸-5-焦磷酸
-
DMAPP:二甲基丙烯基焦磷酸
-
IPP:异戊烯基焦磷酸
-
FPP:法尼基焦磷酸
-
SAM:S-腺苷-L-甲硫氨酸
基因及酶编码缩写:
-
ARO1:编码莽草酸脱氢酶
-
ARO2:编码莽草酸合酶
-
ARO4:编码DAHP合酶
-
ARO7:编码莽草酸变位酶
-
ARO8:编码芳香族氨基转移酶I
-
ARO9:编码芳香族氨基转移酶II
-
ARO10:编码苯丙酮酸脱羧酶
-
ACC1:编码乙酰辅酶A羧化酶
-
ERG10:编码乙酰乙酰辅酶A硫解酶
-
ERG13:编码HMG-CoA合酶
-
HMGR:编码HMG-CoA还原酶
-
ERG12:编码甲瓦龙酸激酶
-
ERG8:编码磷酸甲瓦龙酸激酶
-
ERG19:编码甲瓦龙酸脱羧酶
-
IDI1:编码异戊二烯基焦磷酸异构酶
-
ERG20:编码法尼基焦磷酸合酶
-
FjTAL:编码酪氨酸氨裂解酶
-
HlCCL1:编码4-香豆酸辅酶A连接酶
-
CHS_H1:编码查尔酮合酶
-
HlCHIL2:编码非催化查尔酮异构酶
-
HlPT1L:编码异戊二烯转移酶
-
HlOMT1:编码O-甲基转移酶。
在本研究中,我们通过平衡三条平行途径(芳香族生物合成、丙二酰辅酶A供应和甲瓦龙酸(MVA)途径),构建了用于黄腐醇de novo生物合成的酵母平台。 我们通过筛选和工程化异戊二烯转移酶(PTase),以及增强DMAPP的可用性,优化了限制性步骤——异戊二烯基化,从而将去甲基黄腐醇(DMX)的产量提高了83倍(4.0 mg/L)。最终,通过优化最后一步甲基化反应,成功实现了黄腐醇从葡萄糖的de novo生物合成。这种黄腐醇的微生物生物合成为优化微生物细胞工厂以实现黄腐醇的可持续供应提供了可能,并为其他复杂天然产物的生物合成途径优化提供了可行的策略。
结果
黄腐醇生物合成途径的模块化构建
首先,我们模块化构建了黄腐醇关键前体DMX的生物合成途径。我们通过表达以下基因构建了DMX生物合成的下游途径,该途径以L-酪氨酸为起始底物:来自Flavobacterium johnsoniae的酪氨酸氨裂解酶基因FjTAL,来自Humulus lupulus的4-香豆酸辅酶A连接酶基因HlCCL1、查尔酮合酶基因CHS_H1、异戊二烯转移酶基因HlPT1L(图2a)。此外,我们还表达了来自H. lupulus的非催化查尔酮异构酶基因HlCHIL2,研究表明该基因能够增强CHS_H1和HlPT1L的活性。(18) 此外,为了探索DMX向黄腐醇的转化可能性,我们还表达了来自H. lupulus的O-甲基转移酶基因HlOMT1。(20)
结果显示,构建的菌株YS103生产了25 mg/L的柚皮素查尔酮(NC)和柚皮素(N,NC的不稳定化合物自发形成的产物(24)),但未检测到黄腐醇或DMX的生成(图2b, d)。

a. 模块化途径修改的概要示意图 三个平行的生物合成模块包括芳香族途径(紫色标注)、丙二酰辅酶A途径(橙色标注)*和*MVA途径(蓝色标注)。上调的步骤用粗箭头表示,下调或敲除的步骤用虚线箭头表示。
-
FjTAL:编码酪氨酸氨裂解酶
-
HlCCL1:编码4-香豆酸辅酶A连接酶
-
CHS_H1:编码查尔酮合酶
-
HlCHIL2:编码非催化查尔酮异构酶
-
HlPT1L:编码异戊二烯转移酶
-
aro10:编码苯丙酮酸脱羧酶
-
ARO4K229L 和 ARO7G141S:分别编码耐反馈抑制的DAHP合酶和莽草酸变位酶
-
ACC1:编码乙酰辅酶A羧化酶
-
tHMG1:编码截短型HMG-CoA还原酶1
-
IDI1:编码异戊二烯焦磷酸异构酶
-
ERG20N127W:编码法尼基焦磷酸合酶突变体
-
P-HlPT1L:通过pESC-URA质粒过表达异戊二烯转移酶。 关于其他缩写,请参阅图1注释。
b. 通过代谢改造提高三个模块的前体(NC/N)产量。 c. ERG20 突变和HlPT1L过表达提高了DMX产量。 d. 通过HPLC分析DMX标准品及菌株YS103、YS112、YS116和YS117的发酵产物。所有菌株在含20 mL最小培养基的100 mL摇瓶中培养。数据以均值±标准差表示(n = 3独立生物样品)。通过Student’s t检验比较两组差异(*p < 0.05, p < 0.01, *p < 0.001),p值见图b和图c。原始数据在原始数据文件中提供。
优化上游生物合成途径以增强前体合成
为了增强L-酪氨酸、丙二酰辅酶A和DMAPP的前体合成,首先尝试通过敲除编码竞争酶苯丙酮酸脱羧酶的ARO10基因,以及过表达耐反馈抑制的DAHP合酶ARO4K229L和莽草酸变位酶ARO7G141S,以提高L-酪氨酸的合成。(25) 所得菌株YS107的NC/N产量比母株YS103提高了52%(图2b)。随后,通过用组成型启动子PTEF1替换乙酰辅酶A羧化酶基因ACC1的本底启动子以提高丙二酰辅酶A的合成,但未能提高NC/N的产量,表明乙酰辅酶A羧化过程目前并非瓶颈。
最后,我们尝试通过提高低水平底物DMAPP的供应以及过表达PTase基因来增强异戊二烯基化步骤。过表达MVA途径中的限速基因tHMG1(编码截短型HMG-CoA还原酶1)和IDI1(编码异戊二烯焦磷酸异构酶)仍未能在菌株YS112中生产DMX。我们推测法尼基焦磷酸(FPP)的高效合成与DMAPP的生物合成存在竞争,据报道,法尼基焦磷酸合酶突变体Erg20N127W会降低催化DMAPP转化的活性。(27) 因此,我们将ERG20位点突变为ERG20N127W,以提高DMAPP的供应量,最终在菌株YS116中成功生产了12 μg/L DMX(图2c, d)。这表明,与其提高DMAPP供应,不如阻断DMAPP的消耗更为重要。此外,该突变使NC/N产量提高了79%(图2b),可能是由于MVA途径中流向FPP合成的通量减少,从而提高了丙二酰辅酶A合成的乙酰辅酶A可用性。然而,与母株YS112相比,菌株YS116的最大比生长速率(μmax)降低(补充图2)。这些数据表明,法尼基焦磷酸合酶突变增加了异戊二烯基(DMAPP)的可用性,但进一步减缓了细胞生长。
随后,我们尝试通过高拷贝质粒过表达HlPT1L,所得菌株YS117的DMX产量比母株YS116提高了7.7倍(104 μg/L)(图2c, d),表明PTase是DMX生产中的限制性因素。
PTase的表征与工程化
为了进一步提高DMX产量,我们尝试增强PTase的活性(图3a)。据报道,膜结合型PTase在植物中被定位于高pH的质体,而酵母细胞质的pH由于酸性代谢物的积累较低(<6)。(28) 因此,我们使用MES缓冲介质培养工程化酵母YS116,以将培养基的pH维持在5.4(72小时),对照培养基的pH为3.3。在缓冲培养基中,DMX产量比非缓冲介质中高出2.8倍(图3b)。然而,NC完全转化为N,表明胞质中的高pH难以稳定NC的开环构象(图3b)。

a. PTase工程化示意图 通过改变pH、筛选替代PTase及截短PTase的信号肽以提高PTase的催化能力。 b. 添加MES缓冲液提高了菌株YS116中DMX的产量。在发酵24小时后加入pH为6.58的MES缓冲液。 c. PTase的系统发育分析。通过MEGA7软件和最大似然法构建邻接树,进行1000次自助测试。 d. 在菌株YS116中使用高拷贝质粒评估不同PTase。 e–h. 截短PTase以提高菌株YS116中DMX的产量。所有菌株均在含20 mL最小培养基的100 mL摇瓶中培养。数据以均值±标准差表示(n=3独立生物样品)。通过Student’s t检验比较两组数据(p < 0.05, **p < 0.01, **p < 0.001),p值见图**b和d**。原始数据在数据文件中提供。
筛选和工程化PTase
我们从啤酒花及其他生物中筛选了替代PTase,基于底物类黄酮和异戊二烯供体的相似性,包括来自啤酒花的HlPT-1(与HlPT1L具有98.5%同源性),四种催化异甘草素和DMAPP缩合的查尔酮特异性PTase(Moraceae科的MaIDT30和CtIDT30,以及Leguminosae科的GuILDT31和SfiLDT32),四种异黄酮特异性PTase(SfFPT33、LaPT134、AhR4DT-135和PcM4DT36),Cannabis sativa L.*的*CsPT337和CsPT438,以及来自Streptomyces sp.的可溶性PTase NphB39。所有PTase及其底物特异性的概览见补充数据1。
我们对这13种PTase进行了氨基酸序列比对,构建了系统发育树并评估HlPT1L与其他PTase之间的进化关系(图3c)。结果显示,HlPT1L与CsPT4位于同一分支,表明它们具有相似的酶催化功能。HlPT1L还与MaIDT、CtIDT和CsPT3在进化上较为接近,但与其他PTase酶相距较远。
我们通过高拷贝质粒在菌株YS116中表达这12种密码子优化的PTase以及HlPT1L(图3d)。当表达MaIDT、HlPT-1和LaPT1时,其DMX产量高于HlPT1L,其中LaPT1导致最高DMX产量,为121 μg/L(图3d)。
随后,我们利用信号肽预测软件TargetP(TargetP 2.0 - DTU Health Tech - Bioinformatic Services)截短了N端信号肽,以提高酶活性,截短序列的位置见补充图3。截短后的PTase序列与全长序列一起转入菌株YS116以评估DMX产量。截短HlPT1L、MaIDT和LaPT1均提高了DMX产量(图3e–g),而截短HlPT-1则使DMX产量低于原始版本(图3h)。最终,我们选择截短的HlPT1LΔ1-86用于进一步实验。
优化途径以提高DMX生物合成
接下来,我们尝试优化生物合成途径以提高前体供应(图4a)。首先,我们优化MVA途径以提高DMAPP的供应量。通过将ERG20N127W的本底启动子替换为HXT1启动子(菌株YS119)或ERG1启动子(菌株YS120),进一步下调了DMAPP的转化。与母株YS116相比,DMX产量分别提高了2倍和1.4倍(图4b)。PHXT1是一个高葡萄糖诱导、低葡萄糖抑制的启动子,可帮助DMX生物合成与修饰的GAL调控系统同步。(42) 然而,这两种替换不仅未能提高NC/N产量,还降低了细胞生物量(补充图4a)。
我们还过表达了ERG10(编码乙酰乙酰辅酶A硫解酶)和突变型内源HMG-CoA还原酶HMG2K6R(菌株YS121)(43),使DMX产量比对照菌株YS116提高了1.9倍。在基因组中整合另外两拷贝HMG2K6R(菌株YS123),进一步使DMX产量比菌株YS121提高了34%。这些结果表明,在MVA途径中过表达限速基因可增加DMAPP供应,从而提高DMX产量。
然而,我们发现,与菌株YS121相比,菌株YS123中的前体NC/N产量略有下降(补充图4b),表明继续过表达MVA途径基因可能导致乙酰辅酶A过多流向MVA途径,从而减少丙二酰辅酶A的合成。这一现象与FPP生物合成的下调提高了NC/N产量(图2b中的菌株YS116)的观察结果一致,可能是由于乙酰辅酶A流向丙二酰辅酶A的通量增加。
因此,我们尝试构建一种异戊醇利用途径(IUP)(44),以通过缓解中心碳代谢的代谢压力来供应DMAPP。然而,在补充异戊醇后表达IUP未能提高DMX产量,反而减少了前体NC/N的生物合成(补充图5)。

a. 底物供应与酶融合的示意图 酶的过表达用紫色和蓝色表示,下调表达用灰色表示。通过过表达ERG10和HMG2K6R,并用启动子PHXT1或PERG1替换ERG20N127W的本底启动子,提高了DMAPP的供应。通过外源补充对香豆酸(p-CA)或过表达CHS_H1和HlCHIL2增强了NC的供应。通过带有连接肽(GGGS)3的融合蛋白IDI1-HlPT1LΔ1-86增强了DMX的产量。 *b.* 用PHXT1或PERG1替换ERG20N127W的本底启动子提高了DMX的产量。 *c.* 过表达ERG10和HMG2K6R提高了DMX的产量。 *d.* 在不同时间点添加对香豆酸(p-CA)以生产DMX。在0小时和24小时分别添加140 mg/L p-CA;在0小时+24小时分别添加140 mg/L p-CA两次;在24小时一次性添加280 mg/L p-CA。 *e.* 过表达CHS_H1、HlCHIL2或IDI1-HlPT1LΔ1-86融合蛋白提高了DMX的产量。所有菌株均在含20 mL最小培养基的100 mL摇瓶中培养。数据以均值±标准差表示(n=3独立生物样品)。通过Student’s t检验比较两组数据(*p < 0.05, p < 0.01, *p < 0.001),p值见图b、c、e。原始数据在数据文件中提供。
通过补充p-CA和优化酶表达提高DMX生产
由于在菌株中未检测到p-CA,我们推测增加p-CA的供应量可能进一步提高DMX的产量。补充不同浓度的p-CA有助于增加DMX产量(补充图6),其中在24小时补充280 mg/L p-CA使DMX产量提高了2.2倍(图4d)。有趣的是,几乎没有残留的p-CA,表明所有的p-CA都被转化为p-CA-CoA。因此,我们通过在菌株YS116中过表达CHS_H1和HlCHIL2,尝试提高p-CA-CoA向NC生物合成的转化。所得菌株YS125的DMX和NC产量分别比母株YS116提高了2.1倍和1.8倍(图4e),表明过表达CHS_H1和HlCHIL2驱动了代谢通量向NC生物合成和DMX生产转移。
尽管提高了DMAPP和NC的供应量增加了DMX产量,但DMX的产量仍较低(<150 μg/L)。考虑到信号肽的存在可能阻碍PTase酶快速接触底物DMAPP和NC,我们进一步表达了两拷贝HlPT1LΔ1-86,使菌株YSC1中的DMX产量提高到184 μg/L(图4e)。然而,与菌株YS125相比,HlPT1LΔ1-86的引入仅使DMX产量增加了23%。我们发现菌株YSC1中NC/N的总产量达到153 mg/L,表明胞质中已有足够的NC前体。由于IDI1催化IPP向DMAPP的异构化,我们将IDI1与HlPT1LΔ1-86融合,以促进DMAPP与PTase的快速相互作用。在基因组中整合两拷贝融合基因IDI1-HlPT1LΔ1-86的菌株YSC3的DMX产量达到4 mg/L,分别是菌株YS116和YSC1的83倍和21倍(图4e)。这些结果表明,IDI1-HlPT1LΔ1-86融合蛋白策略可以显著促进DMAPP与PTase酶之间的快速接触,从而提高DMX产量。
由于该融合策略的显著效果,我们进一步将两拷贝融合基因IDI1-HlPT1LΔ1-86转入菌株YSC3,构建了菌株YSC4(补充图7),以期进一步提高DMX产量。此外,由于HlCHIL2可增强HlPT1L酶的活性,我们尝试将HlCHIL2与HlPT1LΔ1-86融合以提高DMX产量。不幸的是,我们发现这两个融合蛋白的加入分别使DMX产量比菌株YSC3降低了77%(IDI1-HlPT1LΔ1-86)和65%(HlCHIL2-HlPT1LΔ1-86)(补充图7)。
通过过氧化物酶体分区实现DMX生物合成
我们发现底物DMAPP的供应对DMX生物合成过程中的异戊二烯基化反应至关重要。亚细胞器分区有助于选择性生产,因为它缓解了与胞质酶的竞争。(45) 过氧化物酶体是理想的分区,其通过脂肪酸β-氧化高效供应乙酰辅酶A,同时不存在脂肪酸合成和FPP竞争。(46-49) 这可能有助于积累DMX前体DMAPP和丙二酰辅酶A。因此,我们将p-CA起始的DMX下游途径分区到过氧化物酶体中,并重建了过氧化物酶体DMAPP生物合成途径(图5a)。
我们使用之前构建的p-CA高产(131 mg/L)菌株RB14作为底盘菌株(42),并在菌株RB14中过表达ARO1(编码莽草酸脱氢酶)、ARO2(编码莽草酸合酶)和ARO3(编码DAHP合酶),得到菌株RB99以进一步提高p-CA产量。在菌株YS1per中靶向过氧化物酶体表达内源性ACC1(ACC1per)*以及外源性*CHS_H1per和HlCCL1per,使NC/N的产量达到28 mg/L(图5b)。进一步通过表达IDI1per、HlPT1LΔ1-86per和HlCHIL2per将异戊二烯基化分区至过氧化物酶体(菌株YS2per)后,未能在工程化菌株中生产DMX(图5b, c)。

a. 工程化过氧化物酶体中DMX生物合成的代谢途径概览 前体p-CA在胞质中被高效生产。p-CA到DMX的三步反应被靶向至过氧化物酶体,基于p-CA高产底盘菌株RB99(粉色标注)。丙二酰辅酶A和MVA途径模块(橙色和蓝色标注)也被靶向至过氧化物酶体。
-
EfmvaEper:编码双功能乙酰乙酰辅酶A硫解酶/HMG-CoA还原酶
-
EfmvaSper:编码HMG-CoA合酶
-
ERG12per:编码甲瓦龙酸激酶
-
ERG8per:编码磷酸甲瓦龙酸激酶
-
ERG19per:编码甲瓦龙酸焦磷酸脱羧酶
-
IDI1per:编码异戊二烯焦磷酸异构酶
-
ACC1per:编码乙酰辅酶A羧化酶
-
HlCCL1per:编码4-香豆酸辅酶A连接酶
-
CHS_H1per:编码查尔酮合酶
-
HlCHIL2per:编码非催化查尔酮异构酶
-
HlPT1LΔ1-86per:编码截短型异戊二烯转移酶。
b. 过氧化物酶体中丙二酰辅酶A和DMX生物合成模块的工程化提高了前体NC/N的合成。 c. 在过氧化物酶体中构建完整的MVA途径,通过增强PTase表达和增加NC供应实现了DMX的de novo合成,并提高了DMX产量。 d. 优化MVA途径并过表达IDI1-HlPT1LΔ1-86per进一步提高了DMX的产量。所有菌株均在含20 mL最小培养基的100 mL摇瓶中培养。数据以均值±标准差表示(n=3独立生物样品)。通过Student’s t检验比较两组数据(*p < 0.05, p < 0.01, *p < 0.001)。原始数据在数据文件中提供。
在过氧化物酶体中重建MVA途径以提供足够的DMAPP前体
为了为DMX生产提供足够的DMAPP前体池,我们在过氧化物酶体中重建了MVA途径。我们表达了来自Enterococcus faecalis的EfmvaEper(双功能乙酰乙酰辅酶A硫解酶/HMG-CoA还原酶)和EfmvaSper(HMG-CoA合酶),以催化MVA途径的前三步反应,这些酶在酵母中具有高效率且不存在反馈抑制。此外,我们还在过氧化物酶体中表达了ERG12per、ERG8per和ERG19per。然而,含有过氧化物酶体MVA途径的工程化菌株YS5per仅生产出低水平的DMX(6 μg/L)。
我们随后通过在过氧化物酶体中额外添加两拷贝HlPT1LΔ1-86per(菌株YS8per)增强异戊二烯基化步骤,DMX产量略有提高(图5c)。随后,在菌株YS8per中表达CHS_H1per和HlCHIL2per,所得菌株YS9per的DMX产量比母株YS8per提高了63%(图5c)。
在增强异戊二烯基化步骤后,我们通过表达另外两拷贝最关键基因ERG12per(菌株YS11per)进一步尝试提高DMAPP的供应量,DMX产量增加了100%(图5d)。这一改进促使我们进一步优化过氧化物酶体MVA途径。因此,我们在高拷贝质粒中共同过表达了ERG12per、EfMVAEper和EfMVASper以及HlPT1LΔ1-86per,所得菌株YS12per的DMX产量比菌株YS9per提高了2.7倍(图5d)。此外,我们尝试表达融合基因IDI1-HlPT1LΔ1-86per以将DMAPP导向PTase(菌株YS15per),其DMX产量比菌株YS9per提高了1.7倍。
然而,尽管进行了这些优化,DMX的产量仍然较低(<100 μg/L),远低于胞质途径的产量(菌株YSC3中的4.0 mg/L)。这种低产量可能归因于过氧化物酶体中PTase酶活性低或DMAPP供应不足。
黄腐醇的生物合成
最后,我们尝试通过在胞质DMX生物合成途径菌株YSC3中表达来自H. lupulus的O-甲基转移酶基因HlOMT1来实现黄腐醇的生物合成(图6a)。在底盘菌株YSC3中分别表达原始版本的HlOMT1和密码子优化版本HlOMT1sc。所得菌株YSC6(HlOMT1)和YSC7(HlOMT1sc)分别生产出49 μg/L和142 μg/L黄腐醇(图6b),并通过液相色谱-质谱分析验证了黄腐醇的生产(补充图8)。
高水平DMX的积累(1.1–2.2 mg/L)表明,为了从DMX高效生产黄腐醇,甲基化步骤应进一步增强。

a. 从DMX通过O-甲基转移酶(HlOMT1)合成黄腐醇的示意图 b. 通过过表达HlOMT1和密码子优化版HlOMT1sc(适用于酿酒酵母的表达)生产黄腐醇(XAN)。所有菌株均在含20 mL最小培养基的100 mL摇瓶中培养。数据以均值±标准差表示(n = 3 独立生物样品)。通过Student’s t检验比较两组数据(*p < 0.05, p < 0.01, *p < 0.001)。原始数据在数据文件中提供。
讨论
啤酒花(Humulus lupulus L.)是多种次级代谢产物的重要来源,包括精油、苦味酸和类黄酮,这些物质具有潜在的医学应用。微生物合成被认为是高效生产啤酒花中低含量天然产物(如苦味酸和精油)的一种可行方法。(17,51) 黄腐醇是一种功能性类黄酮,存在于啤酒中,具有多种药理作用。然而,其复杂的生物合成路径为微生物中的de novo合成带来了挑战。在本研究中,我们通过优化生物合成途径和重新构建细胞代谢,系统性地工程化了酿酒酵母(Saccharomyces cerevisiae),以实现黄腐醇的de novo生物合成。
为了便于途径的构建和优化,我们将重建的代谢途径分为三个模块:p-CA-CoA、丙二酰辅酶A(malonyl-CoA)和MVA生物合成途径。在研究中,我们发现,NC与DMAPP的异戊二烯基化是DMX生物合成的限制性步骤,因为工程化菌株中的DMX水平远低于前体NC的水平。先前的研究也表明,异戊二烯基化是异戊二烯化合物生物合成中的一个限制性步骤。(38,52,53) 因此,异戊二烯基化步骤需要增强以提高DMX产量。在本研究中,我们通过酶筛选、截短信号肽和提高表达水平等手段改进PTase活性,从而显著改善了从NC到DMX的生物合成。
除了PTase活性外,DMAPP的有限可用性是实现高效异戊二烯基化的另一个瓶颈。(54,55) 这是因为DMAPP在酵母中被严格调控,并被高效转化为FPP以参与羊毛甾醇的生物合成。(56) 我们开发了多种途径工程策略,通过减少DMAPP向FPP的消耗、表达突变的FPPS基因(ERG20N127W)、下调ERG20N127W的表达以及过表达MVA途径中的关键限速基因来提高DMAPP的供应。此外,通过酶融合提高DMAPP向PTase的可用性。尽管这些策略改善了DMX的生产,但产量仍低于0.1 mg/L。有趣的是,表达IDI1-HlPT1LΔ1-86融合酶(编码IPP异构酶和截短型PTase的融合蛋白)使DMX产量相比单独表达HlPT1LΔ1-86基因提高了21倍。这种改进不仅增加了DMAPP的供应,还通过缩短距离促进了DMAPP与PTase的接触。因此,我们研究中的高产量限制关键在于异戊二烯供体的可用性以及底物与PTase的共定位,这也得到了其他关于酵母中异戊二烯化合物生产研究的支持。(38,54,55,57) 此外,可以通过蛋白质工程改造PTase以提高其对特定底物供体的选择性。(39,58)
最后,通过过表达优化版的O-甲基转移酶基因HlOMT1,我们实现了黄腐醇在酵母中的de novo生物合成。然而,较低的产量(0.14 mg/L)表明,HlOMT1的活性和/或SAM的循环再利用需要进一步增强,以提高DMX向黄腐醇的转化效率,因为在工程化菌株中仍积累了大量的DMX。此外,黄腐醇的生物合成涉及p-CA-CoA、丙二酰辅酶A和DMAPP三种前体的平行生物合成途径,这与单通道生物合成途径(如萜类化合物生物合成)不同(补充图1),因此需要仔细平衡平行的生物合成模块。具体而言,我们通过消除反馈抑制和敲除竞争途径,增加了由芳香酸途径产生的前体p-CA-CoA的生物合成。DMAPP的供应增加具有挑战性,因为其生物合成与丙二酰辅酶A共享关键节点乙酰辅酶A,并且容易转化为FPP。我们通过启动子替换、关键酶的突变和限速酶的过表达仔细平衡了途径通量,以提供足够的异戊二烯基DMAPP和丙二酰基丙二酰辅酶A。此外,我们观察到通过ERG20突变增强DMAPP供应会减缓细胞生长,这需要精确的调控策略来平衡细胞适应性与DMAPP积累。
通过系统和模块化地重构酵母的细胞代谢,我们成功实现了从廉价碳源葡萄糖中de novo生产黄腐醇。这些在平衡前体平行生物合成方面的策略或许也对其他复杂天然产物的生产改进具有帮助。
方法
菌株、质粒和试剂
Escherichia coli DH5α 用于质粒构建与扩增。酿酒酵母 (S. cerevisiae) 菌株 SY03(MATa, MAL2-8c, SUC2, his3Δ, ura3-52, gal80Δ, XI-5::PTEF1-Cas9-TCYC1)来源于 CEN.PK113-11C(MATa, MAL2-8c, SUC2, his3Δ, ura3-52),被用作菌株构建的背景菌株。(59) 酵母菌株的构建流程详见补充图9,工程化菌株和质粒的详细基因型分别列于补充数据2和3中。 基因扩增使用的PrimeStar DNA聚合酶由 TaKaRa Biotech(中国大连)提供;PCR验证的2× Taq Master Mix聚合酶及质粒构建的MultiS One Step Cloning Kit由 Vazyme Biotech(中国南京)提供。DNA胶回收及质粒提取试剂盒由 OMEGA Biotech(美国)提供。所有引物(补充数据4)由 Sangon Biotech(中国上海)合成。酵母提取物、胨、琼脂粉、胨粉及其他化学品除非另有说明,均由 Sangon Biotech 提供。所有化学标准品除特别说明外均购自 Sigma-Aldrich。DMX 分析标准品由 Yuanye Biotech(中国上海)合成。所有密码子优化的外源基因(补充数据5)由 Genewiz 合成。来源于Enterococcus faecalis的 EfmvaS (GenBank-KX064238) 和 EfmvaE (GenBank-KX064239) 也由 Genewiz 合成。
基因工程
基因敲除和整合通过 CRISPR/Cas9 系统完成。(60) gRNA 表达质粒的构建采用高效组装方法。(59) 简而言之,质粒骨架片段和两个含有特异性20 bp序列的片段被扩增,然后这三个片段通过 MultiS One Step Cloning Kit 体外组装成质粒。组装的混合物被转化到E. coli中,并通过 DNA 测序验证质粒是否正确。gRNA 质粒的特定20 bp序列由 CHOPCHOP 网站工具 (http://chopchop.cbu.uib.no) 设计。所有基因敲除和整合所需的供体DNA通过一锅法融合 PCR 组装后整合到相应的基因组位点。(22)
用于基因敲除的供体DNA由上游和下游同源臂的融合片段制备。基因组整合的供体DNA通过融合启动子、目标基因、终止子和同源臂组装(补充图10)。ERG20 的原位定点突变为 ERG20N127W 使用双端选择标记 (Two-ESM) 方法完成。(59) ARO4K229L、ARO7G141S 和 HMG2K6R 基因通过靶向突变 PCR 构建。ACC1 的启动子(从-547 bp到-1 bp)被 PTEF1 替换,ERG20N127W 的启动子(从-563 bp到-1 bp)被 PHXT1 或 PERG1 替换。
为了进行酶筛选,不同来源的 PTase 基因及其截短版本(补充图3)经过密码子优化后用于酿酒酵母的表达,并通过 BamHI/HindIII 消化后克隆至 pESC-URA。ScCHK + IPKSc + HlPT1LΔ1-86 和 EfmvaEper + ERG12per + EfmvaSper + HlPT1LΔ1-86per 片段也被组装到 pESC-URA 中,对应质粒命名为 pESC-IUP 和 pESC-per。IDI1-HlPT1LΔ1-86 和 CHIL2-HlPT1LΔ1-86 融合蛋白通过 (GGGS)3 连接肽组装。蛋白靶向至过氧化物酶体通过在其C端添加包含灵活连接肽GGGS的过氧化物酶体信号实现。所有酿酒酵母转化子通过菌落PCR和DNA测序验证。
E. coli 转化按照化学转化法进行。(61) 简而言之,将组装好的 DNA 载体直接加入到E. coli 感受态细胞悬液中,然后将细胞悬液冰浴,42°C热冲击后,在37°C预培养液中培养,再涂布于LB琼脂平板上,并于37°C过夜培养。
菌株培养
除特别说明外,E. coli 菌株在 Luria-Bertani (LB) 培养基(10 g/L 胨,5 g/L 酵母提取物,10 g/L NaCl)中37°C、220 rpm 条件下培养(Zhichu Shaker ZQZY-CS8)。通常补充 100 mg/L 氨苄青霉素以维持质粒。酵母菌株一般培养于 YPD 培养基(20 g/L 胨,10 g/L 酵母提取物,20 g/L 葡萄糖)。含 URA3 基因的质粒菌株选择于不含尿嘧啶的合成完全培养基 (SD-URA),培养基成分包括 6.7 g/L 不含氨基酸的酵母氮源 (YNB) 和 20 g/L 葡萄糖。URA3 标记在含有 6.7 g/L YNB、20 g/L 葡萄糖和 1 g/L 5-氟乳清酸 (5-FOA) 的 SD + 5FOA 平板上被移除。
摇瓶批量发酵在含20 mL最小培养基(Delft-D,含 2.5 g/L (NH4)2SO4、14.4 g/L KH2PO4、0.5 g/L MgSO4·7H2O、20 g/L 葡萄糖及微量金属和维生素溶液(62))的100 mL摇瓶中进行。所有上述培养基在需要时补充40 mg/L 组氨酸和/或60 mg/L 尿嘧啶。20 g/L 琼脂用于制备固体培养基。酵母细胞以初始 OD600 为0.2接种,在30°C、220 rpm条件下于液体培养基中培养96小时(Zhichu Shaker ZQZY-CS8)。在摇瓶培养的对数生长期,通过 OD600 对数值与时间曲线的线性回归斜率确定最大比生长速率(μmax)。
产品提取与定量分析
提取方法
为了提取黄腐醇(xanthohumol)和去甲基黄腐醇(DMX),采用低温超高压连续流细胞破碎机破碎酵母细胞。从摇瓶批量发酵中取10 mL发酵液,在1800 MPa条件下循环破碎三次。然后,将每份2 mL处理后的细胞培养液加入等体积的乙酸乙酯中,充分振荡(1600 rpm)15分钟。收集乙酸乙酯相,干燥后用甲醇重悬。在分析前,提取液通过0.2 µm有机膜过滤。
定量方法
所有提取样品均通过高效液相色谱(HPLC)进行定量分析。样品使用 Poroshell 120 EC-C18 柱(2.7 μm, 3 × 100 mm, Agilent)通过配备光二极管阵列检测器的 1260 Infinity II HPLC(Agilent)进行分析。采用两种溶剂的梯度洗脱法:
-
溶剂A:0.05%甲酸水溶液
-
溶剂B:含0.05%甲酸的乙腈
洗脱条件如下:
-
0–10分钟:溶剂B从20%线性梯度增加至55%;
-
10–20分钟:溶剂B从55%线性梯度增加至65%;
-
20–23分钟:溶剂B从65%线性梯度增加至90%;
-
23–24分钟:溶剂B保持在90%;
-
24–26分钟:溶剂B从90%线性梯度降低至20%;
-
在注入下一样品之前,系统使用初始条件(20% B)平衡5分钟。
流速设置为0.30 mL/min。目标产物p-CA和N通过测量288 nm处的吸收值检测,DMX和黄腐醇通过测量370 nm处的吸收值检测。
为了定量分析黄腐醇,使用了Agilent 1290 Infinity II UHPLC系统,结合6470 A三重四极杆质谱仪和ThermoFisher Q Exactive Hybrid Quadrupole-Orbitrap质谱仪,采用正电加热电喷雾电离模式(positive heated electrospray ionization mode)。




























 1877
1877

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








