

2024年3月8日,由中国农业科学院作物科学研究所童红宁研究员领衔的研究团队在Science发表题为“Enhancing rice panicle branching and grain yield through tissue-specific brassinosteroid inhibition”的研究论文。该研究报道了复粒稻多粒簇形成的机制,揭示了BRs在通过精确的分生组织过渡来协调穗分枝和粒数方面的开创性作用。其中,研究找到BR分解代谢基因油菜素内酯缺乏的DWARF3(BRD3),还发现了一种支持这一功能的组织特异性BR通路,涉及BR信号抑制剂激酶GSK2,它可以磷酸化并稳定转录因子OsMADS1。随后,研究利用ChIP-seq和RNA-seq找到了OsMADS1的下游靶基因RCN2;进而确定了组织特异性的BR通路(BRD3-BR-GSK2-OsMADS1-RCN2)。爱基百客为该研究提供ChIP-seq和RNA-seq的技术支持。
研究背景
作物育种本质上是在平衡各种特征以实现植物最佳表现的艺术。然而,由于特征之间复杂的关系,实现最佳平衡具有挑战性。一个主要障碍是各种特征之间的权衡,比如谷粒大小和数量之间的权衡。植物甾醇(BRs)是一类类固醇激素,促进谷粒大小并已被证明可以增强作物产量。尽管它们具有潜力,但BRs的多效性影响阻碍了它们在作物改良中的应用,并且它们在调节谷粒数量方面的作用仍不清楚。
研究结果
1. CL提高了穗分枝和籽粒产量,分枝时间延长导致籽粒数增加
CL1是典型的CL(clustered-spikelet rice,聚类小穗水稻/复粒稻)品种,呈簇状生长,主要由三粒组成。为了便于比较,研究团队利用CL1作为回交亲本,培育了一个非CL品种(NCL1)。然后,从形态、穗长、穗数、抽穗日期、千粒重、产量和籽粒质量等方面进行了比较。总的来说,CL促进了籽粒数和产量。这些结果也表明,CL特征在作物改良方面具有巨大潜力。
在水稻穗发育过程中,依次产生了一系列具有不同特征的横向分生组织(图1R)。研究对穗状体发育过程进行了电镜扫描(图1S-V)。基于这些观察,研究团队得出结论,有三种发育现象驱动了CL的形成:(i)更多的SBMs(次级分生组织)的发育,(ii)多生SM(小穗分生组织)的启动,以及(iii)缩短的花梗。
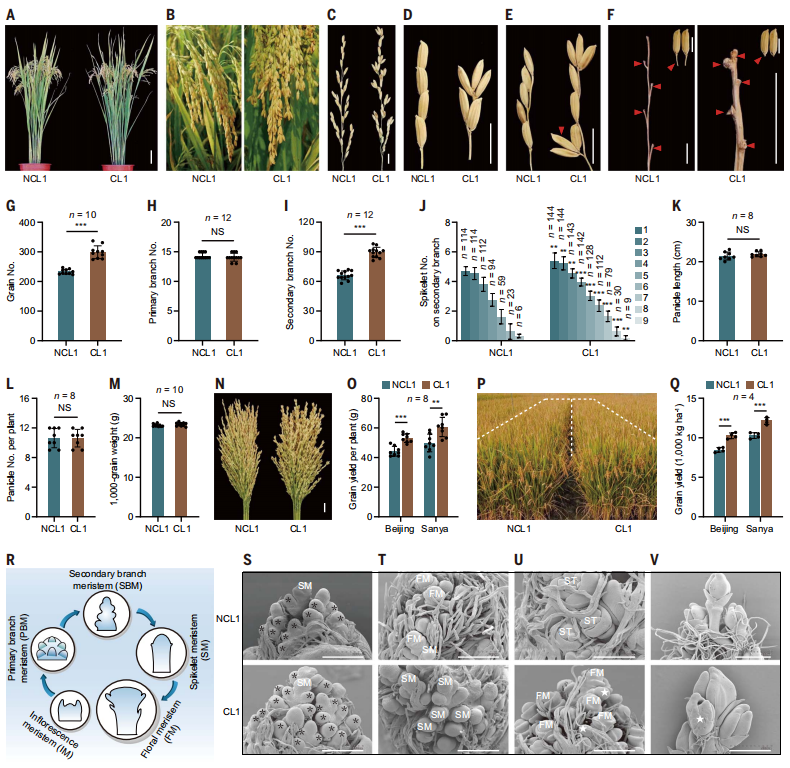
图1:CL促进了籽粒数和产量。
2. 通过筛选CL抑制因子来克隆致病基因
采用化学方法诱变CL,从10000个独立突变系(M1)中,检测M2植物的表型(每株16个),鉴定出两个恢复为野生型NCL表型(不簇生)的突变系,将其命名为cl1-1和cl1-2(图2B)。通过比较从cl1×CL1回交的F2群体中汇总的NCL和CL植株,研究发现,与CL1相似,cl1-1和cl1-2的谷物数量显著减少,因为它们的次生分枝数量较少(图2D-F)。两种突变体均具有与NCL1和CL1相同的植株结构、穗数、穗长和千粒重。利用BSA,鉴定到一个关键基因BRD3(BR代谢酶基因)。研究使用CRISPR-Cas9技术在CL1背景下编辑BRD3基因。所有的编辑品系(包含移码突变))(cl-cc)均显示出NCL表型。此外,与NCL1相似,cl-cc敲除突变体与CL1相比,株粒数和产量减少,而在穗长、穗数和粒重方面没有显著差异。这些分析提供了强有力的证据,表明所鉴定的候选基因负责CL表型和提高籽粒生产力。
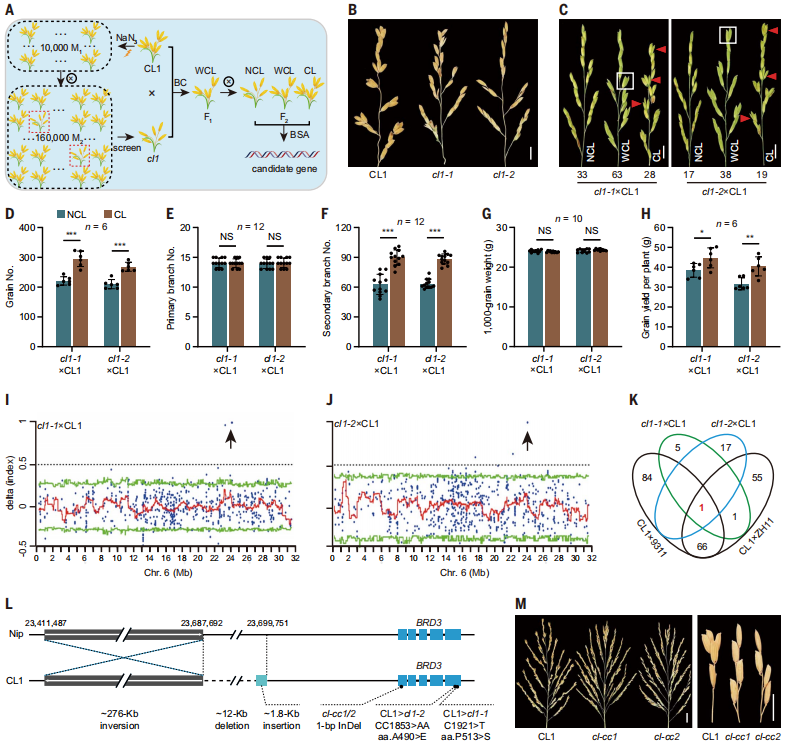
图2. BRD3作为CL致病基因的克隆。
3. BRD3的上调与CL的结构变化相关
BRD3编码一种功能性的BR降解酶,组织表达分析显示,BRD3在生殖组织中高表达。与NCL1和ZH11相比,CL穗中BRD3的表达高~3-5倍(图3A)。与BRD3表达的变化相一致,油菜素甾酮的含量在CL1中明显低于NCL1(图3B)。这些分析表明,CL中BRD3的上调促进了BR的降解,导致了CL的特征表型。
为了确定导致CL性状的潜在致病突变,研究对CL1到CL4以及ZH11和9311中的BRD3基因以及进行了全长测序。在启动子和编码区检测到大量的多态性;然而,没有一个对CLs特异。为了获得更全面的了解,研究结合使用了第二代和第三代测序技术来重新组装该区域的基因组。该结果揭示了CL1中存在巨大的结构变异,包括~276kb的倒置,~12 kb的缺失,以及位于BRD3启动子上游约5 kb的~1.8 kb的插入(图2L)。PCR分析证实,在所有CLs中均存在倒置和缺失,但在任何NCLs中均不缺失。这一特征强烈表明,结构变异负责激活CLs中BRD3的表达。因此,将把整个CL相关位点称为CL,并以BRD3做接下来的研究。
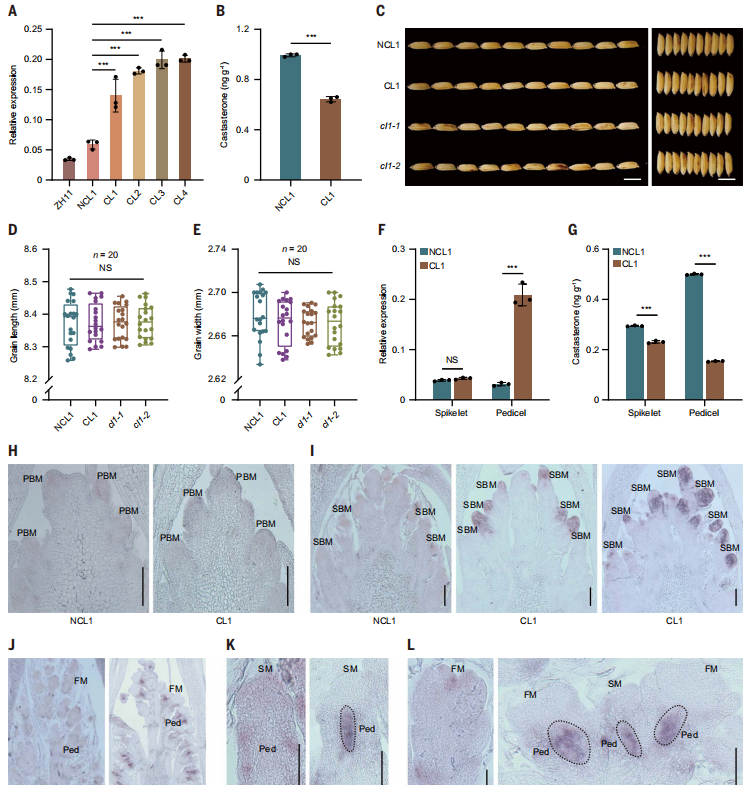
图3:CL1的次生分支分生组织和花梗中BRD3表达的特异性增强。
4. 特异性激活CL1的次级分生组织和花梗中的BRD3
BR缺陷植物通常表现出籽粒变小和植株高度降低。与这些表型一致,先前的研究表明,BRD3的持续过表达会强烈抑制植物的生长和发育。然而,CL1、cl1-1、cl1-2和NCL1在籽粒大小和株高上无明显差异。由于CL与花梗缩短密切相关,研究首先比较了BRD3在NCL1和CL1的花梗和小穗中的表达模式。BRD3在CL1的花梗中表达上调,而在小穗中没有表达上调(图3F)。为了证实这一结果,研究还测量了两种品系在这些组织中的BR含量。与BRD3的表达模式一致,与NCL1小穗和花梗相比,CL1小穗的水平仅低~20%,而CL1花梗的水平低~70%(图3G)。
研究团队进一步进行了RNA原位杂交来确定BRD3在穗发育过程中的时空表达模式。在NCL1花序的发育过程中,BRD3的表达非常弱,并且对任何组织都没有特异性(图3H和I)。相反,在CL1穗中,研究团队检测到了SBM的顶部向下发育中的特定信号,但在PBM中未检测到(图3H和I)。在SM或FM发育阶段,BRD3在小穗基部特异性表达,对应于花梗位置,而不是NCL1(图3J-L)。作为一个负对照,当BRD3被用作sense探针时未检测到信号。BRD3表达模式和植物表型之间的强关系表明,BRD3表达的空间增强导致谷粒数量增加,对谷粒大小没有影响。
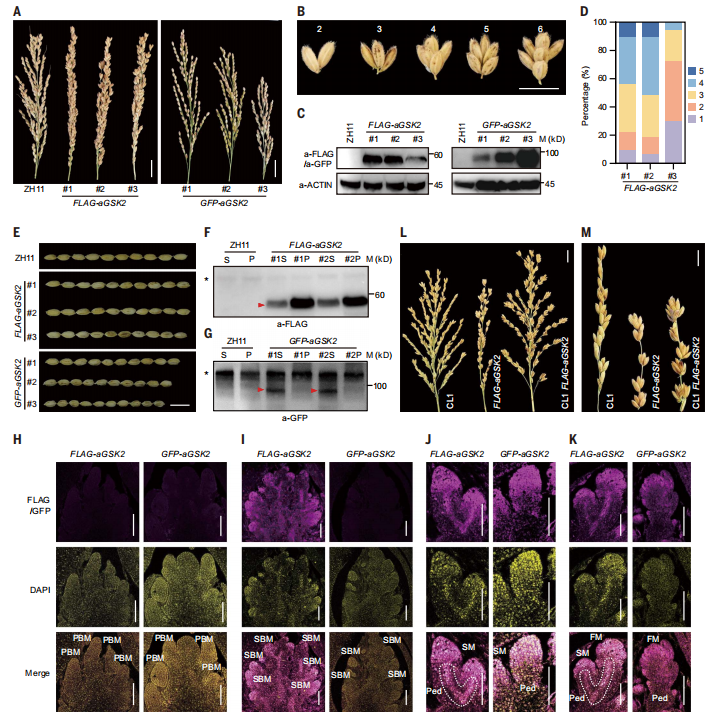
图4: GSK2的空间特异性表达产生CL。
5. GSK2的空间表达产生CL
由于CL1中BRD3的空间上调通过BR信号通路抑制了BR的生物合成和BRs的功能,因此空间抑制BR信号通路的表达也可以促进CL的发展。GSK2是BR信号通路的中心负调控因子,研究团队已经产生了许多过表达GSK2激活形式(aGSK2)的转基因植物,有融合或不融合不同的标签,包括FLAG、绿色荧光蛋白(GFP)和GFP-Myc。大多数这些植物(GFP-aGSK2,GFP-Myc-aGSK2,aGSK2)表现出典型的BR缺陷表型,如矮小和小颗粒,而FLAG-aGSK2过表达系列由于多个小穗的聚类生长而表现出密集紧凑的分枝(大多数情况下为2到6个,其中大多为3个;图4A和B)。免疫印迹分析证实了表型的严重程度与FLAG-aGSK2蛋白水平一致(图4C和D)。进一步分析发现,FLAG-aGSK2品系拥有比ZH11更多的次级分枝,以及次级分枝上的更多小穗,而主分枝数量没有差异,这些特征明显与CL表型非常相似。
BR相关分析(包括叶片倾斜试验,BR生物合成基因评估和BR定量)表明FLAG-aGSK2蛋白具有功能,但其抑制BR信号的能力可能减弱。与ZH11相比,FLAG-aGSK2在粒径和粒重方面没有发现差异,株高仅略有下降(图4E)。值得注意的是,FLAG-aGSK2籽粒数显著提高,使每株籽粒产量提高了14.7~27%。然后,研究评估了FLAG-aGSK2的花梗和小穗中的GSK2蛋白水平。在两个测试的独立品系中,FLAG-aGSK2在花梗中积累较高,但在小穗中积累少得多(图4F)。相比之下,GFP-aGSK2在小穗中含量丰富,但在花梗中几乎检测不到(图4G)。
研究进一步进行了免疫荧光分析,比较了这两种融合蛋白在相应植株的穗状发育过程中的空间分布。值得注意的是,而FLAG-aGSK2和GFP-aGSK2在PBM中均未被检测到(图4H),仅在FLAG-aGSK2的SBM上检测到强荧光信号,而在GFP-aGSK2上未检测到(图4I)。FLAG-aGSK2在整个花序中的扩散表达与总体紧凑的穗形态一致(图4I)。随着进一步发育,这两种蛋白在次生分生组织(SM)和花序分生组织(FM)中表达丰富,而只有FLAG-aGSK2,在花梗中明显表达,而GFP-aGSK2没有(图4J和K)。这些分析表明,FLAG标签在某种程度上影响了融合蛋白的分布。就像NCL1和CL1中BRD3的情况一样,这些分子特征与植物表型一致,表明CL表型受到BRD3或FLAG-aGSK2特定表达赋予的空间限制的BR功能调控。
为评估BR对CL表型的影响,研究将CL1与两种BR增强品系进行杂交,并进行了表型观察。这一部分的结果表明,有缺陷的BR信号通路放大了由BR缺陷引起的CL表型。
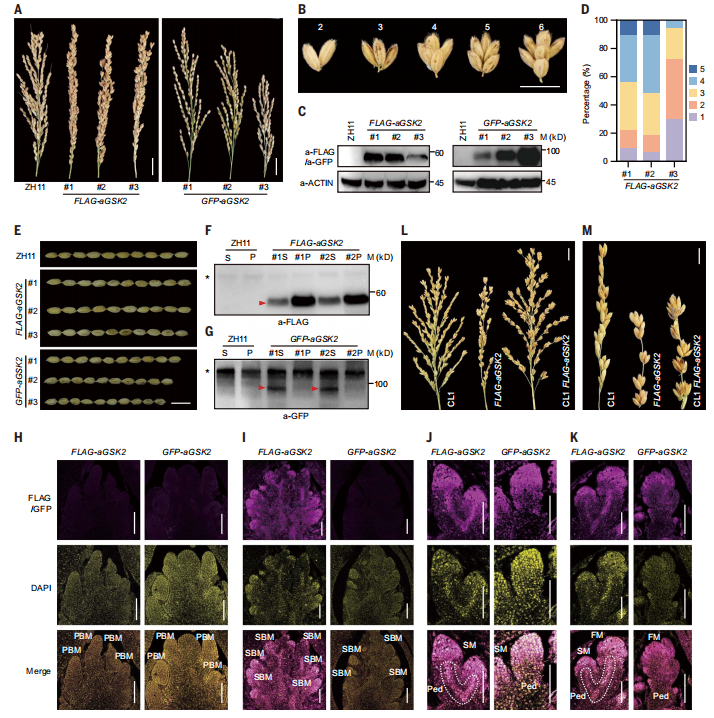
图4:GSK2的空间特异性表达产生CL。
6. GSK2磷酸化OsMADS1以促进其稳定性
GSK2通过靶向多个下游调控蛋白,作为各种BR反应的调节器。为了进一步深入探讨CL中BR的调控机制,研究使用GSK2作为诱饵进行酵母双杂交筛选,结果发现潜在的CL调节因子OsMADS1作为GSK2的候选相互作用蛋白。首先,使用OsMADS1的全长编码序列在酵母中确认了这种互作(图5A)。OsMADS1包含四个结构域,包括MADS结构域(M)、中间结构域(I)、角蛋白样结构域(K)和C端结构域(C)。研究进行了基于结构域的缺失实验,发现只有在M、I和K结构域同时存在时,OsMADS1才能与GSK2发生相互作用(图5B)。随后,还利用了诸如pull down等实验进一步证明了它们的互作关系。
此前研究表明GSK2激酶可以磷酸化其底物,于是研究进行了测试,看GSK2能否磷酸化OsMADS1,结果表明GSK2的磷酸化导致了OsMAD1的迁移。对磷酸化的OsMADS1的质谱分析确定了三个磷酸化位点,分别位于16位丝氨酸(S16),20位苏氨酸(T20)和S138(图5D)。为了分析这三个位点对OsMADS1的影响,研究将这三个位点进行了突变,创建了其磷死亡形式(在体外不能被GSK2磷酸化)。免疫荧光(图5E)和蛋白印记(图5F)分析表明,GSK2磷酸化OsMADS1,增强了OsMADS1蛋白的稳定性。
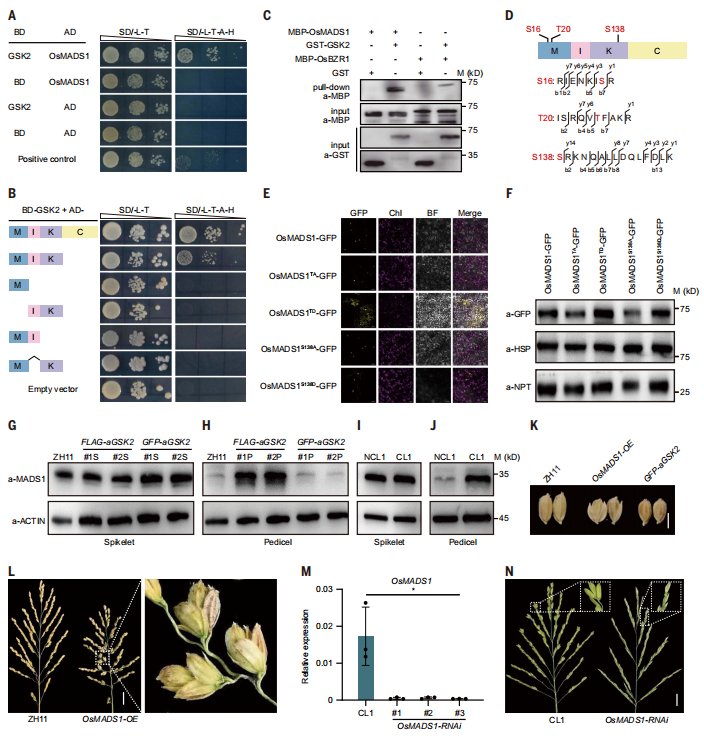
图5:GSK2磷酸化OsMADS1以介导CL的发生。
7. OsMADS1在CLs的花梗中积累
考虑到GSK2靶向并促进OsMADS1,OsMADS1蛋白应该像FLAG-aGSK2蛋白或BRD3转录本一样在CL植物中特异性积累。为了验证这一观点,研究分析了FLAG-aGSK2和GFP-aGSK2品系中穗和花梗中OsMADS1蛋白水平。与野生型比较,在小穗中,OsMADS1在GFP-aGSK2中含量较高,而在FLAG-aGSK2中丰度相似(图5G)。相比之下,在花梗中,OsMADS1在FLAG-aGSK2中大量积累,但在GFP-aGSK2中没有积累。这些数据清楚地表明,OsMADS1和GSK2在GFP-aGSK2和FLAG-aGSK2中的分布模式高度相似(图4F和G,图5G和H)。此外,其分布模式也与植物表型一致:GFP-aGSK2的籽粒较小,而FLAG-aGSK2的花梗缩短,粒径正常(图4E)。
研究随后将分析扩展到CL1和NCL1。与NCL1相比,CL1的花梗中OsMADS1水平更高,但在小穗中没有明显差异(图5I和J)。这些模式与FLAG-aGSK2中观察到的模式相似。综合这些结果表明,OsMADS1在GSK2下游发挥作用,调节CL发育的BR调控。
8. 敲除OsMADS1可消除CL表型
与GSK2类似,OsMADS1已被表征为籽粒大小的负调节因子。此外,OsMADS1被认为参与调节分生组织特性,可能增加小穗数量。对过表达OsMADS1的植株(OsMADS1-OE)的检查确认,其颗粒明显较小,类似于野生型ZH11,而不像GFP-aGSK2(图5K)。值得注意的是,几乎每个穗上都清晰观察到两到三个小穗的聚集生长,一些分枝显示出典型CL特征的强烈相似性(图5L)。OsMADS1-OE中CL表型的出现表明OsMADS1介导了GSK2对CL特征的调节。
为了验证这一观点,研究在CL1中进行了OsMADS1的RNAi。在生成的抑制OsMADS1品系中(图5M),CL表型被消除(图5N),表明OsMADS1对CL表型是必要的。这些发现,共同确立了OsMADS1在GSK2下游发挥作用,调节CL的发育。
9. OsMADS1在CL1的SBM中的特异性积累
为了提供OsMADS1蛋白的空间分布模式的直接证据,研究进行了免疫荧光分析,跟踪花序发育过程中蛋白质的丰度。尽管无法在CL1和NCL1的PBM中检测到OsMADS1蛋白,但特定的荧光信号仅在CL1的SBM中检测到,而在NCL1中没有检测到(图6A和B)。此外,信号仅限于位于顶端的SBM,这可能处于从SBM到SM的过渡阶段,暗示OsMADS1参与了这一过程。随着进一步发展,OsMADS1开始在NCL1和CL1中的SM以及FM中大量表达(图6C和D),这与之前报道的OsMADS1作为花器官调节器的核心功能一致。值得注意的是,在CL1的花梗中心还检测到了明显的OsMADS1荧光信号,而在NCL1中则没有该信号。这种特定的表达模式与上述免疫印迹结果完全一致,并让人联想到BRD3的原位RNA表达:与NCL1相比,BRD3转录本和OsMADS1蛋白都特异性地在CL1的SBM以及与花梗相对应的细胞中积累。综合这些结果表明,OsMADS1的特定积累介导了由BRD3或GSK2的特定分布引起的CL的发生。
10. OsMADS1靶向一个末端的FLOWER1样基因
为了更深入地了解转录因子OsMADS1的功能,研究进行了染色质免疫沉淀测序(ChIP-seq)和RNA测序(RNA-seq)并进行联合分析,旨在识别由OsMADS1调控的靶基因。利用OsMADS1-OE植株的幼小花序(长约5毫米)作为材料,ChIP-seq分析检测到与1320个基因相关联的1650个OsMADS1结合峰(图6E)。同时,RNA-seq分析鉴定了1354个差异表达基因(DEGs)。通过对两个数据集进行联合,鉴定出46个基因均为OsMADS1结合基因和受OsMADS1调控的DEGs(图6E),因此,它们被认为是OsMADS1的直接靶点。根据水稻数据库(https://ricedata.cn/),其中15个已经得到了功能表征(图6F)。
其中,RICE CENTRORADIALIS2(RCN2)是调控CL发育的最佳靶点,在ChIP-seq中富集倍(~9.84倍)排名第三,在RNA-seq中表达变化(~5.83倍)排名第二(图6F)。此外,使用IGV进一步检测表明,RCN2上的结合峰具有高度的特异性(图6G)。值得注意的是,以往的研究表明,水稻中所有4个RCN基因RCN1到RCN4(作为拟南芥末端花1(TFL1)的对应基因),通过延缓分生组织向花分生组织的过渡,在促进穗分枝中发挥关键作用。RCN2的过表达也导致了更密集的穗状形态,初级枝的数量与野生型相当,而次级枝和高阶枝的数量大幅增加,这导致了小穗数量的增加。这一观察结果与CL植物的花序发育特征相一致。
为了验证这一发现,研究进行了RNA原位杂交实验,研究了NCL1和CL1在花序发育过程中RCN2的时空表达模式。在NCL1中,RCN2的表达在任何检测的组织中均未被检测到(图6H至J),与先前的报道一致。相比之下,研究观察到CL1花序的SBM中出现了特定信号,而在PBM中没有(图6H和I)。研究进一步通过CRISPR-Cas9基因组编辑在CL1背景中生成了带有核苷酸缺失的rcn2-cc突变体,CL表型被消除(图6K)。这些结果表明,OsMADS1的空间积累导致了RCN2的特定表达,导致从SBM到FM的过渡延长,最终导致更多的次级分枝和籽粒的产生。
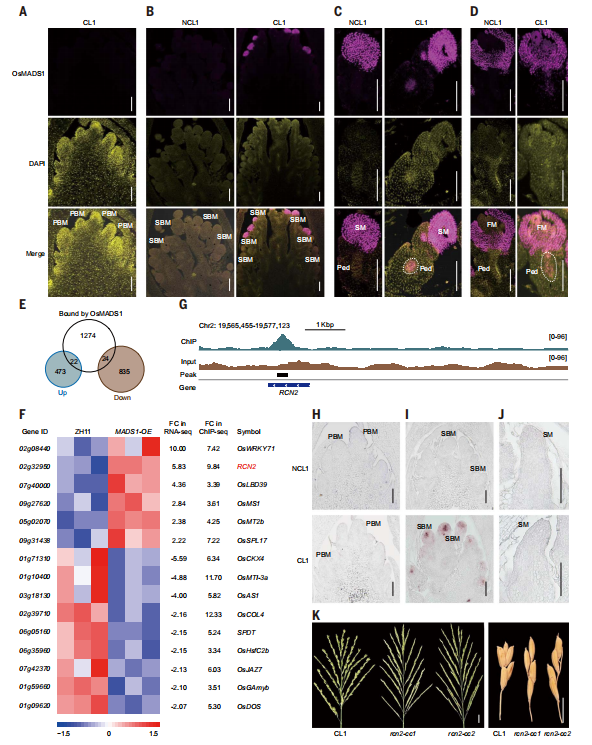
图6:OsMADS1靶向并上调RCN2。
11. 利用CL进行高产育种
研究团队对NCL1、CL1、cl1-1和cl1-2进行的评估表明,CL在增加稻谷产量方面是有效的。接下来,研究将调查扩展到包括ZH11、9311和Yixiang1B(一种广泛用于杂交育种的维持系精英品种)在内的三个热门品种。将CL特征引入这些品种是通过反交和自交直到背景品种和它们各自的导入系之间除了花序形态之外没有明显差异为止。田间评估显示,将CL引入这三个品种中的任何一个都显著增加了每株的谷物数量和产量。
Gn1a,对应于CKX2的缺陷等位基因,已被确定为水稻中具有高育种价值的谷粒数量关键调节因子。为了检查CL是否影响Gn1a的作用,研究使用CRISPR-Cas9在CL1中编辑了CKX2(图7A),并发现在CL存在的情况下,敲除CKX2仍然保留促进谷粒数量的能力(图7B)。与CL1相比,每株的产量进一步提高了18.3%(图7C)。这一结果启发研究团队将CL和Gn1a结合起来用于育种目的。
Shuhui498(R498)是中国西南地区广泛栽培的重穗NCL优良品种,携带Gn1a零等位基因,增强了籽粒数和抗倒伏能力。通过CL1与R498杂交,成功开发出新的水稻品种CL5(图7D)。该品种结合了Gn1a和CL的好处,以及来自CL1或R498的几个额外的有利性状基因等位基因。在北京,CL5的每穗粒数分别比R498和CL1多106.3和48%。在三亚,与R498和CL1相比,CL5的每穗谷粒数量分别提高了81.5%和39.7%,显示出显著改善(图7E和F)。此外,CL5还具有其他有利特征,如粗茎、较重的谷粒、高产量(图7G),展示了将CL和Gn1a结合以提高稻谷产量的前景潜力。
12. 其他物种聚集生长中的BR变化
虽然,研究证明了BR耗竭控制了水稻中的CL(图7H),但研究团队想知道这是否代表了一种普遍机制,适用于植物物种间的簇类生长。天鹰椒(Capsicum annuum L. var. fasciculatum)显示多朵花聚集在单个花蕾形成节点上,而普通辣椒(Capsicum annuum L.)只有一朵花附着在节点上。研究测量了普通辣椒Tianyu 2(TY2)和TY2 CL(一种簇类辣椒,显示出花朵聚集和缩短的花梗,同时在植被和生殖形态上与TY2非常相似)的花梗中的BR含量(图7I和J)。与TY2相比,TY2 CL的油菜素甾酮水平较低(图7K)。相反,在TY2CL花梗中,6-脱氧栗甾酮水平(即油菜素甾酮的前体)较高(图7K),表明负责将6-脱氧栗甾酮转化为油菜素甾酮的BR合成酶可能失去了功能。
研究团队还测量了藤本植物Rosa chinensis(Rosa“ Parkdirektor Riggers”)和藤本植物 Rosa sp.(Rosa“ Angela”)的花梗中的BR含量,后者显示出花朵聚集和缩短的花梗(图7,L和M)。与TY2和TY2 CL一样,Rosa“ Angela”花梗中的油菜素甾酮水平较Rosa“ Parkdirektor Riggers”低,而6-脱氧栗甾酮水平呈相反趋势(图7N)。这些一致的发现表明,BR分布可能在调节花朵聚集生长和花序结构方面发挥着普遍作用。
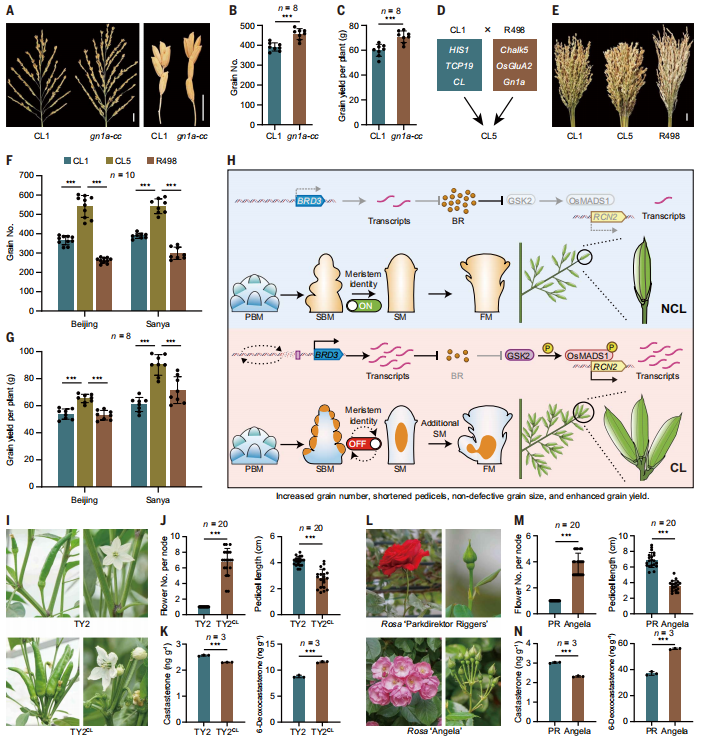
图7:利用CL进行高产育种。
研究小结
研究揭示了BR在通过精确的分生组织转变协调分蘖和谷粒数量方面的开创性作用。研究描述了一个组织特异性的BR途径(BRD3-BR-GSK2-OsMADS1-RCN2),支撑着这一先前未知的功能。BR在调节谷粒大小和数量方面的正负作用代表了一个关键的权衡机制。值得注意的是,BR途径内的这种空间定位机制增加了谷粒数量而不影响大小。因此,调控BR分布提供了有效的育种策略,用于精细调节作物性状,最终提高作物产量。研究展示了组织特异性激素操纵在克服各种性状之间的权衡和释放作物产量潜力方面的有效性。BR水平的变化可能代表着控制自然花序结构的基本机制。

公司简介
武汉爱基百客生物科技有限公司,是一家专业提供表观组学技术服务、高通量测序和单细胞时空组学的新型生物科技服务企业。公司先后引入ChIP、WGBS、ATAC-seq、全转录组、DNBSEQ-T7、10xGenomics和SeekOne®DD等实验平台,不断提升公司的科研服务能力。运营至今合作的科研客户超2000家,涵盖国内知名科研院所、高校以及生物研究相关企业,科研成果曾多次在Science、Cancer Cell、Circulation、Nature Commun、Genome Biology和Plant Cell 等国际高水平学术期刊发表,受到客户的广泛好评。
























 2925
2925

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








