
-
发表单位:中山大学深圳校区药学院(深圳)
-
发表日期:2024年5月14日
-
研究期刊:Cell Reports(IF: 8.8)
-
研究材料:伯克霍尔德氏菌
-
主要技术:ChIP-seq,EMSA,微尺度热泳分析,RNA-seq, RT-qPCR
近日,中山大学深圳校区药学院(深圳)邓音乐教授研究团队在Cell Reports上发表了题为“Regulation of Burkholderia cenocepacia virulence by the fatty acyl-CoA ligase DsfR as a response regulator of quorum sensing signal” 的研究论文,该研究以伯克霍尔德氏菌为研究材料,揭示了脂酰辅酶A合成酶DsfR作为群体感应信号的响应调节因子,调控伯克霍尔德氏菌的毒性。研究结果进一步阐明了群体感应信号传导的机制,为研发新型抗感染药物提供了新的策略。爱基百客为该研究提供了ChIP-seq技术支持。
研究背景
群体感应(Quorum Sensing, QS)是自然界中存在的一种细菌之间的通讯系统,能够感知细胞密度的变化、自诱导动态调控相关基因的表达。群体感应系统在不同微生物种类中存在形式不同,主要表现在信号分子合成酶、信号分子、信号分子识别受体和启动子的不同。其中,革兰氏阴性菌中的LuxI/LuxR系统研究最为透彻。信号分子合成酶LuxI可以合成酰基高丝氨酸内酯(AHLs)作为信号分子,AHLs顺浓度梯度自由进出细菌,当其在胞外积累一定浓度后,AHLs会再次进入细菌内部与LuxR结合形成二聚体,然后与启动子PluxI的lux box区域结合从而调控后续基因的表达。
伯克霍尔德氏菌(Burkholderia cepacia, BC)是20世纪40年代由康奈尔大学教授Burkholder最初从腐烂的洋葱鳞茎分离出的一种革兰氏阴性菌,广泛存在于水、土壤和植物中,也可附着在人的痰液和组织标本、医疗器械表面如呼吸机、导管、支气管镜等,对有机溶剂、防腐剂及低营养条件的耐受性较高,可通过接触或吸入气溶胶传播,是院感的重要机会性致病菌。群体感应也是许多病原微生物完全发挥其毒力所必需的,有研究表明伯克霍尔德氏菌可利用顺式-2-十二烯酸(Burkholderia DSF,BDSF)和N-酰基高丝氨酸内酯(AHL)两种QS系统调节其生理和毒性,其中BDSF通过激活RpfR蛋白的磷酸二酯酶活性,降低细胞内环二聚鸟苷酸(c-di-GMP)水平,从而增强RpfR-GtrR复合物的转录调控活性,其原理如图1所示。
脂肪酸是生物体的重要组成部分,其激活通常由脂肪酰辅酶A连接酶催化,通过形成酰基-腺苷酸中间体(酰基-AMP)并生成脂肪酰辅酶A硫酯。研究发现,脂肪酰辅酶A连接酶BCAM2136(DsfR)不仅能将脂肪酸转化为脂肪酰辅酶A,还作为调控因子控制伯克霍尔德氏菌的重要生物功能和毒性。BDSF能增强DsfR的调控活性,控制目的基因的表达。DsfR的同源物在伯克霍尔德氏菌中也具有类似功能,表明DsfR可能是细菌中BDSF QS信号受体家族的一员,本研究则对这一推测进行了深入研究。
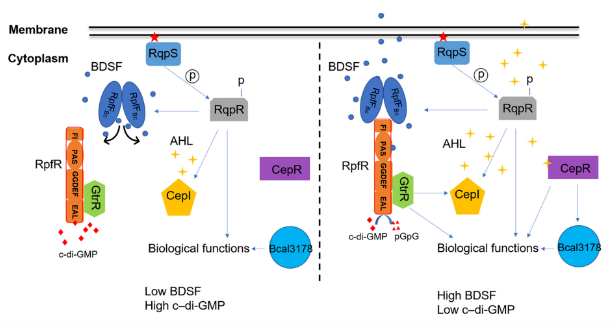
图1 伯克氏菌感应BDSF信号及其传导通路
研究思路
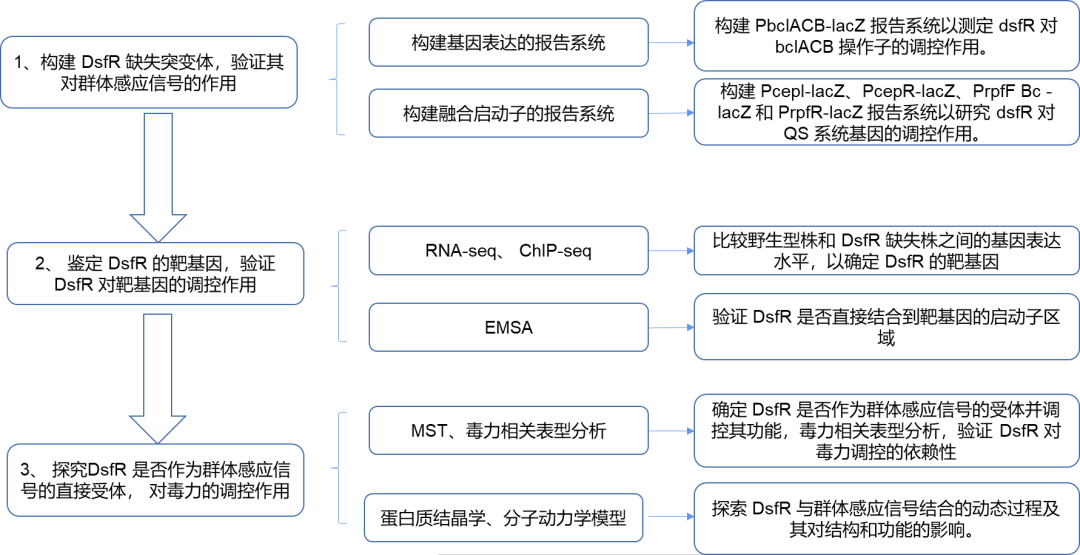
研究结果
一. DsfR控制伯克霍尔德氏菌的毒力相关表型
BclACB操纵子由BDSF和CepIR群体感应系统控制,与生物膜形成和致病性相关。在鉴定的基因中,作者发现了一个长链脂酰辅酶A连接酶(BCAM2136,命名为DsfR),然而,DsfR的功能和调控机制尚不清楚(图2A)。为了研究伯克霍尔德氏菌中DsfR的调控机制,作者将bclACB操纵子的启动子区域与报告基因lacZ(编码β-半乳糖苷酶)融合,并将其构建到一个质粒,并通过X-gal实验来检测活性β-半乳糖苷酶的存在,从而去验证启动子的活性。当dsfR插入突变体在含bclACB操纵子-lacZ融合质粒的平板上呈现浅蓝色菌落,作者假设DsfR可能控制bclACB操纵子的表达。
为了验证这一点,作者在dsfR缺失突变体中构建了PbclACB-lacZ报告系统。通过测量β-半乳糖苷酶活性发现,dsfR缺失突变体中bclACB的表达显著低于野生型菌株,表明DsfR正向调控bclACB的表达(图2B)。此外,dsfR缺失突变体的生物膜形成、运动性和毒力分别降低至野生型菌株的61.07%、36.09%和46.35%,这表明DsfR通过群体感应系统调控相关的表型(图2C-E)。
总结而言,DsfR在伯克霍尔德氏菌中通过调控bclACB操纵子的表达,影响生物膜形成、运动性和毒力,这表明了DsfR是这些致病性特征的重要调控因子。

图2 dsfR对QS调控表型的影响
二. DsfR 作为一个转录调控因子,调控着群体感应和多种基因的表达
为了研究DsfR是否会影响QS信号系统,作者在伯克霍尔德氏菌的dsfR突变株构建了PcepI-lacZ、PcepR-lacZ、PrpfFBc-lacZ和PrpfR-lacZ报告系统。结果显示,dsfR的缺失降低了cepI、cepR、rpfFBc和rpfR的表达,这些基因分别编码AHL和BDSF QS系统的信号分子合成酶(cepI和rpfFBc)和受体基因(cepR和rpfR)(图3A-3D)。RT-qPCR分析也显示,dsfR的突变导致cepI、cepR、rpfFBc和rpfR的表达水平降低(图3E)。进一步测量显示,与野生型菌株相比,dsfR突变株中C8-AHL、C6-AHL和BDSF的产生量显著降低,c-di-GMP的细胞内水平升高,而在dsfR的回补株中这些信号则恢复到了的正常的表达水平(图3F)。此外,作者通过RNA测序(RNA-seq)分析比较了野生型菌株和dsfR突变株的基因表达水平。结果显示,与野生型菌株相比,dsfR突变株中有47个基因的表达上调,96个基因的表达下调(|log2倍变化| ≥ 1.5),这些基因涉及信号转导、氨基酸代谢和致病性等生物功能。总结而言,DsfR不仅调控QS系统基因的表达,还影响多种生物学功能。
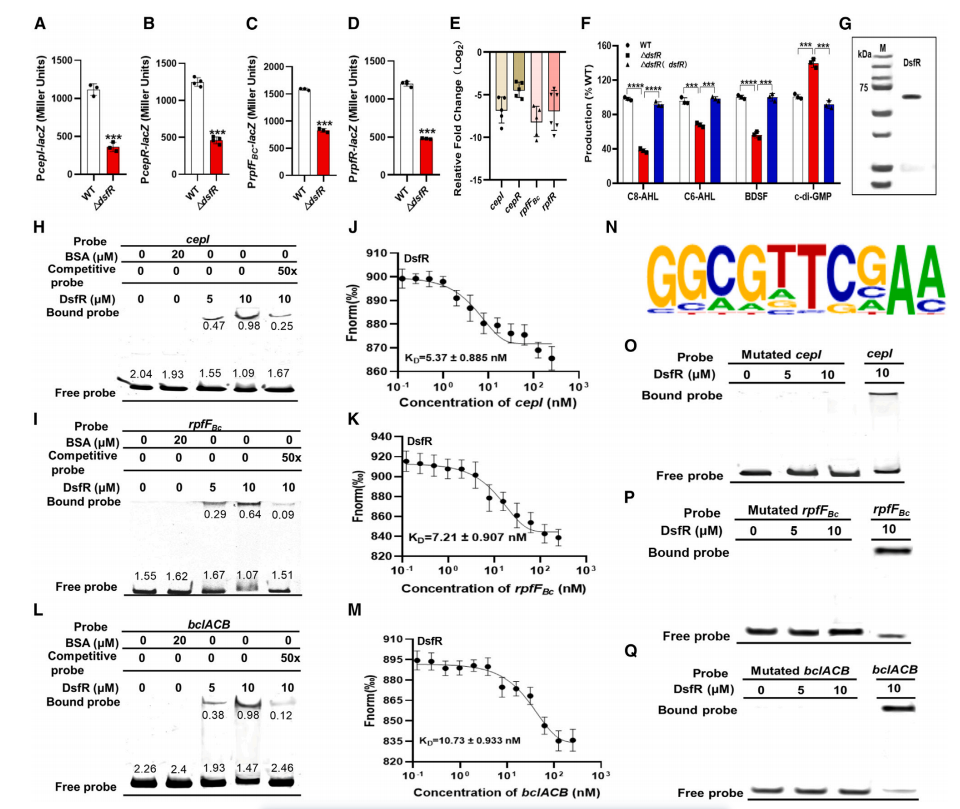
图3 DsfR对伯克霍尔德氏菌靶基因的调控分析
三. DsfR的亮氨酸拉链基序负责与启动子DNA结合
前面的研究表明DsfR显著影响伯克霍尔德氏菌中多个群体感应基因的转录水平,那具体的机制是什么呢?带着这样的疑问,作者通过EMSA和MST实验证明了DsfR直接与cepI、rpfFBc和bclACB等基因的启动子结合,并调节其表达。ChIP-seq数据进一步证明DsfR直接结合到基因启动子区域,调节对应基因的转录(图3H-3Q)。
接着,作者又通过SMART和蛋白质基序分析网站分析,DsfR具有N-AMP结合结构域(DsfR-A),包含一个亮氨酸拉链基序,以及AMP结合酶C末端结构域(DsfR-B)。利用HDOCK服务器预测DsfR与DNA结合位点的相互作用,并通过EMSA实验进一步去验证这一预测(图4A-4B)。结果表明,DsfR-A结构域能与DNA启动子片段结合,而DsfR-B不能(图4C-4I)。进一步的突变分析显示,DsfR-A结构域中的亮氨酸拉链基序对其DNA结合至关重要,突变后无法形成DNA-蛋白质复合物,证明亮氨酸拉链在DsfR调控基因表达中起关键作用(图4J-4K)。
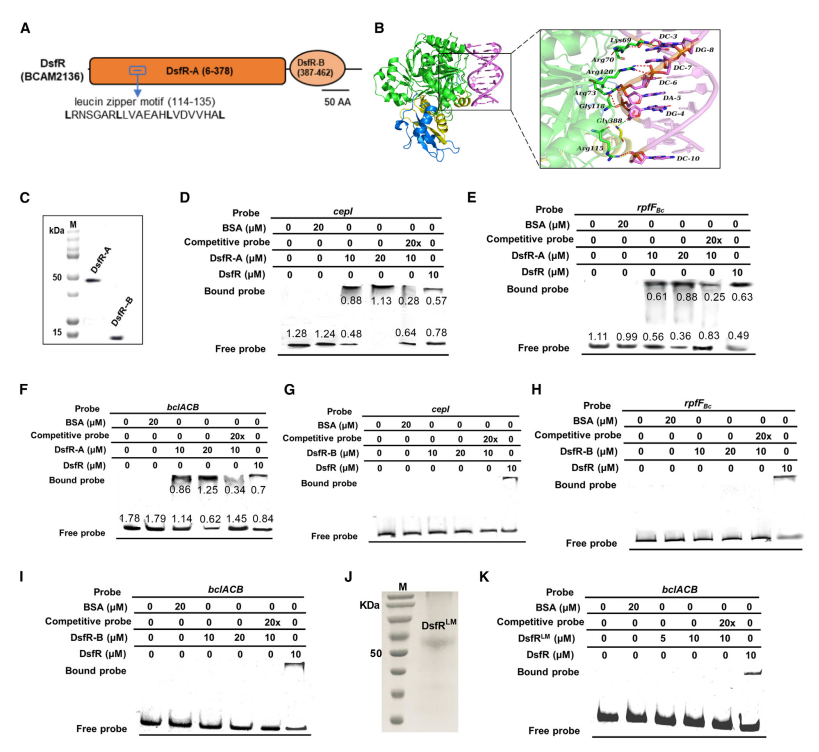
图4氨酸拉链基序对DsfR与启动子结合的影响
四. 在群体感应信号系统中, DsfR是BDSF的特异性受体
由于DsfR作为调控因子控制QS表型再结合前人的研究成果,所以作者推测了DsfR是否是与BDSF或AHL结合来控制生物学功能,还是与这两者都结合来控制生物学功能。为了验证这一假设,作者进行了微尺度热泳(MST)分析,以测试DsfR是否结合BDSF或AHL信号。结果发现DsfR与BDSF结合,解离常数(KD)为8.28 ± 0.96 µM,而不与C8-AHL或C6-AHL结合。DsfR对BDSF类似物DSF的结合较弱(KD = 26.32 ± 0.93 µM),对饱和BDSF异构体月桂酸的亲和力更低(KD = 131 ± 2.47 µM)(图5A-5C)。接着又通过构建双重和三重缺失突变体,研究发现外源性BDSF可以恢复双重突变体的生物膜形成、运动性和毒力。有趣的是,在三重突变体DrpfFBcDrpfRDdsfR中,由于不仅缺少了DsfR,还缺少了其他两个基因,因此外源BDSF无法恢复这些突变体的功能(图5D-5F)。这表明DsfR是BDSF的特异性受体,能够调控伯克霍尔德氏菌中的生物功能。
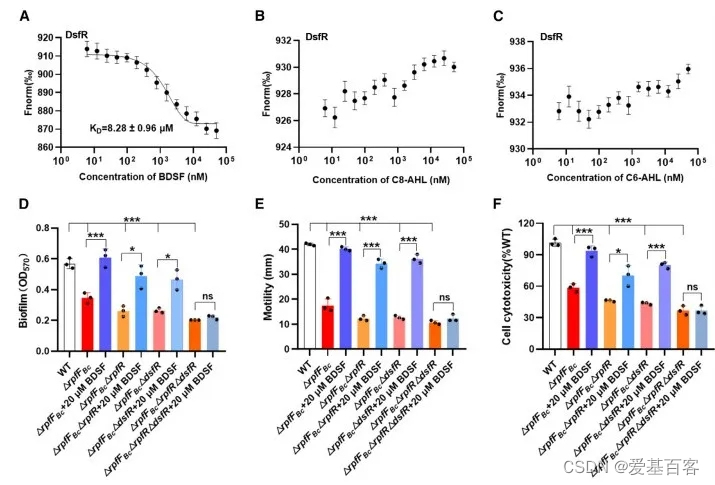
图5 DsfR是BDSF的受体
五. BDSF增强了DsfR与靶基因启动子的结合
为了研究BDSF与DsfR的结合如何影响DsfR的活性,研究人员通过电泳迁移率变动分析(EMSA)检测了BDSF对DsfR结合cepI、rpfFBc和bclACB启动子的影响。结果显示,BDSF增强了DsfR对这些启动子的结合,且随着BDSF浓度的增加,DsfR与探针的结合量也增加(图6A-6C)。而外源加入的DSF(BDSF的类似物)和饱和的BDSF异构体月桂酸并未影响DsfR与这些启动子的结合,表明DsfR是BDSF的特异性响应调节器。
接着,作者尝试鉴定出BDSF在DsfR中的直接结合位点。MST显示,BDSF与DsfR的DsfR-A域结合。Autodocking显示DsfR-A域中两个可能与BDSF相互作用的重要氨基酸残基:Thr191(T191)和Lys196(K196)。为了检测这两个残基在BDSF结合中的作用,作者生成了两个单点突变体。分析结果表明,突变体DsfRT191A无法与BDSF结合,而K196突变显著削弱了DsfR与BDSF的结合(图6I-6J)。
此外,体内表达的dsfRT191A和dsfRK196A仅部分恢复了双重突变体的生物膜形成和运动性,外源加入20 mM BDSF对这些突变体的表型没有影响(图6K-6L)。与此一致的是,突变BDSF结合位点(K196A和T191)的效果完全消除了BDSF的作用。
总结起来,BDSF特异性地与DsfR结合,且增强了DsfR对目标基因启动子的结合,DsfR的两个氨基酸残基T191和K196在与BDSF结合中起关键作用。
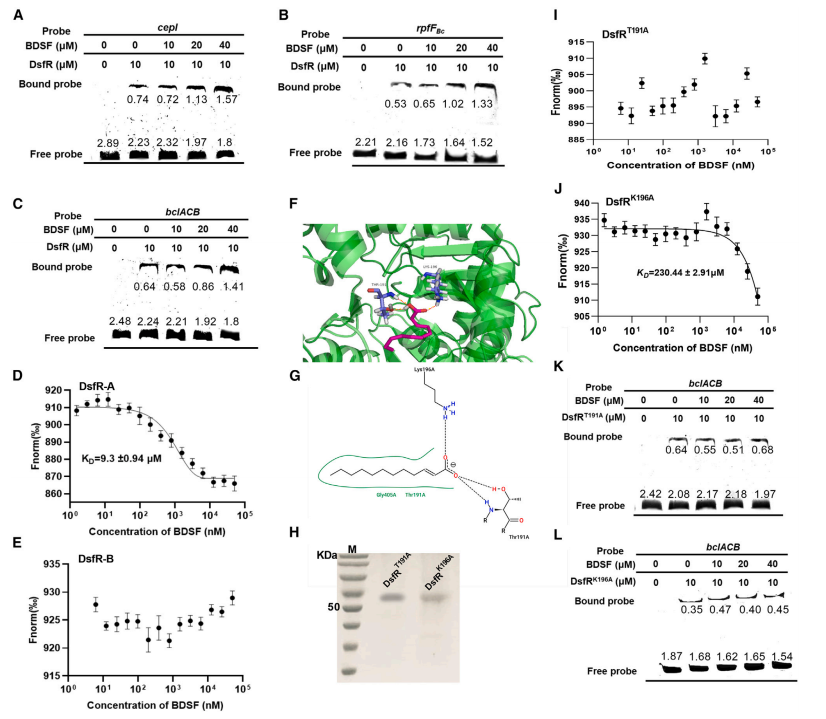
图6 BDSF对DsfR与启动子结合的影响
结 论
这篇文章研究了伯克霍尔德氏菌的毒力调控机制。通过研究脂酰辅酶A连接酶DsfR通过结合BDSF信号,其对靶基因启动子的结合,促进群体感知信号系统的活性,进而影响细菌的生物膜形成、运动性和毒力,从而调控其病原性。未来,可进一步探究DsfR在其他生理过程中的作用,并探索其作为潜在治疗靶点的可能性,以深入理解和应用细菌的毒力调控机制。
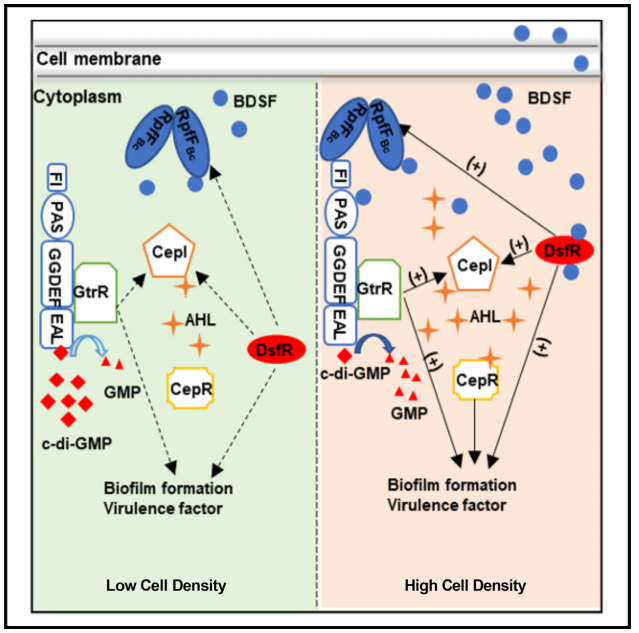
图7 DsfR在伯克霍尔德氏菌起转录调控作用
· 爱基百客王牌产品ChIP-seq简介 ·
· ChIP-seq相关介绍 ·
ChIP-seq技术将染色质免疫共沉淀和二代测序技术结合,是研究体内蛋白质与DNA相互作用的有力工具,可用于组蛋白修饰、RNA聚合酶、转录因子和辅因子以及G4链体(G4)等方面的研究,技术成熟稳定。爱基百客ChIP-seq可提供:
-
ChIP-seq测序分析
Peak分析: Peak注释和分布分析,Peak关联基因的GO、KEGG的注释和富集分析, 转录因子和Motif分析等。
多样本差异分析:差异 Peak 分布情况统计,差异 Peak 关联基因GO、KEGG 功能注释与富集,转录因子预测,Motif 预测等。
· 后续验证
01 ChIP-qPCR
分析组蛋白修饰/转录因子与染色质区域的结合情况,揭示染色质状态和基因表达调控之间的关系,真实反映结合特性。
02 EMSA
基于DNA-蛋白质复合体在聚丙烯酰胺凝胶电泳(PAGE)中的迁移率不同,检测活化的与DNA结合的蛋白转录或调节因子。
03 双荧光素酶报告实验
检测转录因子与靶启动子的特异结合。
-
ChIP-seq+转录组关联分析
ChIP-seq和转录组关联分析可以做以下2个方面的研究:
1、DNA结合蛋白和基因表达调控:通过ChIP-seq技术可以确定DNA结合蛋白(如转录因子)的结合位点,然后与转录组数据结合分析,可以获得转录因子直接调控的靶基因,为全面理解转录因子调控功能提供依据。
2、组蛋白修饰和基因表达:ChIP-seq可以用于鉴定组蛋白修饰的位点,结合转录组数据可以了解这些修饰对基因表达的影响。
· 爱基百客ChIP-seq三大优势
优势一:项目经验丰富,研究物种200+种,累计实验2000余次。全面覆盖医口和农口等不同样本,不惧特殊样本(如脂肪组织、高淀粉组织和真菌类),抗体经验也极其丰富(多种组蛋白修饰、转录因子、标签抗体以及p300和RNApol II等均有涉及);
优势二:提供前期实验设计、测序、分析以及后期验证(ChIP-qPCR、EMSA)一站式服务;
优势三:项目文章多次发表于Science、Cancer Cell、Nature Plants、Nature Metabolism以及Plant Cell等期刊。

























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








