
2024年6月7日,四川大学张舒羽教授团队在Cellular & Molecular Immunology(IF=24.1)期刊上发表了题为“Chaperone-and PTM-mediated activation of IRF1 tames radiation-induced cell death and inflammation response”的文章,通过多组学分析和功能研究,揭示了一种干扰素调节因子1(IRF1)激活依赖的炎症反应,并提出IRF1抑制剂可能作为治疗包括放射性损伤在内的免疫紊乱的有效策略。爱基百客为该研究提供了ChIP-seq技术支持。
「 研究背景 」
结构细胞(如上皮细胞、内皮细胞和成纤维细胞)在免疫调节中扮演关键角色,特别是在面对外部环境挑战时,如病原体感染、紫外线(UV)辐射、电离辐射和细胞毒素暴露。这些细胞不仅构成组织结构,还参与免疫反应和组织修复。随着单细胞多组学技术的进步和系统分析,揭示了结构细胞具有复杂的免疫相关基因活性,结构细胞表达特定的模式识别受体(如AIM2-like receptors或cGAS),识别外部病原体,但结构细胞中基因毒性应激感应蛋白与炎症反应启动蛋白之间的交叉关联仍需进一步探索。本研究揭示了结构细胞如何通过干扰素调节因子1(IRF1)的激活来响应这些应激,以及IRF1如何调控细胞命运和免疫细胞间的通讯,为治疗相关免疫疾病提供新的策略。
「 研究思路 」
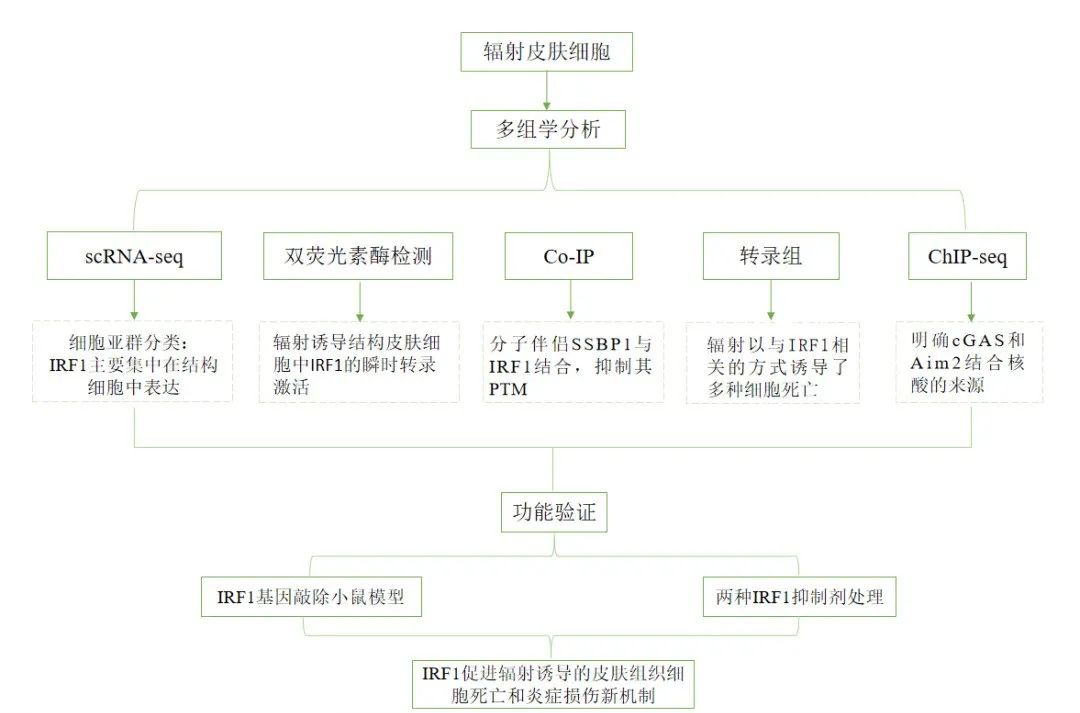
「 研究结果 」
1. 辐射后皮肤结构细胞中IRF1的表达动态变化
RNA-seq结合转录因子富集分析结果显示IRF1在电离辐射射后的大鼠皮肤组织和HaCaT细胞中特异性富集于下调的mRNA启动子中(图1.A),IRF1蛋白水平在辐射后的鼠、猴和人类皮肤样本中也显著增加(图1.B、C)。scRNA-Seq结果显示,IRF1 mRNA在照射后的大鼠皮肤组织中的表达在不同时间点发生变化,主要集中在成纤维细胞、角质形成细胞和内皮细胞,在免疫细胞中表达相对较低(图1.D-F)。
根据基因表达模式将角质形成细胞簇分为12个不同的群体,IRF1的分布主要集中在IFE和IFE-B细胞中,辐射后其比例迅速下降(图1.G-I),同样,在辐射后约250天暴露于铱-192的患者的皮肤组织的不同细胞类型中观察到IRF1的丰富表达,而在成纤维细胞群体中IRF1 mRNA的表达减少(图1.J);此外,另一项scRNA-Seq研究的结果显示,部分辐射逐渐降低了HaCaT细胞中IRF1的mRNA水平(图1.K)。这些结果表明,皮肤结构细胞,特别是IFE-B细胞中IRF1表达的动态变化可能反映了哺乳动物和人类辐射损伤的常见迹象。
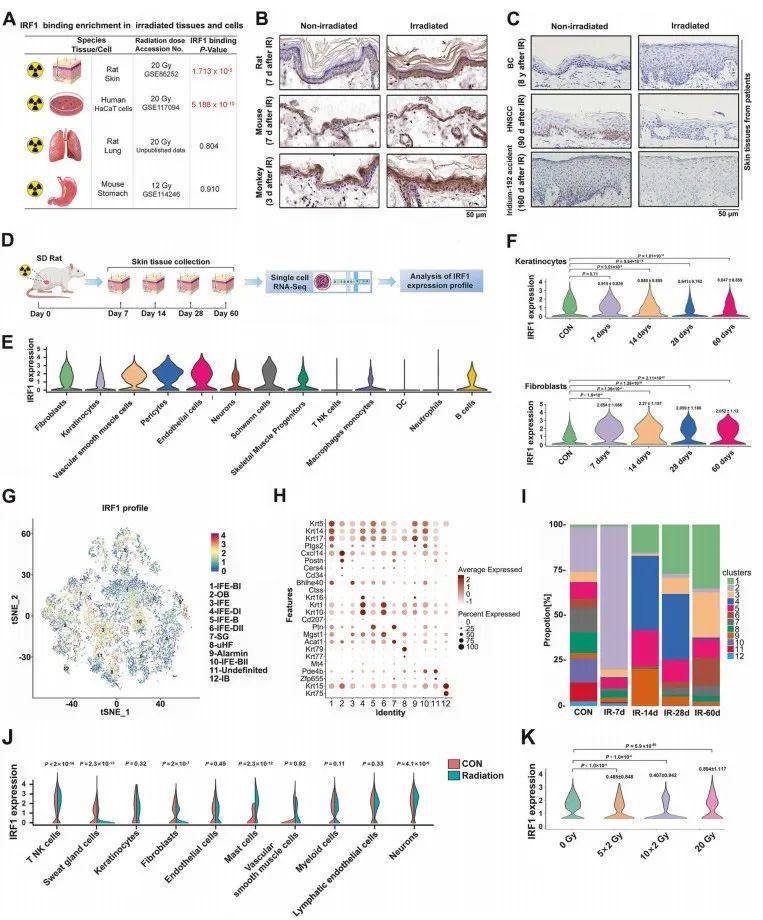
图1.辐射后皮肤结构细胞中IRF1的表达动态变化
2. SSBP1和PTMs决定了辐射诱导的核易位和IRF1的瞬时激活
为了进一步探究IRF1在辐射皮肤细胞中的转录调节作用,作者构建了IRF1荧光素酶报告基因,双荧光素酶实验结果显示,单次高剂量辐射或者多次2 Gy分割辐射均显著提高了HaCaT细胞和WS1细胞中IRF1的活性(图2.A-E),IRF1蛋白表达也在单次高剂量辐射后增加(图2.F),IRF1 mRNA水平在辐射后4小时达到峰值(图2.G)。这些发现表明,单次高剂量和部分2-Gy照射均能触发结构皮肤细胞中IRF1的瞬时转录激活。免疫荧光染色显示HaCaT细胞在照射1小时后IRF1蛋白发生核易位(图2.H),而且核裂解液中的IRF1蛋白水平显著升高(图2.I),接下来作者通过质谱分析了辐射后的HaCaT细胞中IRF1蛋白的翻译后修饰(PTM)(图2.J),在IRF1的NLS中检测到乙酰化和潜在的磷酸化位点(图2.K),免疫沉淀(IP)结果显示辐射后2小时内,IRF1的磷酸化和乙酰化显著变化,与IRF1的转录活性时间一致(图2.L),点突变分析显示,NLS中的K124和S128突变至丙氨酸阻断了IRF1在辐射后的原代皮肤细胞中的转录激活(图2.M)。这些结果表明,辐射诱导的IRF1 NLS中的PTMs决定了其转录激活。
为了研究辐射诱导的IRF1易位和激活的过程,作者通过co-IP和蛋白质组学分析来研究与IRF1的相互作用的蛋白。在照射后的HaCaT细胞中,共鉴定出355个与IRF1相互作用的独特蛋白质,其中SSBP1通过IP得到确认(图2.N、O)。高剂量辐射增加了SSBP1的蛋白水平(图2.P),SSBP1的敲低增强了IRF1的磷酸化、乙酰化和转录活性(图2.Q),促进了其核易位,并减少了IRF1的泛素化(图2.R、S),病毒感染协同诱导了IRF1和SSBP1的表达(图2.T)。这些结果首次揭示了SSBP1作为IRF1的抑制性伴侣蛋白,通过抑制IRF1的PTM和加速其降解来限制辐射诱导的反应。
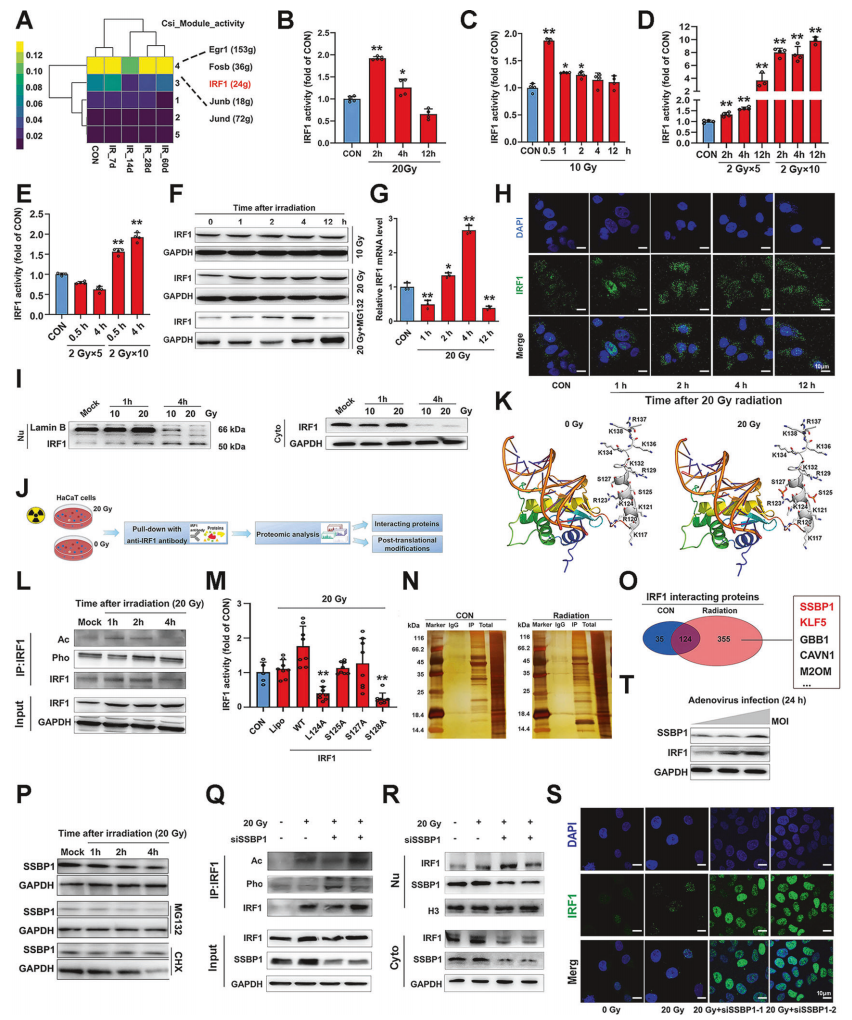
图2.SSBP1和PTMs决定了辐射诱导的核易位和IRF1的瞬时激活
3. cGAS感应胞质mtDNA启动STING和p300介导的IRF1的PTM
考虑到SSBP1在mtDNA的复制和维持中的重要作用,作者推测细胞质中的异位mtDNA损伤可能是IRF1易位的信号。通过免疫荧光分析,观察到辐射后的皮肤细胞中胞质dsDNA和 cGAS有明显的共定位信号(图3.A)。ChIP-Seq结果显示辐射后cGAS感应的mtDNA显著增加(图3.B-D)。此外,使用线粒体通透性转换孔(mPTP)抑制剂环孢素(CsA)处理细胞后,辐射诱导的胞质dsDNA染色强度和IRF1活性在2小时后显著降低(图3.E-F)。这些结果表明,mtDNA通过mPTP的释放是辐射诱导的IRF1响应的信号。
双荧光素酶报告基因分析,发现针对cGAS和STING的siRNA显著降低了IRF1的表达和辐射增强的转录活性(图3.G、M),STING激动剂2’,3’-cGAMP增加了IRF1、IFN-γ和caspase 1的mRNA水平(图3.K),STING拮抗剂H151的预处理减弱了辐射细胞中IRF1活性的增加(图3.L),Co-IP结果揭示了STING和IRF1之间的相互作用在辐射后增强,而H151处理降低了IRF1的磷酸化(图3.N、O)。这些结果表明,辐射诱导的IRF1磷酸化是通过mtDNA-cGAS/STING信号通路介导的。
之前有研究报道,p300介导IRF1的DBD(Lys39/ Lys78)的乙酰化,因此,作者继续探究了p300和IRF1在辐照反应中的潜在相互作用。Co-IP结果表明辐射显著增强了IRF1和p300之间的相互作用(图3.N),p300抑制剂L002在辐射作用下抑制了IRF1的激活(图3.P),H151和L002一起给药后抑制PTM,从而限制了IRF1的核易位(图3.Q),此外SSBP1在细胞核中直接与p300形成复合物,在细胞质中与STING形成复合物,沉默SSBP1增强了IRF1/STING和IRF1/p300之间的相互作用(图3.R)。因此,辐射诱导的IRF1激活是一个由STING和p300介导的伴侣监测和PTM调控的过程。
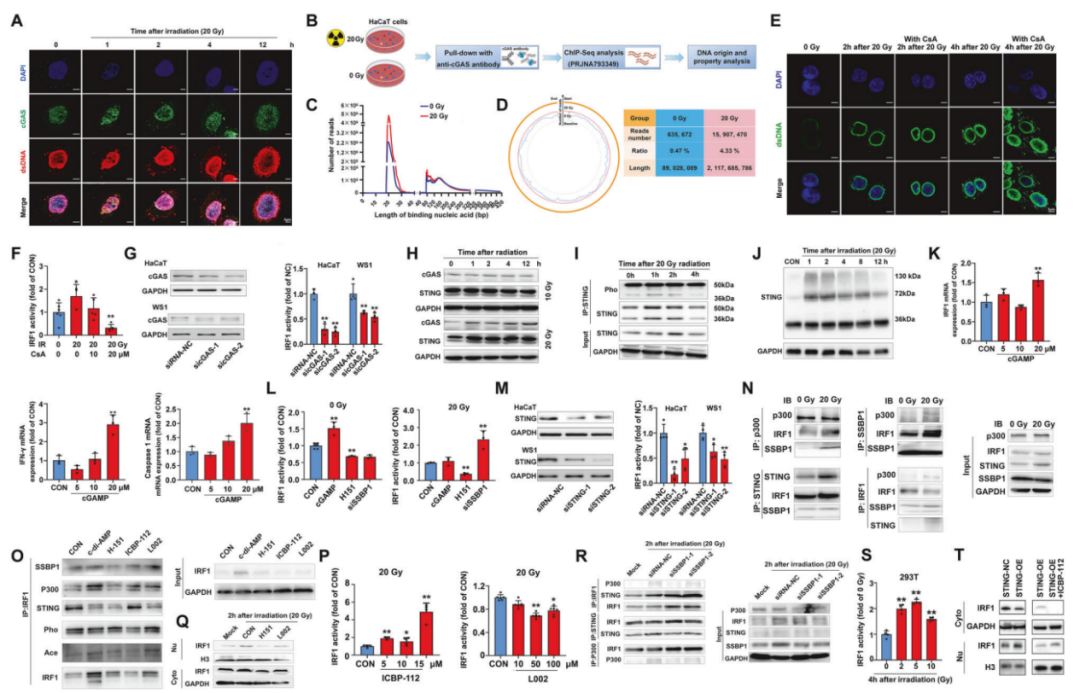
图3.cGAS感知胞质mtDNA启动STING和p300介导的IRF1的PTM
4. IRF1决定了辐射皮肤细胞的细胞命运
接下来作者建立了IRF1过表达和敲低的细胞模型(图4.B、H),以了解IRF1在决定细胞命运中的作用。一系列功能研究表明,IRF1过表达促进了非辐射皮肤细胞的细胞死亡和衰老,限制了自我更新、增殖和迁移,反之亦然(图4.C-N)。为了证实这一发现,作者对辐射后的HaCaT细胞的scRNA-Seq数据进一步分析,检测了凋亡、焦亡和坏死等不同细胞死亡类型的marker基因,t-SNE图揭示了部分或单次高剂量辐射诱导不同类型的细胞死亡(图4.O)。通过单细胞调控网络推断和聚类(SCENIC)分析,发现了超过330个IRF1的靶向基因,这些基因与细胞死亡的不同途径相关,对这些基因进行GSVA分析显示,IRF1转录调控细胞凋亡、坏死、衰老等信号通路基因表达(图4.Q)。这些结果表明,辐射以与IRF1相关的方式诱导了多种细胞死亡。
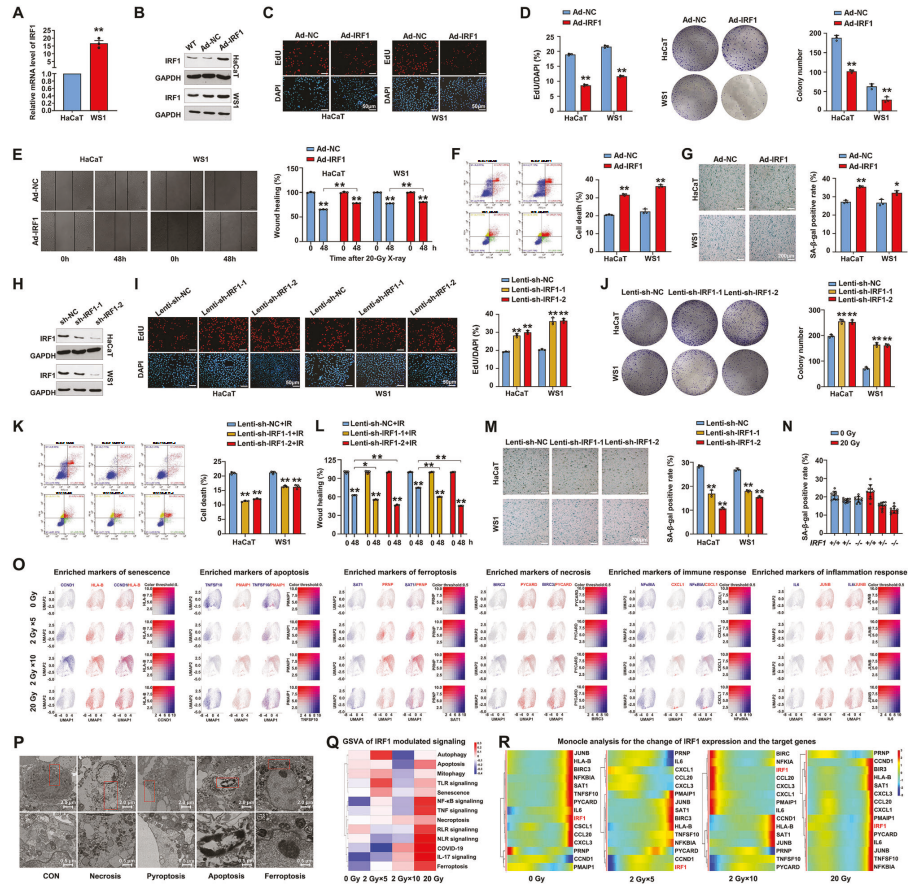
图4.IRF1在辐射的皮肤细胞中触发多种细胞死亡
5. Caspase 1的激活有助于IRF1诱导的炎症细胞死亡
为了了解IRF1调控辐射诱导细胞死亡的潜在机制,作者通过微阵列分析,比较了WT和IRF1缺陷小鼠辐射后皮肤组织的转录组,有显著的差异基因表达(图5.A)。基于DEGs,进一步进行了GO分析,揭示了IRF1在生物过程中的富集,包括DNA损伤修复、免疫和炎症反应、代谢和氧化应答、细胞死亡和衰老(图5.B),特别是在辐射后IRF1缺失的皮肤组织中,Caspase 1和Caspase 12的转录水平显著降低(图5.C),Ad-IRF1的转染提高了Caspase 1下游基因GSDMD和IL1的mRNA水平,反之亦然(图5.D、E)。此外,IRF1的敲除显著降低了辐射小鼠皮肤组织中caspase 1的水解活性以及焦亡、凋亡和坏死相关的关键蛋白表达水平(图5.G-I)。
AIM2是dsDNA的另一个传感器,已被证明可以控制Caspase 1在刺激反应中的活性,接下来作者又研究了AIM2是否参与了IRF1介导的Caspase 1激活的调控。免疫荧光和WB结果显示辐射1-12h,AIM2的蛋白表达水平升高(图5.J-L),接下来作者对AIM2进行了ChIP-seq,探究AIM2结合的dsDNA在辐射HaCaT细胞中的起源和分布,结果发现这些dsDNA大部分来源于细胞核(图5.M-P)。IRF1的敲除或沉默显著降低了辐射皮肤细胞中AIM2的mRNA和表达水平(图5.Q、R)。Caspase-1的激活需要ASC蛋白组装炎症小体复合体,免疫荧光染色显示,IRF1缺失显著降低了ASCs的强度,阻止了ASCs形成明亮的峰值,并阻断了AIM2/ ASC信号的共定位(图5.T、U)。这些结果表明Caspase 1的激活部分受到皮肤细胞中IRF1-AIM2/ASC信号通路的调控。
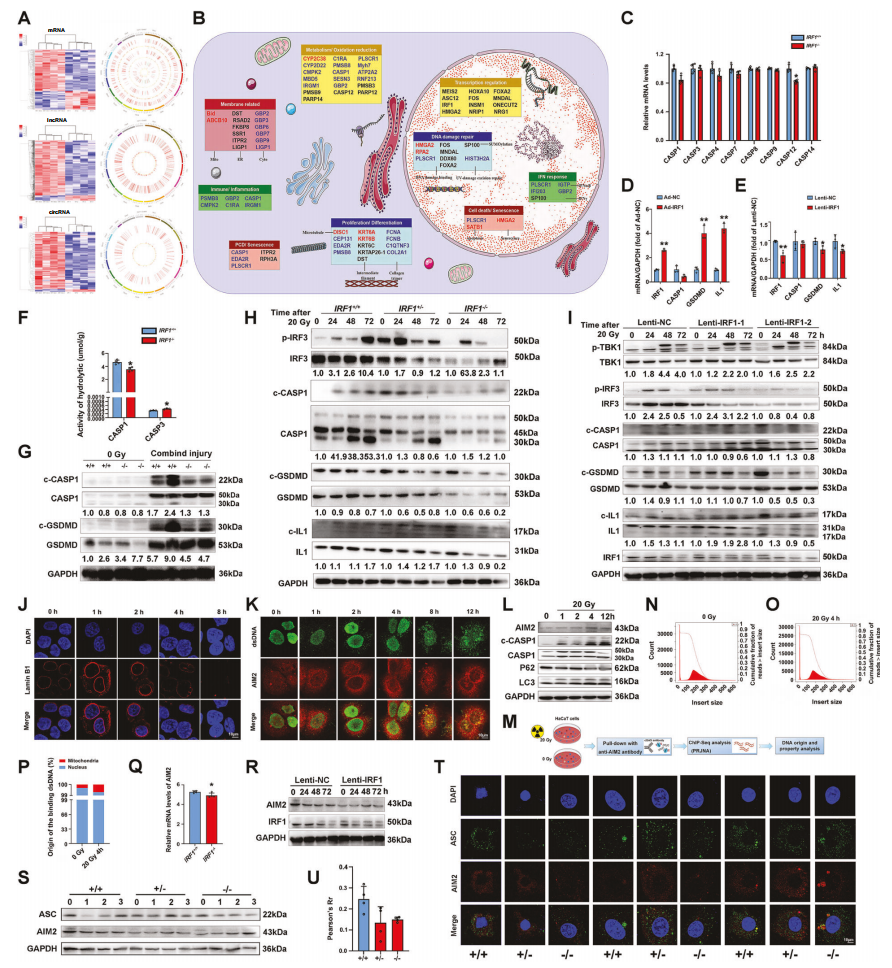
图5.Caspase 1的激活有助于IRF1诱导的炎症细胞死亡
6. IRF1影响辐射诱导的炎症性皮肤损伤
接下来作者进一步探讨了结构细胞中的IRF1表达谱是否会影响与免疫细胞的炎症连接。预测的细胞-细胞相互作用网络表明,辐射诱导结构细胞和免疫细胞之间更频繁的交叉连接(图6.A),IRF1表达谱也会影响炎症相关的调控网络(图6.B)。IRF1缺陷小鼠表现出正常发育和正常皮肤结构(图6.D),与IRF1+/+和IRF1+/-小鼠相比,IRF1−/−小鼠表现出较轻的辐射诱导的皮肤损伤及炎症浸润(图6.E、F),与辐射的WT小鼠相比,IRF1基因敲除小鼠辐射皮肤组织中IL-7和IL-21的浓度显著降低(图6.G),IRF1的敲除显著影响了淋巴细胞的增殖、分化和活化以及组织重塑(图6.H),并且对部分x射线诱导的皮肤损伤具有保护作用(图6.I-K),促进了联合损伤模型中的伤口愈合(图6.L-N)。这些结果表明,IRF1影响了辐射诱导的皮肤损伤和体内修复过程。

图6. IRF1影响辐射诱导的炎症性皮肤损伤
7. 靶向IRF1的DNA结合域(DBD)的小分子可以减轻辐射诱导的炎症损伤
最后,作者探讨了IRF1的药理抑制是否可以防止辐射诱导的皮肤损伤。通过双荧光素酶报告基因检测,鉴定了两种特异性分子对IRF1-DNA结合有抑制作用(图7.B、C),ChIP结果也显示两种抑制剂处理降低了辐射细胞中IRF1在CASP1启动子的富集(图7.D),IRF1抑制剂可以阻止低剂量辐射引起的永生化皮肤细胞的死亡(图7.F),并减轻辐射诱导的溶解性死亡和细胞焦亡(图7.G-H),DCFH-DA探针染色显示,IRF1抑制剂处理在辐射后早期维持了皮肤细胞的线粒体活性和ROS的产生(图7.J)。体内实验表明,皮下注射IRF1抑制剂,可以显著减少放射性皮肤小鼠损伤小鼠模型的急性炎症表现,并加速愈合过程(图7.M、O),与炎症反应相关的基因也发生了差异表达(图7.P),两种抑制剂都显著抑制了Caspase 1、GSDMD、IL-1和PARP1的裂解,引起细胞死亡通路的变化(图7.R、S)。这些结果表明,IRF1抑制剂对辐射诱导的炎症细胞死亡和组织损伤具有潜在的保护作用。
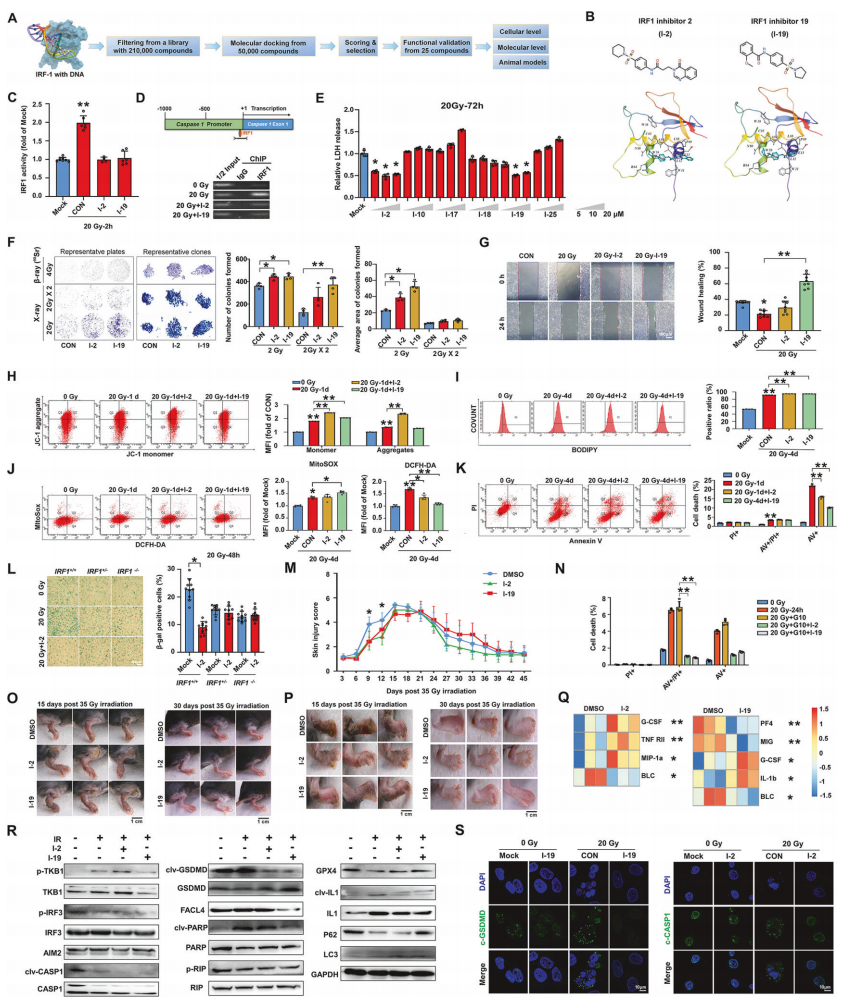
图7.靶向IRF1的DNA结合域(DBD)的小分子可以减轻辐射诱导的炎症损伤
「 研究结论 」
该研究主要探讨了IRF1(干扰素调节因子1)在结构细胞中对基因毒性应激的响应机制,以及如何通过抑制IRF1来减轻辐射引起的炎症和细胞死亡。研究发现,IRF1在结构细胞中的表达高于免疫细胞,且其激活是由线粒体DNA(mtDNA)通过cGAS/STING信号通路触发的。此外,SSBP1作为IRF1的伴侣蛋白,抑制IRF1的修饰和核转运,从而影响辐射响应。文章还首次识别了两种小分子抑制剂,它们通过靶向IRF1的DNA结合域(DBD)有效减轻了辐射诱导的炎症和细胞死亡。这些发现揭示了IRF1在辐射诱导的炎症中的关键作用,并提出了通过抑制IRF1来治疗免疫紊乱,包括辐射损伤和感染性疾病的新策略。
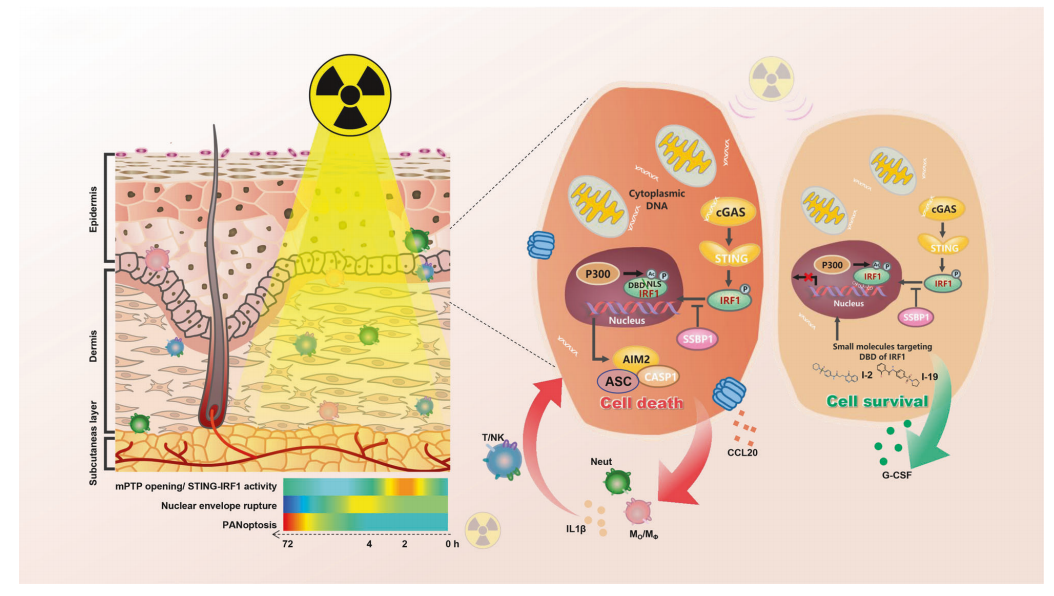
-
原文链接:https://www.nature.com/articles/s41423-024-01185-3
























 3590
3590

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








