Acyltransferases in plants: a good time to be BAHD
植物中的酰基转移酶:正是BAHD大展身手的好时机

摘要
酰化是植物次生代谢物中一种常见且具有生化意义的修饰。植物中的BAHD酰基转移酶构成了一个庞大的家族,这些酶利用酰基辅酶A(acyl CoA)来生成包括小型挥发性酯、修饰的花青素、以及固有的防御化合物和植物抗毒素在内的产物。BAHD酶的催化多样性使得仅凭其一级序列难以进行功能预测。然而,随着基因组测序的最新进展以及第一个BAHD家族成员的晶体结构的获得,逐渐为这些酰基转移酶在植物王国中的进化和功能提供了见解。
引言
植物王国中存在大量的次生代谢物,但只有少数主要的代谢途径通向萜类、酚类、脂肪酸衍生物以及含氮次生代谢物的生物合成。这些化合物的多样性是通过修饰基本骨架来实现的,修饰酶催化的反应包括脱羧、氧化/还原、羟基化、糖基化、甲基化和酰化反应。 其中,氧和氮含量的底物分别通过酰化生成酯和酰胺,这是次生代谢物中最常见的修饰类型之一。这些反应中的活化酰基供体来自如酰基糖、酰基化的酰基载体蛋白或酰基活化的辅酶A硫酯类。催化这些酰化反应的酶通常属于大型蛋白质家族。 生化研究以及正在进行的基因组和表达序列标签(EST)测序项目的结果,最近发现了一个名为BAHD的大型酰基转移酶家族,该家族利用CoA硫酯,催化一类多样化的植物代谢产物的形成。到本综述完成时,已有46种不同的BAHD酰基转移酶基于遗传和/或生化实验被赋予了功能(见表1),尽管在公共基因组和表达谱数据库中还有更多该家族的序列。本综述总结了已知的BAHD酶的基本特性、共享基序和催化机制,并描述了该组内的系统发育关系,重点介绍了最近描述的成员。
BAHD超家族的发现与描述
BAHD酰基转移酶家族是根据该家族中最早被生化表征的四种酶的首字母(BEAT, AHCT, HCBT, 和 DAT)命名的。这些酶包括两种乙酰基转移酶,加利福尼亚野花Clarkia breweri中的苯甲醇O-乙酰基转移酶(BEAT),其负责生成花卉挥发物苯甲酸乙酯,和来自长春花Catharanthus roseus的脱乙酰长春花碱4-O-乙酰基转移酶(DAT),这是生物碱长春花碱合成的最后一个酶。其他两种酶是苯甲酰/羟基肉桂酰CoA酰基转移酶。Yang等人从康乃馨Dianthus caryophyllus中鉴定出蒽酸N-羟基肉桂酰/苯甲酰转移酶(HCBT),该酶生成一类称为蒽酰胺的植物抗毒素。此外,研究如三色堇Gentiana triflora等物种中酰基化花青素的研究小组鉴定出催化花青素O-羟基肉桂酰转移酶(AHCT)活性的相关酶。HCBT是第一个能够将酰基转移至N原子以形成相应酰胺的BAHD成员。
事实上,最早已知编码BAHD家族成员的基因在描述玉米Zea mays的光泽2突变体和拟南芥Arabidopsis thaliana的eceriferum2(cer2)突变体时被报告,这些突变体不能将其叶片上的表皮蜡由C28延长到C30。然而,Glossy2和CER2基因编码的酶尚未进行生化表征,因而这些酶在形成表皮蜡中的确切作用仍未明确。
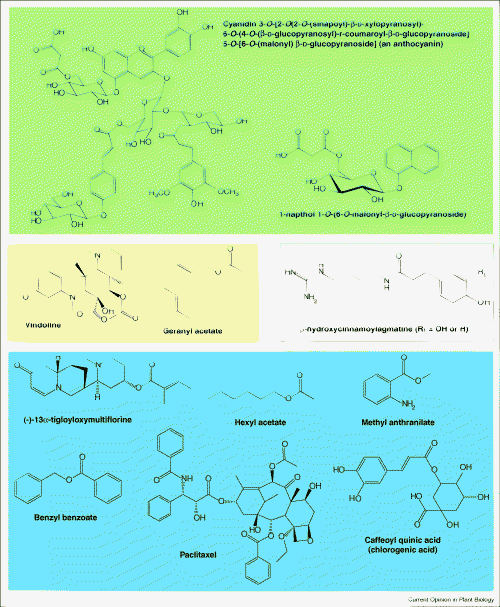
图1. 由BAHD家族成员酰化的次生代谢物的例子。化合物根据相应BAHD家族成员的进化分支关系进行分类(图3)。
到目前为止,已鉴定出的BAHD成员都是单体酶,分子量在48到55 kD之间。一个BAHD蛋白的平均氨基酸数量约为445。目前认为该家族的所有成员都定位于细胞质中,因为没有发现任何信号肽或其他会导致定位于细胞器或分泌的序列。BAHD家族成员之间的最低序列相似性约为25-34%,但一些在不同物种中催化同类反应的功能等效成员(如催化挥发性化合物苯甲酸苄酯形成的酶)之间的序列相似性可高达90%。
BAHD家族成员的保守基序与催化机制
无论它们的总体相似性如何,BAHD家族的酶共享几个保守的结构域。第一个是位于每个酶中心附近的HXXXDG基序,与几类利用辅酶A硫酯的酰基转移酶家族共享。这些家族包括I型、II型和III型氯霉素乙酰基转移酶(CAT)以及胆碱/肉碱O-酰基转移酶。研究表明,这一基序对于CAT酶通过一般碱催化的乙酰基转移机制非常重要。第二个高度保守的区域是位于羧基末端附近的DFGWG基序,几乎所有功能已被表征的BAHD酶都含有这两个基序。多个研究组通过定点突变实验独立证明,删除或修改这两个基序中的一个或两个会导致酶活性显著降低。此外,最近一项针对甜瓜(Cucumis melo)果实中涉及挥发性酯类生物合成的BAHD成员的研究表明,蛋白质的另一区域可能也对催化起重要作用。将CmAAT2酶的268号丙氨酸替换为苏氨酸可以恢复该天然无功能酶的活性。
Ma等人通过获得BAHD家族成员的首个晶体结构,在理解催化机制及共享基序的重要性方面取得了突破性进展。来自印度蛇木(Rauvolfia serpentina)的乙酰基转移酶vinorine合酶在该物种及其相关种中发现的ajmalan型单萜吲哚生物碱的生成中发挥着关键作用。Vinorine合酶是一个球状蛋白,由两个几乎等大的结构域通过一个环连接而成。整体上,该酶由14个β链和13个α螺旋组成。其活性位点位于贯穿两个结构域之间的溶剂通道中,催化性组氨酸残基从通道两侧都可获得。有趣的是,BAHD家族中所有成员共享的DFGWG基序位于酶的活性位点之外,似乎并未参与推测的催化机制。简而言之,HXXXD基序中的组氨酸残基去质子化相应受体底物上的氧或氮原子,使其能够对CoA硫酯的羰基碳进行亲核攻击,进而形成CoA硫酯和受体底物之间的四面体中间体。随后,该中间体再质子化,生成游离的CoA和酰化的酯或酰胺。如今晶体结构的可获得性使得可以对未知功能的BAHD成员进行建模研究,以帮助预测其催化功能。

图2. Vinorine合酶晶体结构。图中展示了第一个被解析的BAHD酰基转移酶结构的带状图。乙酰辅酶A位于结构的中心附近,并用黑色标记。α-螺旋以橙色表示,β-链以青色表示。BAHD家族中两个已识别的保守区域,HXXXD基序(中心)和DFGWG基序(右上方)已被标记。此图经[14••]授权转载。
系统发育分析揭示了BAHD酶的几个独特类群
最近的几项研究通过蛋白质比对和随后的系统发育分析,揭示了BAHD家族中功能的进化,并预测了尚未在生化上被表征的酶的潜在底物。对表1中所有BAHD家族成员的分析得出了一张进化树,显示出五个主要分支(图3),这一结果与Stewart等人先前报告的结果类似。这五个分支可以根据所使用的底物类型或基因及其编码酶的活跃条件进行分类。
Table 1. Genetically or biochemically characterized BAHD acyltransferases.
| Acyltransferase name | NCBI Genbank protein ID number | Major acyl CoA donor | Major product(s) formed | Species | Reference(s) |
|---|---|---|---|---|---|
| Clade Ia | |||||
| Gt5AT | BAA74428 | Hydroxy-cinnamoyl | Anthocyanins | G. triflora | [8] |
| Dv3MAT | AAO12206 | Malonyl | Anthocyanins | D. variabilis | [25] |
| Sc3MaT | AAO38058 | Malonyl | Anthocyanins | Pericallis cruenta | [54] |
| Dm3MAT2 | AAQ63616 | Malonyl | Anthocyanins | Chrysanthemum x morifolium | [35] |
| Dm3MAT1 | AAQ63615 | Malonyl | Anthocyanins | Chrysanthemum x morifolium | [55] |
| NtMAT1 | BAD93691 | Malonyl | Flavonoid and napthol glucosides | Nicotiana tabacum | [23] |
| Vh3MAT1 | AAS77402 | Malonyl | Quercetin 3-O-6″-O-malonylglucoside | Verbena x hybrida | [56] |
| Lp3MAT1 | AAS77404 | Malonyl | Quercetin 3-O-6″-O-malonylglucoside | Lamium purpureum | [56] |
| Pf3AT | BAA93475 | Hydroxy-cinnamoyl | Anthocyanins | Perilla frutescens | [57] |
| Ss5MaT1 | AAL50566 | Malonyl | Anthocyanins | Salvia splendens | [58] |
| Pf5MaT | AAL50565 | Malonyl | Anthocyanins | P. frutescens | [58] |
| Clade II | |||||
| CER2 | AAM64817 | Unknown | C30 epicuticular waxes | A. thaliana | [11, 12] |
| Glossy2 | CAA61258 | Unknown | C32 epicuticular waxes | Z. mays | [13] |
| Clade III | |||||
| SalAT | AAK73661 | Acetyl | Thebaine | Papaver somniferum | [29] |
| Pun1 | AAV66311 | Unknown | Capsaicin pathway | Capsicum annum | [20] |
| DAT | AAC99311 | Acetyl | Vindoline | C. roseus | [6] |
| MAT | AAO13736 | Minovincinine | C. roseus | [30] | |
| Vinorine synthase | CAD89104 | Acetyl | Vinorine | R. serpentine | [17] |
| Ss5MaT2 | AAR26385 | Malonyl | Anthocyanins | S. splendens | [26] |
| CbBEAT | AAC18062 | Acetyl | Benzyl acetate | C. breweri | [5] |
| CmAAT4 | AAW51126 | Medium-chain aliphatic | Medium-chain and hydroxycinnamoyl acyl esters | C. melo | [19] |
| RhAAT1 | AAW31948 | Acetyl | Geranyl acetate and other volatile esters | Rosa hybrid cultivar | [31] |
| SAAT | AAG13130 | Acetyl | Medium-chain aliphatic and benzyl esters | Fragaria x ananassa | [32] |
| VAAT | CAC09062 | Acetyl | Small- to medium-chain aliphatic esters | Fragaria vesca | [21] |
| Clade IV | |||||
| ACT | AAO73071 | Hydroxy-cinnamoyl | Hydroxy-cinnamoyl agamatine derivatives | Hordeum vulgare | [34] |
| Clade V | |||||
| CHAT | AAN09797 | Acetyl | (Z)-3-hexen-1-yl acetate | A. thaliana | [35] |
| HMT/HLT | BAD89275 | Tigloyl | Quinolizidine alkaloids | Lupinus albus | [37•] |
| MpAAT1 | AAU14879 | Short- to medium-chain aliphatic | Short- to medium-chain aliphatic volatile esters | Malus x domestica | [59] |
| AMAT | AAW22989 | Anthraniloyl | Methyl anthranilate | Vitis labrusca | [36•] |
| CbBEBT | AAN09796 | Benzoyl | Benzyl benzoate | C. breweri | [35] |
| CmAAT3 | AAW51125 | Medium-chain aliphatic | Medium-chain and hydroxycinnamoyl acyl esters | C. melo | [19] |
| NtBEBT | AAN09798 | Benzoyl | Benzyl benzoate | N. tabacum | [35] |
| BPBT | AAU06226 | Benzoyl | Benzyl benzoate/ phenethyl benzoate | Petunia x hybrida | [15••] |
| CmAAT(1–2) | CAA94432 | Medium-chain aliphatic | Medium-chain and hydroxycinnamoyl acyl esters | C. melo | [19] |
| AAL77060 | |||||
| BanAAT | CAC09063 | Acetyl | Cinnamyl acetate and other medium-chain aliphatic acetate esters | Musa sapientum | [21] |
| DBNTBT | AAM75818 | Benzoyl | 2’-deoxytaxol | Taxus canadensis | [38] |
| BAPT | AAL92459 | β-phenylalanoyl | N-debenzoyl-2’-deoxytaxol | Taxus cuspidata | [39] |
| DBAT | AAF27621 | Acetyl | Baccatin III | T. cuspidata | [40] |
| DBBT | Q9FPW3 | Benzoyl | 7,13-diacetylbaccatin III | T. cuspidata | [41] |
| TAT | AAF34254 | Acetyl | Taxa-4(20),11(12)-dien-5a-yl acetate | T. cuspidata | [42] |
| HCBT | CAB06430 | Hydroxy-cinnamoyl/benzoyl | Dianthramides | D. caryophyllus | [7] |
| HQT | CAE46932 | Hydroxy-cinnamoyl | Chlorogenic acid | N. tabacum | [46•] |
| AsHHT1 | BAC78633 | Hydroxy-cinnamoyl | Avenanthramides | A. sativa | [60] |
| NtHCT | CAD47830 | Hydroxy-cinnamoyl | Chlorogenic acid and derivatives | N. tabacum | [47] |
| AtHCT | NP_199704 | Hydroxy-cinnamoyl | Chlorogenic acid and derivatives | A. thaliana | [48] |
缩写: ACT,亚精胺香豆酰转移酶;AMAT,蒽酰酰基辅酶A:甲醇酰基转移酶;AtHCT,拟南芥羟基肉桂酰基辅酶A:莽草酸/奎宁酸羟基肉桂酰转移酶;AsHHT1,燕麦羟基肉桂酰基辅酶A:羟基蒽酸N-羟基肉桂酰转移酶;BanAAT,香蕉醇酰基转移酶;BAPT,紫杉III O-苯基丙酰转移酶;BPBT,苯甲酰辅酶A:苯甲醇/苯乙醇苯甲酰转移酶;CbBEAT,加州野花苯甲醇O-乙酰基转移酶;CbBEBT,加州野花苯甲酰辅酶A:苯甲醇O-苯甲酰转移酶;CHAT,(Z)-3-己烯-1-醇O-乙酰转移酶;CmAAT1-4,甜瓜醇酰基转移酶;DAT,脱乙酰长春花碱4-O-乙酰基转移酶;DBAT,10-脱乙酰紫杉III-10-O-乙酰转移酶;DBBT,2-脱苯甲酰-7,13-二乙酰紫杉III O-苯甲酰转移酶;DBNTBT,3′-N-脱苯甲酰-2′-脱氧紫杉醇N-苯甲酰转移酶;Dm3MAT1/Dm3MAT2,菊花花青素3-O-葡萄糖苷-6″-O-马来酰转移酶;Dv3MAT,变种菊马来酰辅酶A:花青素3-O-葡萄糖苷-6″-O-马来酰转移酶;Gt5AT,三色堇花青素5-芳香酰基转移酶;HCBT,蒽酸N-羟基肉桂酰/苯甲酰转移酶;HMT/HLT,虎杖酸辅酶A:13α-羟基多花黄芪/13α-羟基鲁潘O-虎杖酸转移酶;HAT,羟基肉桂酰基辅酶A奎宁酸:羟基肉桂酰转移酶;Lp3MAT1,紫盖香堇马来酰辅酶A:黄酮醇3-O-葡萄糖苷-6″-O-马来酰转移酶;MAT,长春花碱-19-羟基-O-乙酰转移酶;MpAAT1,苹果醇酰基转移酶;NtBEBT,烟草苯甲酰辅酶A:苯甲醇O-苯甲酰转移酶;NtHCT,烟草羟基肉桂酰基辅酶A:莽草酸/奎宁酸羟基肉桂酰转移酶;NtMAT1,烟草马来酰辅酶A黄酮类/萘酚葡萄糖苷酰基转移酶;Pf3AT,紫苏羟基肉桂酰基辅酶A:花青素3-O-葡萄糖苷-6″-O-酰基转移酶;SalAT,7-O-乙酰转移酶;RhAAT1,杂种玫瑰醇乙酰转移酶;SAAT,草莓醇酰基转移酶;Sc3MaT,参宿马来酰辅酶A:花青素3-O-葡萄糖苷6″-O-马来酰转移酶;Ss5MaT1/Ss5MaT2,穗花马来酰辅酶A:花青素5-O-葡萄糖苷-6″′-O-马来酰转移酶;TAT,紫杉-4(20),11(12)-二烯-5α-醇-O-乙酰转移酶;VAAT,野草莓醇酰基转移酶;Vh3MAT1,杂种堇菜马来酰辅酶A:黄酮醇3-O-葡萄糖苷-6″-O-马来酰转移酶。

图3. 植物BAHD酰基转移酶家族的最新系统发育树。(登录号见表1。)该分析仅包括那些通过遗传突变筛选或生化检测功能性表征的成员。蛋白质序列通过Clustal-X比对,生成的比对结果随后通过PAUP* v 4.0 beta 10软件进行邻接和自举分析。
进化分支I完全由参与酚类糖苷修饰的BAHD家族成员组成,主要是花青素,尽管最近加入该分支的成员NtMAT1参与烟草中马来酰化萘酚和黄酮糖苷的生成。迄今为止,已表征的大多数花青素BAHD酰基转移酶的进化和底物特异性已被审阅。研究表明,通过酰化对花青素3-O和5-O糖的修饰,在添加羟基肉桂酰时可增强颜色,而添加马来酰基则可增加稳定性。该分支中的许多酶除了BAHD酰基转移酶的两个已知保守基序外,还共享一个共同的基序(酪氨酸-苯丙氨酸-甘氨酸-天冬酰胺-半胱氨酸),因此该基序已成功用于基于同源性的花青素马来酰转移酶Dv3MaT的克隆。然而,并非所有参与花青素修饰的BAHD酰基转移酶都位于分支I中;马来酰转移酶Ss5MaT2被归入分支III。尽管生化性质表明它参与了花青素的修饰,但它缺乏分支I成员的特征性基序,可能是BAHD家族底物特异性进化的一个例子。
分支II的两个已知成员是来自玉米的Glossy2和来自拟南芥的CER2。这些酶参与延长长链表皮蜡,这对于控制地上组织的水分流失和形成有助于抵御病原体的保护性边界至关重要。尽管其酶促功能没有生化数据,但使用针对合成肽的抗体进行的亚细胞定位研究表明CER2可能定位于细胞核。然而,Glossy2和CER2并不包含已知的核定位信号。最近的一项研究测量了CER2在蜡生物合成过程中基因表达水平,研究表明CER2可能在表皮蜡生物合成中发挥调节作用而非生物合成作用。
分支III中的大多数BAHD成员接受多种醇类底物,尽管大多数酶利用乙酰辅酶A作为主要酰基供体。该分支中的一个亚群包括参与生物碱化合物修饰的BAHD乙酰基转移酶,如长春花碱和吗啡前体蒂巴因。最近关于辣椒中辣椒素生成的研究揭示,Pun1基因编码的BAHD酰基转移酶导致了辣和温和品种之间的差异。尽管Pun1酶尚未进行生化表征,但推测其可能是辣椒素合酶,通过将支链酸8-甲基-6-壬烯酰辅酶A与香草胺酰化。分支III中的另一个主要亚群包括参与花和成熟果实中挥发性酯类生物合成的乙酰基转移酶,例如来自杂种玫瑰的RhAAT1,该酶生成香叶醇的乙酰酯。这些酶均能接受多种醇类底物,生成各种挥发性酯类,但植物中实际存在的化合物可能取决于内源性底物的可用性。
酰基转移酶ACT是第三个被证明能够酰化氮原子形成相应酰胺的BAHD酰基转移酶。ACT包含所有BAHD家族成员共有的HXXXD基序,并且还具有稍微改变的DFGWG基序,其中甘氨酸被色氨酸替代。Burhenne等人还报告了来自大麦的与ACT类似的序列,但尚未进行生化表征。
分支V中的BAHD成员可进一步分为几个亚群。其中一个亚群主要由参与挥发性酯类生物合成的酶组成。几种能够形成苯甲酸苄酯的BAHD酶聚集在该亚群中。Boatright等人通过饲料实验结合计算机辅助代谢通量分析,证明了源自β-氧化途径的苯甲类化合物必须通过苯甲酸苄酯形成,这表明苯甲酰辅酶A:苯甲醇/苯乙醇苯甲酰转移酶在矮牵牛花中的重要作用。该组中一个新成员是新近鉴定的蒽酸酰基辅酶A:甲醇酰基转移酶AMAT,负责康科德葡萄中甲基蒽酸酯的‘狐狸’气味。AMAT是第一个被证明以甲醇为主要底物并利用蒽酸酰基辅酶A作为酰基供体的BAHD酰基转移酶。
分支V的第二个亚群由来自紫杉属植物的BAHD酶组成,这些酶参与紫杉醇的生成。这些蛋白质是裸子植物中唯一被表征的BAHD成员。参与紫杉醇生物合成途径中所有基因的聚集表明这些酶来自共同的谱系。最近在苏格兰松树中鉴定出的参与黄酮酰化的酰基转移酶可能会进一步揭示裸子植物中BAHD成员的范围。
分支V的最后一个亚群由使用羟基肉桂酰基/苯甲酰辅酶A作为酰基供体的酶组成。这些酶包括HCT和HQT,它们在烟草属植物和拟南芥中负责形成羟基肉桂酰奎宁酸/莽草酸酯。这些酶在木质素生物合成途径中起着关键作用,形成所需的ρ-香豆酰莽草酸/奎宁酸酯中间体。缺乏这种酶的活性会导致显著的表型变化,如植物矮小和木质素组成的变化,尤其是愈创木酚单元的减少。
单个物种中的BAHD家族
拟南芥和水稻基因组测序项目的完成揭示了这两个基因组中包含大量BAHD基因。拟南芥中的BAHD成员约有64个,包括假基因。然而,到目前为止,只有两个编码的蛋白质被赋予了生化功能。第一个是前述的HCT酶,它在木质素生物合成中起关键作用;第二个是(Z)-3-己烯-1-醇O-乙酰转移酶(CHAT),它合成绿色叶片挥发性酯(Z)-3-己烯-1-乙酸酯。另一种由At5g23940(EMB3009)基因编码的BAHD酰基转移酶最近被证明对胚胎发育至关重要,表明其在发育中的关键作用。对拟南芥中花青素生物合成的最新研究发现,主要花青素是一种具有三种酰基(马来酰基、ρ-香豆酰基和丁香酰基)修饰糖基的矢车菊素衍生物。通过微阵列技术研究参与花青素代谢途径的基因表达,Tohge等人鉴定出两个上调的BAHD家族成员At1g03940和At3g29590,它们与已知的花青素酰基转移酶具有高度的序列同源性。类似的综合研究将会越来越普遍,并应能加快找到和优先表征BAHD候选酶的速度。
水稻基因组的完成揭示了至少有119个BAHD成员。几项研究报告称水稻中的BAHD成员与已被生化表征的酶高度相似。例如,Burhenne等人在研究大麦中的ACT时报告了‘OsHCBT’和‘OsACT’的存在。然而,这些酶尚未进行生化表征;尽管它们与大麦中的同源酶高度相似,但仅根据序列同源性来预测BAHD成员的底物特异性仍然具有挑战性。例如,Beekwilder等人指出,在对成熟水果中挥发性酯类的酰基转移酶进行生化检测之前,无法通过序列相似性预测其底物偏好。因此,结合代谢物分析、表达数据以及序列同源性/晶体结构建模的综合方法,可能有助于预测许多仅存在于基因组或表达谱实验中的BAHD酰基转移酶的底物需求。然而,最终的证据仍需要通过生化实验来证明其活性。
结论
酰基转移在许多植物代谢物的修饰中起着关键作用,影响它们的极性、挥发性、化学稳定性和生物活性。过去对BAHD酰基转移酶的研究表明,该家族能够酰化各种底物。然而,单个酶的催化多样性差异很大。一些BAHD成员在底物的使用上具有较为有限的范围,而另一些在体外表现出广泛的底物特异性,这样它们在植物中形成的产物有时由底物的相对可获得性决定。因此,如果一些编码具有广泛底物特异性的BAHD成员的基因能够引入其他植物,可能会形成新的酰基化代谢物。此外,特定BAHD酰基转移酶的上调可能会增加被认为对人类健康有益的化合物的含量。例如,咖啡酸奎宁酸酯(图1)是一种重要的抗氧化剂,通过上调BAHD酶HQT的表达,可以在番茄果实中生成更多这种化合物。尽管甲基蒽酸酯的“狐狸”香气是康科德葡萄的特征性主要成分,但在葡萄酒行业中却是不受欢迎的挥发物。Wang和De Luca发现的AMAT使得葡萄酒生产者可以通过分子育种计划来减少或消除AMAT活性。对催化位点的日益深入了解以及BAHD家族成员的持续功能表征将为这些酶的机制和进化提供更多信息。此外,具有改变的BAHD活性的植物的可获得性将有助于进行实验,以测试其产物的生理和生态作用。




























 2982
2982

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








