文献来源:Highly selective fluorescent probe based on AIE for identifying cysteine/homocysteine - PubMed (nih.gov)
一、AIE机理在荧光探针设计方向的应用:
参考文献:几种代表性的AIE的发光特点和机制(2020-10-11) - 知乎 (zhihu.com)
1.AIE发光的机理:
1.1基于Π-Π重叠相互作用实现荧光增强:
通过限制单键旋转,从而抑制了无辐射衰减,加强了辐射衰减,产生聚集诱导发光。唐本忠院士通过增加溶剂的黏度和降低溶剂的温度并且限制单键旋转实现荧光增强。四苯乙烯衍生物(TPE)的单个分子发光强度较弱,通过限制单键旋转促使能量升高(S1),便于聚集从而出现“聚集诱导发光现象”。

1.2聚集诱导发光现象(AIE)相较于 聚集荧光淬灭(ACQ)机理的差异:
在低粘度的稀溶剂中,由于TPE中的苯环可以自由的转动或者振动,激发态(S1)的能量通过结构松弛而稳定,而基态(S0)的能量明显升高,两态之间的能量间隙减少,这使得激发态分子通过辐射衰减到基态(从而产生荧光淬灭)。而在固体或者晶体态中,由于相邻分子的空间位阻(离得比较近),激发态的能量在激发过后会急剧上升,分子内的运动由于较大的能量势垒从而阻断了非辐射衰减,加强了辐射衰减,形成聚集诱导发光现象。

2.AIE现象和卡莎规则的区别:
根据卡莎规则,发光体的辐射衰减只能来源于最低激发态(S1, T1)。然而1,根据理论计算和实验结果证明(Aprahamian),存在双发射磷光的有机光电材料(AIEgen)。T1和T2间具有较低的能级差,室温下两个激发态具有不同的电子组态,T1是以Π-Π*为主的慢磷光辐射过程,而T2是以n-Π*为主的快荧光过程。

3.传统AIE发光材料和新AIE材料的改进方式:
传统的发光材料以Π共轭体系为发光团,近年来一些具有富电子原子(电负性大),如N,O,S,P。或者基团(羰基,亚胺,羧基)能起到AIE效应。
二、背景介绍:
1.生理学条件:
在生命系统中半胱氨酸(Cys)和同型半胱氨酸(Hcy)参与维持体内稳态,但是Cys/Hcy在体内的含量远低于谷胱甘肽(GSH)。
2.特异性发光机制:
作者设计的探针SQM-NBD本身没有荧光,而在GSH的干扰下(GSH也可以发生Micheal加成),探针的荧光信号可以被Cys/Hcy打开释放分子SQM-OH和Cys/Hcy-NBD,释放的SQM-OH可以继续被Cys/Hcy通过Micheal加成淬灭,实现对细胞内的Cys/Hcy的特异性定位(LOD分别为54nM和72nM)。
3.PET效应(光致电子转移效应)以及探针分子设计中的应用:
光的诱导下,电子进行分子内或者分子间转移的现象。典型的光诱导电子转移体系由包含电子给体的供体部分(Receptor)间隔基团(Spacer,比如亚甲基)和荧光团F(Fluorophore)三个部分组成。电子从供体转移到激发态荧光团,一旦供体和荧光团断裂,PET效应收到抑制或者阻断,荧光团会辐射衰减发射荧光。
在SQM-NBD探针设计中,我们首先将荧光团SQM-OH和电子供体NBD-Cl结合起来,从而不发生PET电子效应。再通过生物硫醇(GSH,Cys,Hcy)对电子供体发生反应抑制PET电子转移效应释放荧光团SQM-OH,释放的荧光团先发射红光然后再被生物硫醇淬灭。而电子供体通过分子内电子转移机理发射绿光,实现对Hcy/Cys的定位。

三、数据解读:
1. 紫外图像数据解读:
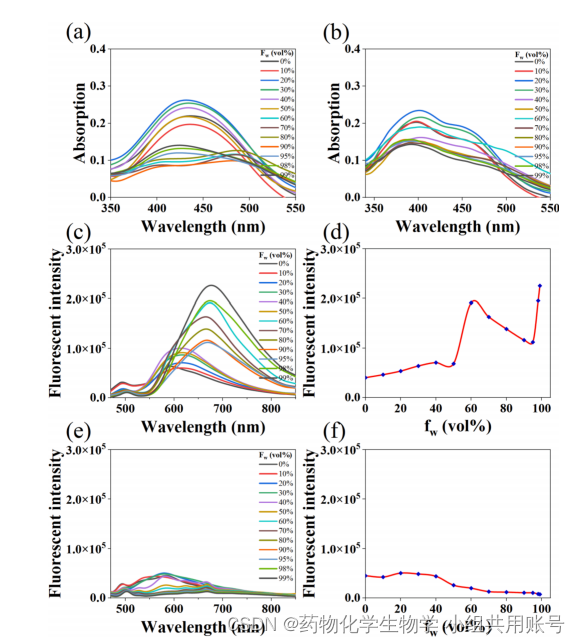
1.1图像(a),(b)数据解读:
通过设计一系列浓度梯度的PBS-DMSO溶液和水混合比例()实现对SQM-OH和SQM-NBD的聚集体探究,图像(a)和图像(b)分别为在不同溶剂比例下的紫外吸收。可以观察到,在
=60%时,SQM-OH的紫外吸收强度开始下降,可能是因为随着水组分的增加,SQM-OH会形成聚集体,产生的散射效应导致紫外吸收强度的降低(AIE)。
1.2图像(c),(d),(e),(f)数据解读:
根据上述图像(a),(b)可以发现SQM-OH和SQM-NBD的最大吸收波长为430nm和400nm,作者采用430nm和400nm对不同含水量的探针SQM-OH和SQM-NBD进行激发。
1.2.1图像(c),(d)数据解读:
发现当溶液中不含水组分时(= 0), SQM-OH的荧光信号峰仅存在于600 nm处。此外,在Fw = 0 ~ 50%范围内,SQM-OH的荧光变化不大。而当Fw = 60%时,SQM-OH的荧光信号由430 nm红移至670 nm。同时,荧光信号在670 nm处急剧增加,在Fw = 99%时达到最大值。
说明探针SQM-OH在670nm出辐射衰退最强,具有最强的AIE效应。
1.2.2图像(e),(f)数据解读:
发现SDM-NBD随着水组分()增加,辐射衰减逐渐减弱,而非辐射衰减逐渐增强。随着水组分增多,SDM-NBD的ACQ效应逐渐增强。
2.体外三种不同氨基酸的响应紫外解读:
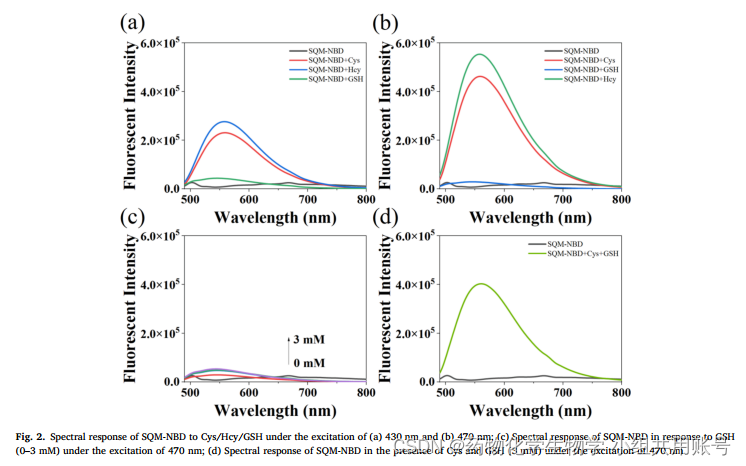
2.1 图像(a),(b)的紫外图像数据解读:
图像(a),(b)分别是在430nm和470nm激发未被孵育,使用Cys/GSH/Hcy孵育的SQM-NBD,可以发现无论使用430nm或者470nm激发,都对GSH具有较低的响应。 通过430nm和470nm波长激发SQM-NBD比较,发现在470nm激发下紫外强度更强。
2.2 图像(c),(d)的紫外图像数据解读:
图像(c),(d)分别是不同浓度GSH孵育下探针SQM-NBD用470nm激发的吸收强度变化和GSH+Cys孵育下用470nm激发的吸收强度变化。图像(c)中随着GSH浓度增加,SQM-NBD的荧光信号仍未开启,说明SQM-NBD可以选择性地识别Cys/Hcy。图像(d)中在Cys (650 μM)和GSH (3 mM)孵育下测量紫外吸收,验证SQM-NBD的抗干扰能力,和图像(c)比较得探针SQM-NBD对Cys具有较强的吸收。
3.荧光强度线性测试:
图像(a),(c)分别是用Cys/Hcy测定探针(5μM )的荧光滴定,氨基酸浓度从0μM逐渐增加到650μM。图像(b),(d)分别是不同氨基酸浓度的最强紫外吸收的浓度线性图,可以发现接近于1,线性良好。
说明探针对Cys和Hcy的检测限(LOD)分别为54nm和74nm。说明SQM-NBD对Cys和Hcy具有较高灵敏度。

4.荧光响应时间测试(图像在支持文件中):
作者进行了SQM-NBD与Hcy/ Cys的响应时间实验,以确定560 nm处30 min的荧光强度变化趋势。探针SQM-NBD对Cys和Hcy的反应速度快,且反应时间相同,在20min时可以达到最大吸收。
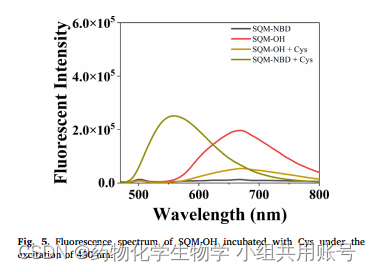
5.反应机理探究:
在实验中始终未探测到SQM-OH的荧光信号。作者为了解释这一现象,在430 nm激发下测量了含有Cys的SQM-OH的荧光光谱。结果表明,加入Cys后,SQM-OH的荧光强度降低。
作者再通过核磁,HRMS,LC-MS方法测试了加入Cys后的SQM-OH,验证说明SQM-OH和Cys发生Micheal加成造成部分荧光发生淬灭。
然后,作者测定SQM-OH与半胱氨酸或精氨酸在H2O和PBS中的荧光光谱(在支持文件中),SQM-OH在PBS中的荧光强度明显低于在H2O中的荧光强度,说明荧光团SQM-OH通过Cys猝灭可能是Michael加成和富离子环境共同作用的结果。
6.荧光成像分析:
作者使用探针SQM-NBD (5 μM)对对HeLa细胞进行共聚焦荧光成像。在图(a),(b),(c)对HeLa细胞进行共聚焦荧光成像,可以发现具有较低的荧光强度。在图(d),(e),(f)对使用Cys预孵育的HeLa细胞进行成像,可以看到显著的荧光强度。在图(g),(h),(i)对NEM处理的HeLa细胞成像,将SQM-NBD加入HeLa细胞后,荧光消失。说明SQM-NBD能够同时检测外源和内源的Cys/Hcy。

























 725
725











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








