肠道菌群及其代谢产物与肥胖相关疾病(如2型糖尿病)密切相关,但其因果关系和潜在机制尚不清楚。研究表明,肥胖与肠道微生物的丰度和多样性变化有关,例如,高脂饮食(HFD)诱导的肥胖会增加某些细菌的百分比,导致肠道炎症。此外,肠道菌群转移实验表明,肠道菌群失衡对肥胖发展至关重要。然而,肠道菌群衍生的代谢产物如何影响宿主的代谢综合征(如胰岛素抵抗)仍不清楚。

2024年07月04日,同济大学生命科学与技术学院邓寒松教授团队在The EMBO Journal(IF:9.4)发表了题为Gut microbiota metabolite tyramine ameliorates high-fat diet-induced insulin resistance via increased Ca2+ signaling的研究论文,该研究以果蝇和小鼠为模型,探讨了肠道菌群代谢产物酪胺(Tyramine, TA)如何通过增加细胞质Ca2+信号来抑制高脂饮食引起的胰岛素抵抗。爱基百客为本研究提供了16s rDNA测序技术支持。

研究结果
1. HFD通过Gαq/PLCβ/IP3R级联激活肠细胞内的cytoCa2+来减少脂质积累
肠细胞(ECs)是肠道中主要的细胞类型,负责营养物质的消化和吸收。研究者测试了cytoCa2+(细胞质Ca2+)是否参与了ECs中的饮食脂质代谢。在双光子显微镜下利用相对荧光比率量化ECs(肠细胞)中的cytoCa2+ (Fig. 1A),与对照组Ctrl相比,SercaRi果蝇ECs中的cytoCa2+水平分别显著增加, IP3RRi果蝇ECs中的cytoCa2+水平显著的减少(Figs.1B,C)。通过ORO染色检测了肠道中的中性脂质水平,通过TAG(三酰甘油)定量全身的脂质水平,SercaRi果蝇肠道和全身的脂质水平降低,IP3RRi果蝇肠道和全身的脂质水平则升高(Figs.1D-F),这些结果表明,肠道Ca2+能够调节肠道和全身的脂质代谢。在 ND(正常饮食)或HFD(高脂饮食)喂养4天后,肠道中中性脂质水平的定量检测发现,仅4天的HFD就足以增加肠道脂质水平(Figs.1G),ECs中的SercaRi可以抑制这一效应(Fig. 1H)。与ND相比,HFD喂养的果蝇其ECs中的cytoCa2+水平显著升高(Figs.1I)。进一步的实验表明,敲除IP3R受体或Gαq能显著抑制HFD引起的cytoCa2+水平升高(Figs.1J,K)。这些结果表明,肠细胞中的cytoCa2+通过Gαq/PLCβ/IP3R级联反应调节肠道和全身脂质代谢,并且HFD激活了肠细胞中的cytoCa2+信号以减少脂质积累。
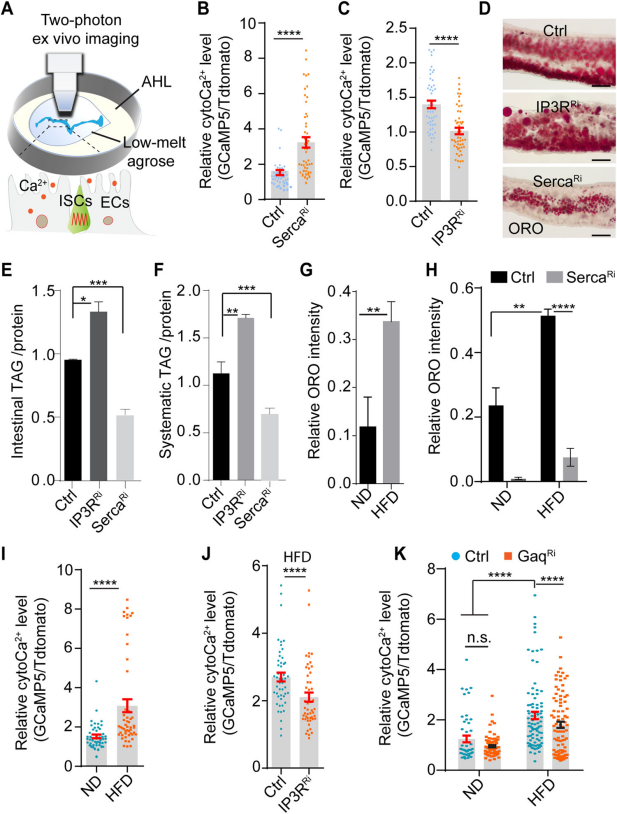
Fig1. HFD通过Gαq/PLCβ/IP3R级联激活肠细胞内的cytoCa2+来减少脂质积累
2. HFD诱导的酪胺激活肠细胞cytoCa2+信号
研究者试图确定HFD诱导的ECs内cytoCa2+水平增加的来源。用椰子油衍生的自由脂肪酸混合物(FFAs mix)喂养果蝇4h后,ECs内的cytoCa2+水平基本不变(Fig.2A)。然而,当果蝇被喂食来自HFD果蝇的肠道裂解液后,ECs内的cytoCa2+水平升高(Fig.2B,C)。这些结果表明,肠道裂解液中的代谢物可能在HFD激活的ECs内cytoCa2+水平升高过程中起作用。
对喂食HFD或ND 4天的果蝇的肠道裂解物进行了广泛靶向代谢组学分析。通过OPLS-DA的火山图显示了HFD与ND条件下肠道裂解液的1461种代谢物的变化,其中175种代谢物表现出显著差异,特别是酪胺(TA)水平在HFD条件下显著上调 (Fig.2D)。进一步实验表明,喂食含TA饲料的果蝇在一天内表现出肠细胞内cytoCa2+浓度的剂量依赖性增加(Fig.2E),且TA暴露能迅速并持续地增加新鲜分离肠道的细胞内cytoCa2+水平(Fig.2F)。这些结果表明,HFD条件下肠道微生物群产生的酪胺(TA)是激活肠细胞Ca2+信号的源头。
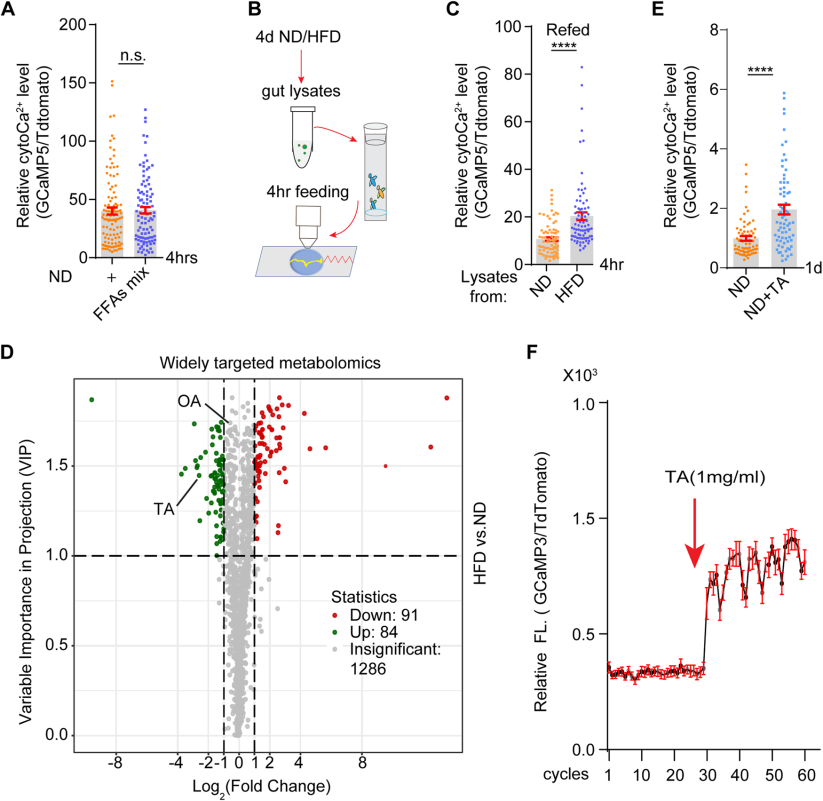
Fig2. HFD喂养的果蝇肠道中酪胺的增加激活了肠道中cytoCa2+信号
3. 由HFD增加的革兰氏阳性菌负责TA的产生
通过平板计数法(CFU)测定了HFD喂养4天或15天后果蝇肠道裂解物中的细菌数量,显示HFD显著增加了肠道细菌负荷 (Fig.3A)。用抗生素混合物处理(HFD+组)显著降低了HFD喂养果蝇肠道裂解物中的cytoCa2+水平(Fig.3B),并且抗生素处理进一步增加了HFD条件下肠道中的中性脂质水平(Fig.3C)。这表明肠道微生物群参与了HFD介导的cytoCa2+调控。
通过16S扩增子测序分析比较了ND和HFD喂养的果蝇的肠道细菌组成,HFD显著增加了革兰氏阳性细菌,特别是乳杆菌属(Lactobacillus)的丰度(Fig.3D)。喂养野生型(未敲除Tdc基因)的L. Brevis(短乳杆菌)或E. Faecalis(粪肠球菌)足以增加肠细胞中的cytoCa2+,而喂养敲除Tdc基因的L. Plantarum(植物乳杆菌)则未能增加(Fig.3E,F)。薄层色谱(TLC)分析显示,L. Brevis和E. Faecalis培养基中的TA水平显著增加,而L.Plantarum(植物乳杆菌)则没有(Fig.3G)。使用TA合成的抑制剂烟酸(NA)可以降低TA水平,并且能够显著减少HFD或L. Brevis引起的肠细胞内cytoCa2+浓度的升高(Fig.3H)。这些结果表明,HFD条件下革兰氏阳性细菌的增加是TA产生的来源,并且这些细菌产生的TA通过激活肠细胞中的Ca2+信号来发挥作用。
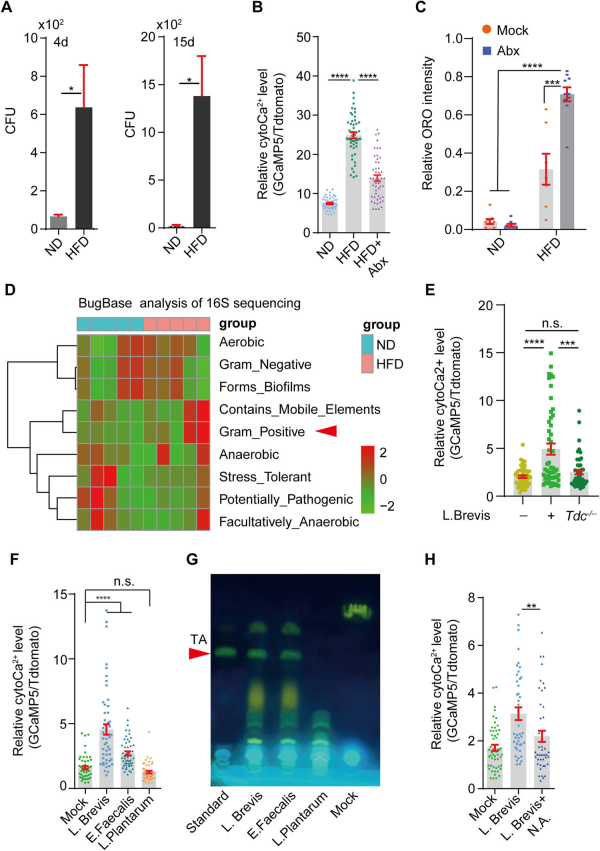
Fig3. 由HFD增加的革兰氏阳性菌负责酪胺的产生
4. 由革兰氏阳性菌产生的酪胺通过酪胺受体TyrR1激活肠内Ca2+信号通路
通过敲减Gαq或TyrR1,可以抑制酪胺(TA)或高脂饮食(HFD)介导的ECs内cytoCa2+升高(Fig.4A,B),进一步证实了敲低TyrR1足以阻断TA诱导的cytoCa2+水平的增加(Fig.4C)。CREB是一种保守的转录因子,受cytoCa2+调控,参与控制多种生物学过程。通过免疫染色和荧光素酶报告基因分析显示HFD喂养后肠细胞中CREB活性增加(Fig.4D,E),这一过程涉及钙-钙调蛋白激酶的磷酸化作用。敲降CaMKII或Gαq可以阻断这种激活(Fig.4F,G),表明HFD通过TA/TyrR1/Gαq介导的钙离子级联反应激活CREB。通过p-CREB的免疫染色显示了TA喂养、Serca敲低或L. Brevis喂养增加了肠细胞中的CREB活性(Fig.4H-J),Gαq的敲低抑制了HFD诱导的CREB激活(Fig.4K)。通过ORO染色显示CREB突变体(CREBΔ36)在ND和HFD条件下都积累了更多的肠细胞内脂质,而过表达CRTC足以抑制HFD或GαqRNAi诱导的脂质积累(Fig.4L-N)。这些结果表明,通过TyrR1受体激活的cytoCa2+信号级联反应在调节肠细胞的脂质代谢中起着核心作用。
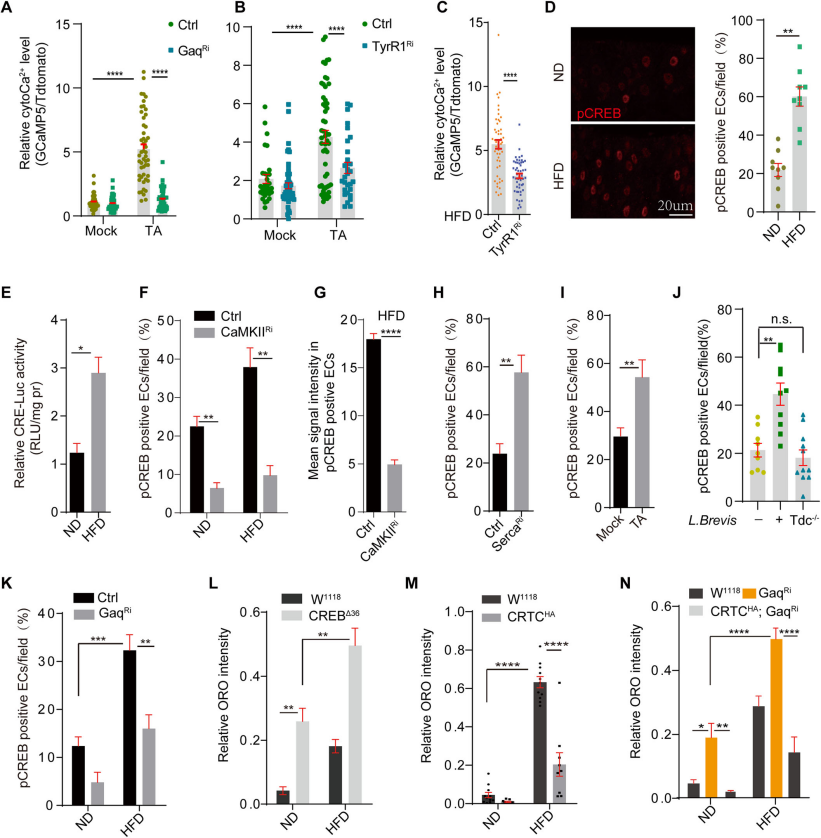
Fig4.革兰氏阳性菌产生的酪胺通过酪胺受体tyrR1激活肠道Ca2+信号
5. Ca2+/CRTC/CREB级联抑制了Magro的表达,从而抑制了膳食脂质消化
通过RNA-seq测序分析找到CRTCOE和IP3ROE在肠道中共同调控的基因(Fig.5A),RT- PCR验证了肠道中magro基因表达的确实显著降低(Fig.5B,C)。生物信息学分析发现magro启动子区域含有两个保守的CRE基序,并通过ChIP-qPCR分析证实CREB可以直接结合magro基因的启动子(Fig.5D)。抑制magro基因表达后肠道脂质的减少(Fig.5E),通过粪便样本的脂质水平和肠道腔中的脂肪酶活性测定,进一步证实了CRTC过表达抑制了饮食脂质的消化(Fig.5F,G),添加胰蛋白酶可以部分恢复CRTC过表达诱导的肠道中性脂质的减少(Fig.5H)。这些结果表明,Ca2+/CRTC/CREB信号通路通过抑制饮食脂质消化的关键酶Magro的表达来调节肠道脂质水平。
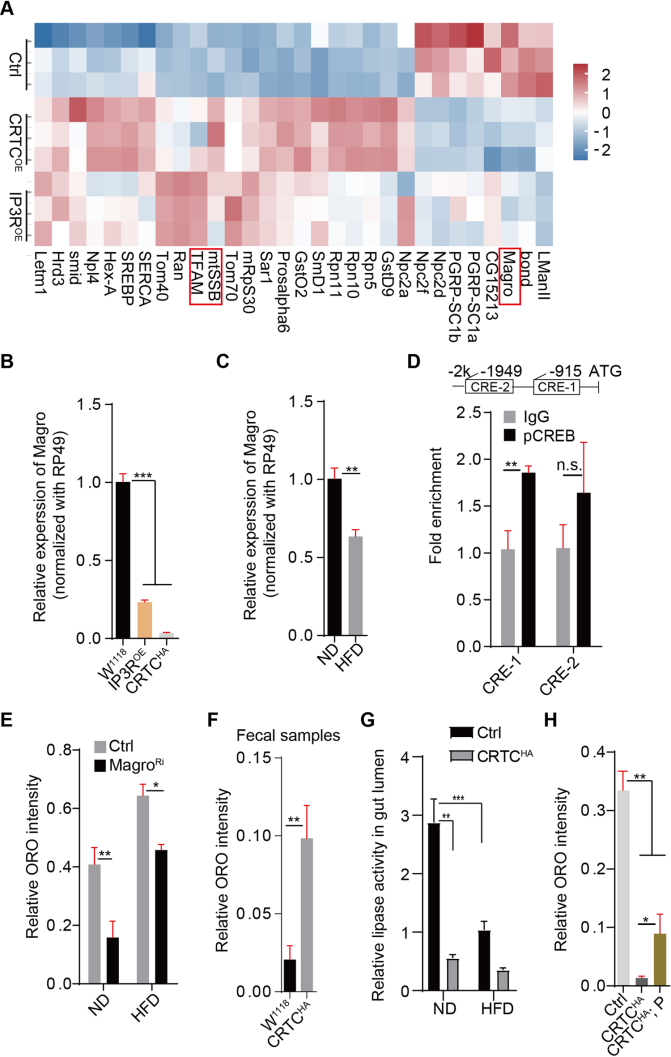
Fig5. Ca2+/CRTC/CREB级联抑制了magro的表达,从而抑制了膳食脂质消化
6. Ca2+/CRTC/CREB级联促进线粒体生物发生并抑制肠细胞脂肪生成
通过qRT-PCR分析了肠道中基因表达的变化,显示了CRTC过表达能显著下调DGATs基因(CG1942和CG1946,参与脂肪生成的关键基因) (Fig.6A)。通过qPCR和WB分析证实了CRTC过表达增加了ctDNA(线粒体DNA)拷贝数和线粒体质量(Fig.6B,C)。通过BODIPY-C12荧光标记的脂肪酸追踪实验,观察了在CRTC过表达或TA喂养条件下,脂肪酸在肠细胞和腹部脂肪细胞中的分布变化(Fig.6D-F)。定量分析了肠细胞中BODIPY-C12与LipidTOX(中性脂质染料)双阳性斑点的数量,表明脂肪酸在肠细胞中的局部消耗增加(Fig.6G-H)。通过TAG检测试剂盒分析了脂肪体中的TAG水平,显示CRTC过表达降低了TAG水平(Fig.6I)。综上所述,这些结果表明ECs中的cytoCa2+抑制膳食脂质消化和肠内脂肪生成,同时促进线粒体生物生成 (Fig.6J)。
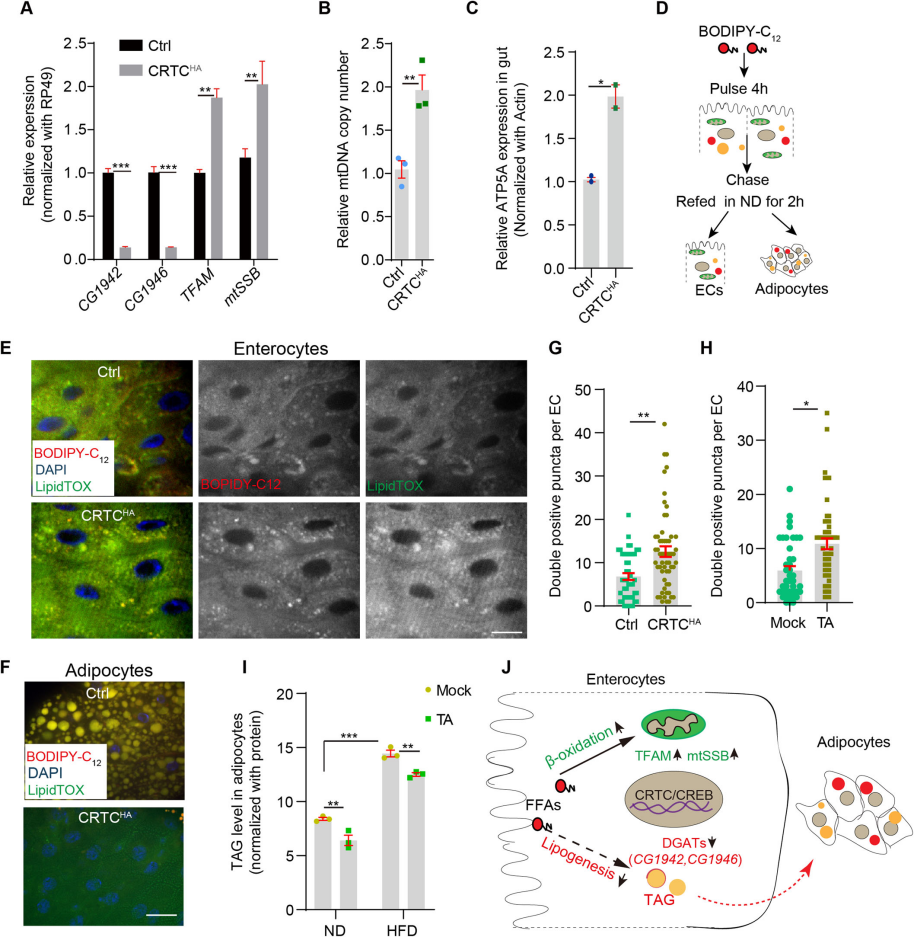
Fig6. Ca2+/CRTC/CREB级联促进线粒体生物发生并抑制肠细胞脂肪生成
7. TA介导的Ca2+信号级联抑制HFD介导的胰岛素抵抗
通过Akt-SPARK报告基因检测了胰岛素刺激下ECs中Akt活性的变化,显示HFD喂养的小鼠肠细胞中Akt活性降低,而补充TA或过表达CRTC能够恢复这种活性(Fig.7A,B),同时,TA补充或CRTC过表达也能显著恢复HFD喂养果蝇的肠细胞中的胰岛素敏感性(Fig.7C),进一步实验证实了这些处理能够抑制HFD引起的系统性高脂血症(Fig.7D)。这些结果表明,HFD喂养引起肠道胰岛素抵抗,肠道Ca2+介导的CRTC/CREB活性的进一步升高足以缓解糖尿病表型(Fig.7E)。
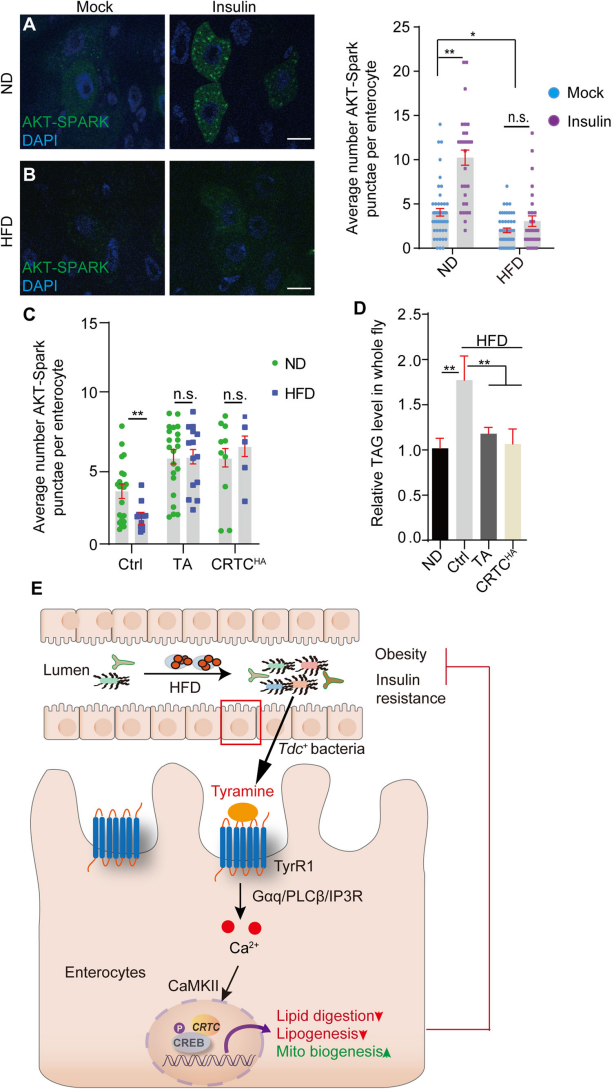
Fig7. TA介导的Ca2+信号级联抑制HFD介导的胰岛素抵抗
总 结
本文通过在果蝇和小鼠模型上的研究发现,高脂饮食引起的肠道菌群失调导致酪胺(TA)的产生增加,TA通过激活肠细胞中的cytoCa2+信号通路,进而激活CRTC-CREB转录复合体,这种信号级联不仅抑制了饮食脂质的消化和肠道脂肪生成,还促进了线粒体生物发生,最终减轻了HFD诱导的胰岛素抵抗。此外,研究还发现,TA的摄入能够改善小鼠的葡萄糖耐受性和胰岛素敏感性,表明TA可能成为治疗HFD相关代谢性疾病的潜在靶点。这些发现揭示了肠道微生物代谢产物与宿主代谢之间的复杂相互作用,并为开发新的代谢疾病治疗策略提供了科学依据。

























 2732
2732

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








