一、Cys响应的特异性:
1.Cys识别的背景:
1.1生物硫醇常见的种类以及参与的细胞活动:
Cys,Hcy,GSH三种生物硫醇,参与蛋白质的结构支持(Cys),潜在的疾病检测物(HCy)以及抗氧化剂(GSH),生物硫醇具有强大的氧化还原特性以及亲核性,可以保护细胞和组织免受内源性活性氧(ROS)和自由基氧化方面具有重要作用。

生物硫醇除了清除活性氧和自由基外,还在细胞凋亡、信号传导、细胞生长、免疫系统调节方面发挥积极作用。
1.2 生物硫醇在不同组织以及细胞中的浓度:
①GSH浓度:在细胞质中最普遍,通常在1~10mM之间。通常在大多数细胞中处于1~2mM,而在肝脏细胞中上升至10mM。
②Cys浓度:细胞中的Cys浓度一般在30~200μM之间。
③Hcy浓度:正常范围内浓度不确定,总体处于5~15μM之间。
1.3 半胱氨酸(Cys)不足可能诱发的疾病:
Cys在蛋白质三、四级结构中提供支撑,作为乙酰辅酶、谷胱甘肽、牛磺酸的前体。缺乏Cys可能会造成皮肤损伤、肝损伤、儿童发育迟缓。
1.4 现存的生物硫醇探针检测出现的困难:
①Cys的高反应性强调了快速原位检测的重要性。
②Cys与Hcy和GSH具有相近的结构单元和反应特性,由于Hcy和GSH的干扰,对Cys的检测提出了挑战。
2.Cys传感设计策略的思路:
2.1 半胱氨酸和其他生物硫醇的区别的依据:
半胱氨酸具有较小的PKa(1.96),以及半胱氨酸更小的结构(具有更强的亲核性)。
2.2 通过芳香取代重排反应的BODIPY探针设计:
参考文献:BODIPY-based fluorescent probe for cysteine detection and its applications in food analysis, test strips and biological imaging - ScienceDirect 通过8-苯基硫化物BODIPY衍生的产物显示出轻微的荧光,利用Cys更小的单元结构对硫化物进行进攻,利用推拉电子结构产生近红外的紫外吸收,相较于BDP-S,BDP-S-N-Cys具有3150倍的荧光强度,以及非常小的检测限11.2nM。

分子设计的亮点在于BODIYP两端的甲基,对于体积更大的Hcy具有较强的位阻,并以此设计了一个Cys专一性响应的紫外以及荧光实验。
2.3 Cys专一性实验:
2.3.1时间依赖的Cys紫外吸收光谱:
通过对孵育不同时间的Cys、Hcy、GSH作为对照,用于说明响应基团对Cys的响应时间以及对Cys的专一性。

2.3.2 时间依赖的荧光光谱实验:
根据上面的紫外光谱可以看到,响应后的BDP-S-N-Cys在500nm左右吸收峰逐渐变大。于是在500nm波长下进行时间依赖的荧光发射实验,可以显著看到Cys响应的峰高远高于同等浓度下的Hcy和GSH。

同样,在600nm波长下激发, BDP-S-N-Cys几乎没有荧光吸收,进一步证明了Cys响应的专一性。

2.4 通过芳香取代重排反应设计的Hcy和Cys双响应的NBD衍生物探针
文章来源:Improved Aromatic Substitution–Rearrangement-Based Ratiometric Fluorescent Cysteine-Specific Probe and Its Application of Real-Time Imaging under Oxidative Stress in Living Zebrafish | Analytical Chemistry 在先前的研究中,Niu发现了NBD-Cl可以同时识别Cys和Hcy,但是目前的大多数 Cys 特异性荧光探针通过响应时间将 Cys 与 Hcy 区分开来,这在长时间检测中将不可避免地受到 Hcy 的干扰。该篇文章作者Lin设计的Cou-SBD-Cl是一例多通道探针,相较于之前Niu设计的NBD-Cl对Cys具有更加显著的Cys选择性。

2.4.1 探针的结构设计:
与之前的Niu类似,仍然是通过NBD的芳香取代重排来实现Cys的选择性,但是不同于之前Niu提出的NBD-Cl结构,Lin提出的SBD-Cl中的磺酰乙二胺结构吸电子能力相对较弱。进一步降低Hcy的响应速率。
该探针使用了FERT能量转移原理,首先在450nm的波长下激发,发射481nm的蓝光。激发过后的能量通过偶极子向SBD-Cl转移。其中刚性结构哌嗪作为能量转移的Linker。能量转移的效率与供体的发射光谱与受体的吸收光谱的重叠程度、供体与受体的跃迁偶极的相对取向、供体与受体之间的距离等因素有关。
可以很明显地看到,SBD-Cl对Cys具有良好的紫外吸收能力,在无响应物以及Hcy和GSH的条件下几乎没有紫外吸收。同时我们看到在荧光发射光谱的条件下,有无Cys的探针吸收光谱具有显著差异,并且Cys响应的吸收光谱和Cys响应的发射光谱存在一定重叠。

如下的荧光滴定光谱实验中,随着Cys的浓度不断增加(由0到100equiv.),空白对照的吸收峰越来越小,Cys峰逐渐升高。通过荧光浓度的不断增强,580nm激发的荧光强度相较于481nm激发的荧光强度呈现线性递增的关系。

如下是检测限与PH适用范围的荧光滴定光谱实验,通过对580nm激发的荧光强度与481nm激发的荧光强度进行对照,发现在300μM的浓度下可以被检出。再在不同PH下的PBS溶液中检测,发现在PH>6的条件下具有较强的荧光强度。

2.4.2 FERT荧光共振能量转移的基本原理:
荧光共振技术,采用荧光分光光度计来测量分子间相互作用的方法。 下述待检测的蛋白是X,Y,D,A分别是两个相对具有供电和吸电作用的基团。D和A之间如果没有相互作用,则产生相应的荧光。而如果D和A之间的距离相对较近,则D产生的蓝光会被A吸收,从而发射出黄光。


在Cys激发之前,FERT效应关闭,但是在Cys响应之后FERT效应打开,以580nm的波长输出。 相反,由于不能发生重排,探针与Hcy或GSH相遇会产生4-巯基SBD衍生物,并引起几乎可以忽略的荧光强度变化。

芳香取代重排反应、醛环化反应、Michael加成反应、Se - N或S - S或键裂解反应、丙烯酸酯加成环化反应、金属配合物反应和亲核取代反应。
3.醛环化的探针设计:
3.1 醛环化的背景:
含有胺基和巯基的β-/γ-胺基烷基硫醇环化,是Cys常见的检测方式。Li课题组设计了一款对Cys专一性响应的荧光探针。可以观察到随着Cys的浓度不断递增,在552nm处的荧光显著增强。相比于其他生物硫醇随着荧光强度不断增加至50μM荧光强度具有显著变化。

3.2 罗丹明类似物探针结构设计:
根据先前的文献报道,由于Hcy相较Cys多一个碳,不易形成六元环。但是Cys形成五元环后发生1,6消除,从而形成一个D-Π-A结构,结构中存在羧基负离子的供电子基团和一个胺基正离子吸点基团,从而把探针的紫外吸收拉至近红外区域。
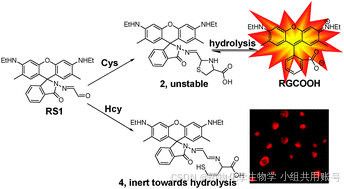
3.3 基于苯并噻唑类似物的ICT和EPIST电子转移机理的探针设计:
参考文献:通过 ICT 和 ESIPT 的设计特定调整收集红色荧光:半胱氨酸和活细胞成像的高效光学检测 - RSC Advances(RSC 出版)
双发射荧光探针可同时检测谷胱甘肽和半胱氨酸/同型半胱氨酸 - Chemical Science (RSC Publishing)

K. K. Upadhyay课题组设计了一个比率型,对Cys具备高选择性,极低检测限的荧光探针,该探针通过ESIPT质子转移机理伴随着光诱导互变异构化,表现出大Stoke位移以及酮-烯醇异构化产生的双发射特性。
3.3.1先前的Cys响应的苯并噻唑探针设计:

传统的传感方法可以分为两种类型:①生物硫醇对醛的亲核进攻类型。②游离羟基的再生(化学计量学方法)。先前Yang课题组发表了一篇罗丹明硫酯的化合物,该探针在GSH和Cys/Hcy响应中显示不同信号。在响应物不存在的条件下,荧光激发后,电子从罗丹明乙二胺基团的一侧转移至对硝基硫醇一侧。但是在GSH响应物的存在下,光致电子转移效应消失,罗丹明和苯并噻唑在587nm波长释放下呈现红色。同样,在Cys/Hcy的条件存在下,同样会出现光致电子转移效应消失。但是Cys/Hcy会发生重排,亚胺分子攻击罗丹明共轭双键4号位发生1,6-加成反应,罗丹明上的羟基和苯并噻唑上的氮发生EPIST质子转移效应,在454nm的波长下释放呈现蓝光。

Yang课题组设计的HBT探针不具备Hcy/Cys分辨的能力,在先前的研究中,仅存在EPIST电子转移机理。现在通过两个苯并噻唑结合(其中一个为苯并噻唑阳离子),利用阳离子的强吸电子作用,将发射波长由521nm拉至625nm。相较于BHI,Yang设计的R1具有①醛基具有专一的选择性。②具有超长的stoke位移(大约为130nm)。

3.3.2 紫外/荧光扫描时的溶剂选择对互变异构的影响:
总所周知,ICT、EPIST电子效应对环境及其敏感,作者尝试了多种溶剂。通过图a对探针在不同溶剂下的吸收峰,发现在非极性溶剂CDCl3的溶剂下吸收峰更高并且荧光吸收差异较大,可以观察到CDCl3的荧光发射波长有470nm和680nm双发射带形式存在,而大极性溶剂的荧光发射波长在500nm。

结果表明,正常烯醇形式在激发态(E*)470nm处也有所需的发射带,而在680nm处受激发的酮(K*)形式的发射带最大。结果表明,溶剂的极性增加会试着酮-烯醇变化趋向于烯醇式。从而导致酮的含量减少。这个结论与EPIST由于分子氢键的存在而非常温和。
3.3.3 紫外光谱以及荧光光谱的解析:
随着Cys的浓度不断增加(由1到10equiv.),在502nm处具有最大吸收,并在305-355nm的宽波段内显示。并且R1的颜色被漂白,ICT波段呈现衰减趋势,但是在397出现新的波段。在430nm和373nm处显示出两个良好的等吸点,强调了R1构型发生的变化。
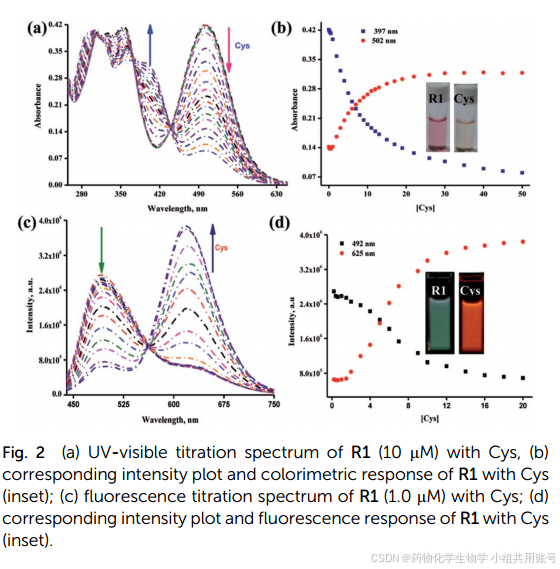
对该探针的PH耐用范围以及荧光强度变化,可以看到仅在1equiv.Cys的条件下达到平台期。同时可以观察到该探针可以在PH=5~9之间作为窗口使用。

3.3.4 理论计算验证Cys加成会趋向于酮的构型:
通过理论计算,我们可以得出,在烯醇形式中,R1在羟基的氢原子和苯并噻唑的氮原子之间具有很强的氢键,这表明分子内发生了EPIST效应。再通过R1和R1-Cys的LUMO和HUMO进行比较,发现R1-Cys的LUMO和HUMO之间的能量差要大得多,近一步证实了ICT电子效应的减弱。

3.3.5 氢谱和高分辨质谱对机理的预测:
对于核磁,我们通过比较R1和R1-Cys的核磁。发现9.67ppm处的醛质子在R1-Cys中消失了,而在5.76ppm处出现了一个新的峰,该峰属于噻唑环的甲基质子。同时,我们对加入1equiv.的Cys,结果显示在m/z=532处形成了R1-Cys加合物。

通过上述的理论计算和氢谱以及高分辨质谱,我们可以推测紫外吸收峰以及对应的电子效应。R1作为强ICT、弱EPIST探针,在502nm处的吸收最大,在492nm处具有弱EPIST吸收(N*)。半胱氨酸亲核进攻醛基,体系内的ICT减弱,同时EPIST增强,因此在红光区域观察到酮发射(T*,625nm)。

4. Micheal加成型探针设计:
本文设计并合成了一种基于苯并噻唑基团的新型半胱氨酸荧光探针(HL-Cys)。在620nm (Ex = 513 nm)处,HL-Cys与Cys发生Michael加成反应,导致丙烯酰基从母体配体(HL)上断裂,从而对Cys和GSH等其它分析物表现出特异性荧光响应。

4.1 紫外光谱/荧光光谱解析:
根据Cys的浓度不断提升(由1μmol不断提升至200μmol), 可以观察到没有加Cys之前,在315nm处显示出最大的吸收带,该吸收带所属于萘环。随着Cys浓度不断加大,在315nm和365nm处的吸收峰逐渐降低,而在513nm和393nm处的吸收峰不断上升。这些现象说明可能是Cys加入导致丙烯酰氯脱落所致。
HL-Cys对Cys、GSH、Hcy等生物硫醇由于不同的结构而对响应时间有不同的影响,研究响应时间是去分辨。可以观察到添加Cys 15min内达到最大值,而添加GSH没有荧光强度的增强,添加Hcy以后在30min内有微弱的上升,氮结果表明,HL-Cys具有根据时间区分Cys和Hcy以及GSH的 能力。


4.2荧光滴定实验解析:
荧光滴定实验是研究探针HL-Cys与Cys相互作用的方法。随着Cys浓度增加,HL-Cys在620nm处的荧光发射强度显著增加。然而当Cys浓度大于25µM时,荧光强度的增加逐渐趋于平稳。在区间0~25µM时,HL-Cys在620nm处的荧光强度与Cys浓度呈现良好的线性关系(R=0.9964),计算出检测限DL=0.076µM(公式为DL=3σ/斜率)。

4.3 不同氨基酸的竞争荧光光谱研究:
通过先后加入10µM的各种类型的氨基酸以及加入200µM的Cys来验证丙烯酰氯基团的专一性。a图中从1到22分别为HL-Cys、Lys、Trp、Ala、Gly、Thr、Ser、Arg、Tyr、Leu、Ile、His、Pro、Met、Gln、Val、Glu、Asn、Hcy、Asp、GSH、Cys。b图中HL-Cys(10µM)在不同氨基酸存在下(620 nm)对Cys(200µM)的识别竞争研究。从1到21:None、Lys、Trp、Ala、Gly、Thr、Ser、Arg、Tyr、Leu、Ile、His、Pro、Met、Gln、Val、Glu、Asn、Hcy、Asp和GSH。通过在620nm吸收的荧光强度可以看出HL-Cys对Cys具有相对较高的专一性。

4.4 理论计算以及机理预测:
丙烯酸酯通常被认为是其他研究小组用作Cys的识别集团。因此,根据相关报道合上述结果,推测HL-Cys的反应机制。如上图所示,10µMHL-Cys在620nm发射波长处仅有较弱的荧光强度,这是因为由于羟基和丙烯基的结合抑制了ESIPT电子过程和ICT电子过程。

为了更好地说明反应机理,还进行了简单地理论计算,如图6所示,烯醇式和酮式在HOMO中的电子密度分布相似,均广泛定位于整个分子。不同之处在于酮式LUMO地电子密度分布主要集中在苯并咪唑集团上。

二、Cys实验设计方法设计:
1.谢涛师姐文献:
参考文献:
该工作设计了一个Cys响应并且粘度响应的探针,当前Cys探针已经有很多设计,但是单一银子并不能准确阐明相关生理效应。因此,涉及多功能荧光探针同时探究两个及其以上的分析物在生理或者病理中的联系,对疾病的研究具有重要意义。
目前检测Cys和粘度的线粒体探针具有一下不足:①响应Cys的stoke位移较小,会产生自荧光干扰。②响应Cys或黏度时的荧光增强倍数较低。③双通道成像造成串色的干扰。

1.1紫外-可见光谱、荧光光谱解析:
在没有Cys存在下,探针在300nm和555nm附近有一个小吸收峰、大吸收峰,当探针识别Cys以后,在395nm处形成了一个新吸收峰。,再结合响应前后的荧光发射谱图,以390 nm 为激发波长时,探针识别Cys 后的体系在570 nm 处呈现显著的荧光发射,荧光强度增强了174 倍,斯托克斯位移为175 nm。

1.2 探针QA-PA 识别Cys 的灵敏性与时间依赖性研究:
在根据探针响应Cys 的紫外吸收、荧光发射光谱之上,进一步评估了探针与不同浓度的Cys 后的荧光强度变化情况。在实验中我们发现荧光强度值在Cys 浓度为80 μM 时出现拐点并随后趋于稳定,更重要的是在0-10 μM 的浓度范围内,570 nm 处的荧光发射值与Cys 浓度呈现出十分优异的线性相关(图3-3B),相关系数R2 = 0.99,根据相应的拟合方程Y = 69.49X+125.30,检测限公式3 σ/k(σ = 14)计算出探针QA-PA 能检测Cys 的最低浓度为49 nM。
紧接着我们扫描了不同时间段探针(10 μM)识别Cys(100 μM)的荧光发射光谱,结果如图3-3C 所示。在37°C 的恒温条件下,在0 至25 分钟内,荧光强度逐渐增强并在30 分钟后逐步趋于稳定(图3-3D),这表明探针对Cys 的响应是时间依赖性的,可以应用于对Cys 的实时检测。

1.3 稳定性研究&选择性研究:
稳定性实验中,分别在PH=3-10的区间内测量其荧光强度,观察该探针的PH窗口。选择性实验中,使用实验室现有的氨基酸、阳离子、还原性物质检测,其中除了Hcy使用200 μM,其他物质均使用1mM,观察其荧光强度大小。

2.段德琛师兄NADH-R文献解读:
参考文献:细胞核荧光探针:一种红色发光、NADPH响应的的喹啉基荧光探针_荧光探针的文章-CSDN博客
NAD(P)H是一种重要的氢供体和电子载体,参与了许多生物过程。开发用于NAD(P)H活体成像的小分子工具对于进一步探索其病理生理作用具有重要意义。在探针的帮助下,我们首先监测了活细胞中外源性和内源性NAD(P)H的产生,随后观察了不同代谢扰动下活细胞中NAD(P)H水平的动态变化,最后可视化了脑卒中模型小鼠活脑中NAD(P)H水平的下降。
2.1该探针设计的优势:
该探针设计基于以下原因:①吡啶基团和氰基都是强吸电子基团,因此当1-甲基喹啉基团被NAD(P)H还原,释放出1-甲基-1,4二氢喹啉,这是一种富电子的胺基基团时,可以进行推拉式分子内电荷转移(ICT)过程。它延长了总共轭键,从而提供了释放红色荧光的途径;②氰基的引入降低了多甲基链的电子密度,从而降低了它们与单重态氧的反应性,从而有效地提高了所设计探针的光稳定性;③吡啶部分还可以提高探针的水溶性,并通过与线粒体内膜负膜电位的静电相互作用提高探针的线粒体靶向性。④ NADH-R和NADH-G对NAD(P)H都具有良好的选择性和敏感性,但前者的荧光增强(335倍)、超低检出限(12 nM)和红光发射(657 nM)优于后者。

2.2 紫外/荧光吸收谱图解析:
2.2.1紫外/荧光吸收吸收谱图解析:
文章首先研究了在37℃的PBS缓冲液(10mM,PH 7.4, 0.1%DMSO, v/v)中NADH-R和NADH-G对NADH的光谱响应。NADH- R(5 μM)在376 nm处表现出最大的吸收,加入NADH后,溶液颜色由无色变为蓝色,使NADH的吸收红移至610 nm,可以用肉眼检测到NADH。此外,单独NADH- r没有荧光发射,但添加NADH (25 μM)后,657 nm处的荧光强度增强了335倍(图1B)。吸收光谱和荧光光谱的变化对应于NADH的氢化物加成,导致自由荧光团NADH- RH的释放,其具有典型的供体- π -受体结构,并基于推-拉ICT过程产生独特的荧光信号。
2.2.2 时间依赖性荧光响应分析/荧光滴定实验表明:
使用657nm处的红色荧光信号激发,在25min内达到平台期,表明响应速度相对较快.荧光滴定实验表明,在0 ~ 35 μM范围内,随着NADH浓度的增加,657 nm处的荧光发射强度逐渐增加,并与0 ~ 5 μM范围内的NADH浓度呈良好的线性关系(图1D及其插图)。根据回归方程F = 7.66 + 173.68 [NADH],计算出NADH- r对NADH的检出限(LOD = 3σ/k)低至12 nM。

3. 段德琛师兄Nu-H2O2的文献解析:
①上述的Nu-H2O2基于上述的Nu-Red骨架,这为分子的发光和细胞核靶向奠定了基础。 ②响应基团采用了H2O2经典的响应基团,可以在温和的条件下被H2O2水解。③Nu-H2O2和H2O2反应后,发生1,6-消除反应,释放出不含氮正离子的NH,分子整体的推拉效应减弱,呈现出更弱的ICT电子转移。
3.1 亚细胞器共定位研究:
三、核内Cys实验设计方法:
1.细胞核内Cys参与的氧化还原调节:
参考文献:Spatial Redox Regulation of a Critical Cysteine Residue of NF-κB in Vivo - ScienceDirect
1.1 该篇文章的意义:
氧化还原(redox) 调节与转录因子 NF-kB 的激活有关。然而,氧化还原调节的意义和机制仍然难以捉摸,主要是由于氧化还原反应中快速质子转移和细胞内存在许多氧化还原分子造成的技术限制。在这篇文章中,作者建立了在体外和体内测量蛋白质及其单个半胱氨酸残基的氧化还原状态的通用方法,涉及巯基修饰试剂和 LC-MS 分析。使用这些方法,作者证明了 NF-kB 的氧化还原状态在空间上受其亚细胞定位的调节。
虽然 p65 亚基和 p50 亚基的大多数半胱氨酸残基在细胞质和细胞核中以类似的方式减少,但 p50 的 Cys-62 在细胞质中高度氧化,在细胞核中强烈还原。Cys-62 的还原形式对于 NF-kB 的 DNA 结合活性至关重要几条证据表明,氧化还原因子 Ref-1 参与细胞核中 Cys-62 的还原(62指的是在多肽上的氨基酸残基序列)。我们提出,细胞核中 p50 的 Ref-1 依赖性减少是 NF-kB 激活的必要步骤。

1.2 Cys在细胞核内氧化还原调节中起到的作用:
NF-kB是一种炎症转录因子,是Ref转录家族的成员之一。NF-kB由两个亚基p50和p65组成,并与IkBα抑制性蛋白结合。在适当的刺激下,NF-kB释放抑制性蛋白并易位到细胞核中,在细胞核内结合DNA并进行转录。现如今,NF-kB的活化机制已经被广泛研究。然而,DNA结合步骤是否存在以及如何激活在很大程度上是未知的。
Cys的氧化还原状态可以在细胞内可逆的发生改变,涉及蛋白质稳定性、伴侣活性和蛋白质结构。一些转录因子(Ref-1)以氧化还原调节的方式通过和DNA相关位点的结合而降低细胞内氧化水平。目前,部分氧化还原的调节方式暂时没有确定,原因是难以监测蛋白质氧化还原状态的改变,少数人使用了物理化学或者生化技术定量氧化的半胱氨酸的量。
1.3 Nishi课题组先前做的抗氧化药物以及该药物在本实验中的作用:
由于细胞内的氧化水平和炎症息息相关,之前课题组报道了一种抗炎药物E3330,特异性的抑制NF-kB结合DNA活性。但该药物不能抑制其他炎症转录因子AP-1、NF-AT。在先前的报道中,E3330不影响NF-kB活化的几个步骤,包括IkBα的脱离,p65的磷酸化以及NF-kB的迁移,这么说明E3330可能靶向一种未知的炎症核因子。
通过该课题组从细胞核中提取蛋白跑WB,发现E3330和细胞核内氧化还原因子Ref-1有关, E3330是Ref-1活性的抑制剂。Ref-1是一种核蛋白,最初被鉴定为核算内切酶活性的DNA修复酶。Ref-1可以刺激AP-1核其他转录因子包括p35和HIF-1活性。通过体外半胱氨酸点诱变分析,作者发现AP-1核转录因子和DNA结合是由Ref-1地还原活性刺激的。
很少有文章分析确定这些过程是否涉及氧化还原反应,以及这些过程如何在细胞中发生,许多氧化还原调节分子的存在,如硫氧还蛋白(Trx)、硫氧还蛋白还原酶(TrxR)、谷氧还蛋白(glutaredoxin)、核氧化还原蛋白(nucleoredoxin)和谷胱甘肽(GSH),使得探索真核细胞中蛋白质之间的特异性氧化还原调节变得困难。

该课题组利用不可逆巯基修饰试剂和LC-MS分析,评估了NF-kB在体内激活过程中地氧化还原状态。我们提供的证据表明NF-kB地p50亚基的Cys-62在细胞核内被Ref-1选择性地还原,并且这种还原是NF-kB在体内活化的先决条件。
1.4 实验设计:
1.4.1探针购买:
该课题组购买了硫醇修饰试剂荧光素-5-马来酰亚胺(F5M)和N-乙基马来酰亚胺(NEM),溶解在DMF配置为浓度为200mM的溶液。F5M可以筛选含有半胱氨酸残基的突变蛋白,激发波长为 494 nm,发射波长为 519 nm。NEM用于共价修饰蛋白质的半胱氨酸残基的试剂。

1.4.2 细胞荧光标记:
将不同条件下培养的J-50细胞在含有10mM F5M的培养基中,37℃下孵育5min,后续步骤均在4℃下进行。用含有10mM F5M的PBS溶液洗涤两次后,离心重新收获细胞,将细胞培养于含有10 mM HEPES (pH 7.9)、10 mM KCl、0.1 mM EDTA、0.1 mM EGTA、0.5 mM苯甲基磺酰氟和1 mM F5M的低渗缓冲液中。孵育完毕后,对细胞核和细胞质部分加入100mM DTT 停止F5M对细胞核和细胞质内的生物硫醇的标记反应。对洗脱液进行SDS-PAGE,并对蛋白质的荧光强度进行分析。
1.5 结论分析:
F5M对硫醇捕获系统的评估-为了测量蛋白质的氧化还原状态,F5M采用带有荧光素基团的马来酰亚胺衍生物作为硫醇修饰试剂。马来酰亚胺不可逆地修饰还原的半胱氨酸,但不氧化,在4°C的生理pH范围内(pH 6.5-8.0),正常的氧化还原反应几乎不能进行。
由于巯基修饰试剂F5M特异性地标记了还原的半胱氨酸残基,因此用荧光强度测量蛋白质的还原状态。B和C, Trx与TrxR反应后Trx氧化还原状态的可视化。将氧化Trx野生型和Trx C32、35S (40 pmol)与指定量的TrxR在0.2 mM NADPH存在下于37°C孵育不同时间,用荧光法分析Trx的还原状态。
可以观察到,随着NAPDH的浓度和时间的不断增加,荧光强度逐渐增强。3pmol的TrxR还原100seconds以后,因光强度达到了100%。


1.6 Trx和TrxR的体外反应分析:
在NADPH存在的情况下,TrxR特异性地在两个保守的半胱氨酸残基Cys-32和Cys-35上减少Trx。将一定量氧化后的Trx和TrxR浓度的增加在37℃下孵育不同时间,在4℃下进行F5M标记反应如图BC所示,Trx的Cys-32和Cys-35上突变为丝氨酸残基时,荧光强度没有随时间增加到可监测的水平。
Ref-1降低p50,以E3330敏感的方式激活DNA结合活性,之前的EMSA表明,Ref-1刺激p50/p50同型二聚体,但不刺激p65/p65同二聚体,这些发现表明Ref-1通过影响p50亚基激活NF-kB的DNA结合。
1.7 Ref-1和p50之间氧化还原反应的证明:
为了证明Ref-1和p50之间发生了氧化还原反应,在将Ref-1和p50混合后,在不同的时间点监测Ref-1和p50的氧化还原状态。如图1B所示,1分钟后,p50降低到50%。相反,Ref-1的荧光强度在1分钟内降低到60%。因此,我们认为Ref-1通过氧化还原交换反应直接快速降低了p50。

1.8 E3330对Ref-1抑制的证据:
有人提出,但是尚未证实,E3330对Ref-1的抑制是通过阻断其氧化还原活性实现的。与先前的结果一致,E3330以剂量依赖的方式抑制氧化p50对ref-1依赖性的DNA激活。同样,E3330也抑制了ref-1依赖性氧化p50的还原形式的氧化还原条件或DNA结合活性。
从上述这些结果,我们得出结论,E3330是通过抑制Ref-1的氧化还原活性介导。

1.9 改进后的生物硫醇捕获办法:
人类p50在62、88、119、124、162、262、273位置具有七个半胱氨酸。为了鉴定被Ref-1还原的p50半胱氨酸残基,作者改进了上述硫醇的三个步骤:① 用马来亚酰亚胺NEM不可逆标记Trx。②用Lys-C内肽酶消化NEM标记的蛋白质。③ LC-MS 鉴定。
1.10 结论:
Ref-1通过特异性地降低p50的Cys-62激活Nf-kB核转录因子,从而在体内和体外激活了Nf-kB的DNA结合。作者发现Trx和TrxR对p50地氧化转台没有影响。先前的研究表明Trx参与Nf-kB地氧化还原调节。然而,一些证据表明Ref-1在体内p50地降低中起到重要作用。



























 721
721

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








