本文转载自“微生物生态”,已获授权。
“微生物组”(Microbiome)是指由多种微生物聚居在一起形成的生态群落,从人和动物的肠道,到植物、土壤、海洋,它们无处不在,推动着地球物质循环,影响着人体乃至整个地球生物圈的健康。小到一个工厂的污水处理,大到温室气体排放造成气候变暖,人类面临的能源短缺、环境污染、粮食安全、疾病流行等几乎所有问题的背后,都有微生物的身影。
近年来,得益于低成本高通量基因测序技术的发展、计算和成像技术的改进,以及用于数据分析的生物信息学工具的革新等进展,高通量测序走下神坛,变得平易近人,使得更多的学科领域开始投入到微生物组学的研究中来。
对于微生物组学的研究,最常见的就是对微生物群落结构多样性的研究。也就是通过第二代高通量测序技术(Roche454高通量测序、Illumina MiSeq高通量测序等)对16SrDNA/18S rDNA/ITS等序列进行测序,获得样品中的微生物群落组成以及相对丰度。探讨微生物多样性对于研究微生物与环境的关系、环境治理和微生物资源的利用有着重要的理论和现实意义。
在高通量测序的时代,“16S测序”在各大杂志期刊、学术报告及重大会议中频繁出现,那么你真正了解16S测序吗?为什么选择16S测序?16S测序区域又该如何选择?
今天,小圆要跟大家聊一下16S测序中的引物选择。
1、16S 是个啥?
16S rRNA 即16Sribosomal RNA,是原核核糖体30S小亚基的组成部分。16S中的"S"是一个沉降系数,亦即反映生物大分子在离心场中向下沉降速度的一个指标,值越高,说明分子越大。16SrRNA基因是细菌上编码rRNA相对应的DNA序列,存在于所有原核微生物的基因组中。16S rRNA具有高度的保守性和特异性以及该基因序列足够长(包含约50个功能域)。随着PCR技术的出现及核酸研究技术的不断完善,16S rRNA基因检测技术已成为病原菌检测和鉴定的一种强有力工具。数据库的不断完善,应用该技术可以实现对病原菌进行快速、微量、准确简便地分类鉴定和检测。该技术主要有三个步骤:首先是基因组DNA的获得,其次是16S rRNA基因片段的获得,最后是进行16S rRNA基因序列的分析。
(卢瑟菌:“字太多,不想看,还能更通俗点吗?”)
好吧,以上是网上搜的,简单来说,16S是一段序列,是原核微生物的“身份证”,你拿到这段序列,再跟数据库一比对,所有的物种信息你就完全明了了。因为操作简单,可行性高,比对信息准确,所以被认为是微生物多样性组学研究中最常用的检测手段。
2、16S测序区域是个啥?
这与16S rRNA基因的特殊结构有关,其基因结构示意图如下图1。基因全长1500bp左右,基因序列包括间隔分布的保守区和可变区,对于细菌一般包括9个保守区(C1-C9)和9个可变区(V1-V9)。不同种类的细菌有相同的保守区序列和不同的可变区序列,因此可以根据保守区序列设计引物来扩增环境样品中所有细菌16SrRNA基因,而根据可变区序列来区分不同种类的细菌。

传统方法中最常用的引物是27F和1492R,几乎能扩增出完整的16SrRNA基因全长,由于目前二代高通量测序的读长限制,该引物不适用于高通量测序平台,但被广泛用于纯菌的分子鉴定。考虑到目前主流高通量测序平台读长的限制,只能对16SrDNA的某一段可变区进行测序。有的文献中选择测单V区(V3/V4/V6),有的测双V区(V3-V4区或V4-V5区),还有的选择三V区(V1-V3区、V5-V7区或V7-V9区)进行16S rDNA测序。
(卢瑟菌:“说了半天,我到底选啥才能测的稳准狠啊!”)
3、16S测序区域到底该怎么选择?
想测的准,当然长度越长越准确嘛,但是出于经济实惠的角度考虑,其实测双V甚至单V区也已经足够。一般而言,我们环境微生物组学常用的,也是认可度比较高的测序区域是V3-V4,V4-V5,或者单测V4区。
那不同的测序区域对于我们的数据结果有什么影响呢?
中科院的周宁一老师,2013年在AEM杂志发表文章(IntragenomicHeterogeneity of 16S rRNA Genes Causes Overestimation of Prokaryotic Diversity),研究比较了16S不同区域的测序结果,所选择的引物如下:

研究结果显示,V4-V5区域是最佳的测序区域,造成的基因组内异质性最小。
4、那我该选择哪对引物?
一般而言,我们常用的V4-V5区引物有515F/907R 或者515F/926R。这也是罗氏454测序时代最常用的16S测序引物。
在Illumina时代,由于平台测序长度的限制,V4单区测序(515F/806R)被更为广泛地使用。也是地球微生物计划中推荐使用的引物序列(想了解地球微生物组戳这里:http://www.earthmicrobiome.org/emp-standard-protocols/16s/)。
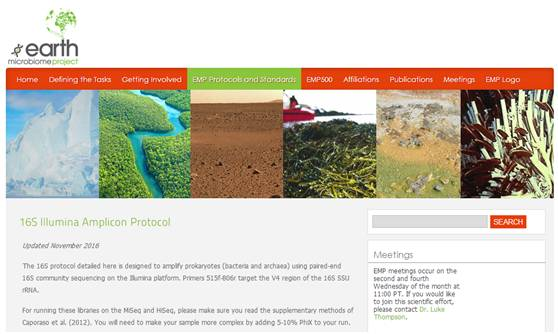
图2 地球微生物组计划中使用的16S测序引物
传统的V4区引物,由Caporaso等科学家(2012)设计,对细菌的覆盖度高,也可以同时检测到部分古菌。然而随时数据库的日益更新,我们发现这对引物虽好,但还是有改善空间的。既然可以细菌古菌通测,那我们能不能改进一下,让古菌覆盖的更广泛一些。
转眼到了2015年,Parada等科学家发现,传统的515F/806R引物,会对海洋中SAR11群落的检测造成低估,同时对γ-变形菌纲(Gammaproteobacteria)造成高估,因此他们对传统515F引物的一个兼并碱基做了改进,并结合926R引物,对海洋中的微生物多样性进行了检测,发现改进后的515F引物可以有效地改善扩增偏好性。
秉承着追求科(wu)学(mei)严(jia)谨(lian)的目标,越来越多的科学家想要在有限的经费内获得更多覆盖面更全的序列信息,于是Apprill等科学家在515F改善的基础上,进一步改善了806R端(嗯,也是只改了一个兼并碱基而已),相比原先的806R端其覆盖面更广了。他们推销的口号是“我的片段虽然短!花钱更少测的好!”
好吧,Caporaso眼看自己辛苦设计出来的引物都被改进了,虽然改的好,但直接说出来岂不是太没面子了。于是2016年,几个相关科学家联手发表了一篇文章(Walters et al. 2016),使用不同的环境样品对这几对引物进行了比较。最后研究证明,改进后的515F/806R确实效果不错,相比之前,不仅对细菌群落的检测进行了矫正,还可以多测出来好多古菌,一举两得!

注:上表是改进前后引物序列的详细信息,改进的碱基用黑体加粗了。
此文发表后,地球微生物组计划也与时俱进的把这两对改进后的引物列在了自己的网站,希望更多的环境微生物组学科学家可以来规范使用引物,方便进行不同环境的研究对比。截止目前,短短不到一年时间内,谷歌学术检索到引用改进后515F/806R引物的文献已有8篇,其中包括一篇Cell(Sampson et al. 2016)和一篇Nature Microbiology(Snijderset al. 2016)。

图3 截图示例地球微生物组计划改进后的16S测序引物
因此对于环境样本而言,使用改进后的515F/806R or515F/926R,可能在行业标准日益规范的今天,是一个更好地选择,今后应该会成为16S检测微生物多样性测序的首选。
(卢瑟菌:“然而科学研究日新月异,谁知道过几天会不会再来一篇文章把前面这些都否了呢~”)
最后,我们的口号是:“引物选得好,测序没烦恼!”
参考文献
1.Sun D L, Jiang X, Wu Q L, et al. Intragenomic heterogeneity of 16S rRNA genescauses overestimation of prokaryotic diversity. Applied and environmentalmicrobiology, 2013, 79(19): 5962-5969.
2.Caporaso, J. G. et al. Ultra-high-throughput microbial community analysis onthe Illumina HiSeq and MiSeq platforms. ISME J (2012). doi:10.1038/ismej.2012.8
3.Caporaso, J. G. et al. Global patterns of 16S rRNA diversity at a depth ofmillions of sequences per sample. Proc Natl Acad Sci USA 108, 4516–4522 (2011).
4.Walters, W. et al. Improved Bacterial 16S rRNA Gene (V4 and V4-5) and FungalInternal Transcribed Spacer Marker Gene Primers for Microbial CommunitySurveys. mSystems 1, 915 (2016).
5.Parada, A. E., Needham, D. M. & Fuhrman, J. A. Every base matters:assessing small subunit rRNA primers for marine microbiomes with mockcommunities, time series and global field samples. Environ Microbiol 18,1403–1414 (2014)
6.Apprill, A., McNally, S., Parsons, R. & Weber, L. Minor revision to V4region SSU rRNA 806R gene primer greatly increases detection of SAR11bacterioplankton. Aquat. Microb. Ecol. 75, 129–137 (2015).
7.Sampson T R, Debelius J W, Thron T, et al. Gut Microbiota Regulate MotorDeficits and Neuroinflammation in a Model of Parkinson’s Disease[J]. Cell,2016, 167(6): 1469-1480. e12.
8. Snijders A M, Langley S A, Kim Y M, etal. Influence of early life exposure, host genetics and diet on the mouse gutmicrobiome and metabolome[J]. Nature Microbiology, 2016, 2: 16221.
PS: 既然都看到这里了,就点个赞再走嘛,客官~~~

相关文章
扩增子引物选择 16S结构 16S单V4区是最佳选择? 引物评估
猜你喜欢
10000+:肠道细菌 人体上的生命 宝宝与猫狗 梅毒狂想曲 提DNA发Nature 实验分析谁对结果影响大 Cell微生物专刊
文献阅读 热心肠 SemanticScholar Geenmedical
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
写在后面
为鼓励读者交流、快速解决科研困难,我们建立了“宏基因组”专业讨论群,目前己有国内外150+ PI,1500+ 一线科研人员加入。参与讨论,获得专业解答,欢迎分享此文至朋友圈,并扫码加主编好友带你入群,务必备注“姓名-单位-研究方向-职称/年级”。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍末解决群内讨论,问题不私聊,帮助同行。

学习16S扩增子、宏基因组科研思路和分析实战,关注“宏基因组”


点击阅读原文,跳转最新文章目录阅读







 本文介绍了16S测序技术及其在微生物多样性研究中的应用,重点讲解了16S rRNA基因的结构、测序区域的选择及引物的设计优化过程。
本文介绍了16S测序技术及其在微生物多样性研究中的应用,重点讲解了16S rRNA基因的结构、测序区域的选择及引物的设计优化过程。



















 5031
5031

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








