目录
肿瘤相关成纤维细胞综述学习_肿瘤相关成纤维细胞系-CSDN博客
①六种癌症类型共有的CAF亚型(pan-CAFs)
我们对黑色素瘤 (MEL)、头颈部鳞状细胞癌 (HNSC) 和肺癌 (LC) 的 CAF 进行了综合分析,并确定了每种 CAF 亚型中明显活跃的分子特征。鉴定了单个 CAF 亚型的基因特征,并用于研究亚型丰度与临床结果和免疫治疗耐药性的关联。我们确定了六种癌症类型共有的CAF亚型(pan-CAFs),并揭示了区分它们的分子特征和遗传途径。有趣的是,这些 CAF 亚型表达不同的免疫抑制因子,例如 CXCL12 和 CXLC14,以及干细胞促进因子 IL-6。此外,我们还鉴定了对 CAF 异质性至关重要的新型转录驱动因子(MEF2C、TWIST1、NR1H3、RELB 和 FOXM1)。此外,我们发现CAF亚型与不同的临床结果相关,并揭示了可以激活或抑制癌症进展或参与抗PD1或抗PD-L1免疫治疗耐药性的关键分子途径。
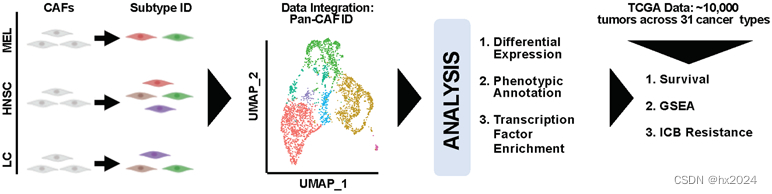
1,六种泛CAF亚型的鉴定和分子表征
pan-CAF亚型的标记基因和生物学过程。
(A) UMAP(左)描绘了亚型,热图(右)描绘了与 pan-CAF 亚型相关的标记基因。Pan-myCAF,肌成纤维细胞样CAF;pan-dCAF,结缔组织增生性CAF;pan-iCAF 和 pan-iCAF-2,炎性样 CAF;pan-nCAF,正常肌成纤维细胞;pan-pCAF,增殖 CAF。(B) 单个癌症类型中 CAF 亚型的比例。(C)显示pan-CAF亚型标记基因表达的点图。(D) 泛CAF亚型的富集基因集。(E) 描述泛CAF亚型细胞周期状态的UMAP。(F) 与选定功能相关的基因表达热图。(G)编码细胞表面蛋白的基因表达热图。
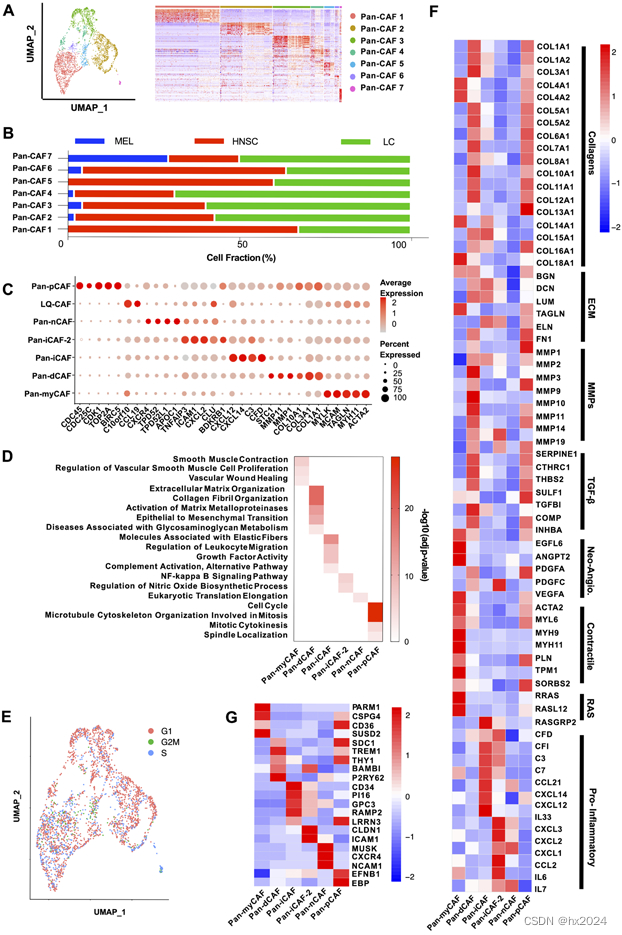
2,Pan-CAF亚型特异性转录因子和基因调控网络
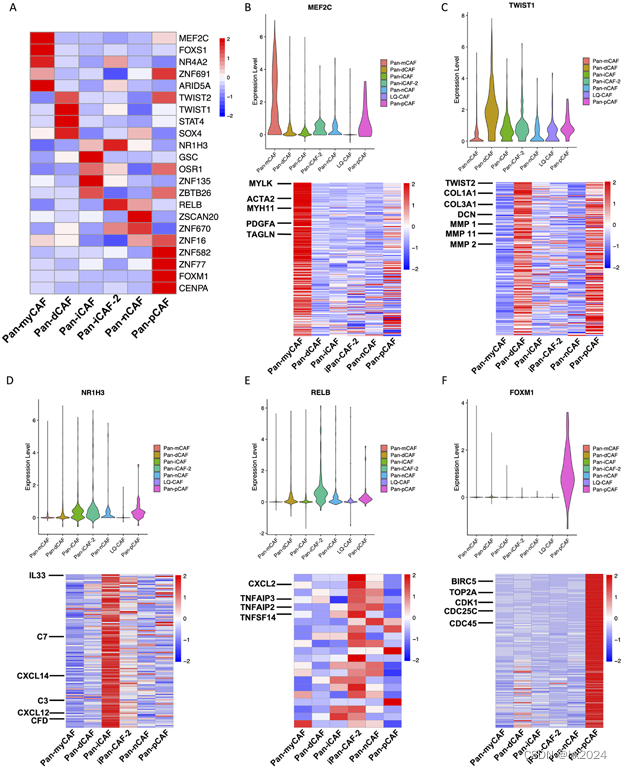
(A)转录因子基因表达的热图。(B) 描绘 MEF2C 表达的小提琴图(上图)和描绘 MEF2C 靶基因在 pan-myCAF 中上调的热图。(C) 描绘 TWIST1 表达的小提琴图(上)和描绘 TWIST1 靶基因在 pan-dCAF 中上调的热图。(D) 描绘 NR1H3 表达的小提琴图(上)和描绘 NR1H3 靶基因在 pan-iCAF 中上调的热图。(E) 描绘 RELB 表达的小提琴图(上图)和描绘 pan-iCAF-2 中上调的 RELB 靶基因的热图。(F) 描绘 FOXM1 表达的小提琴图(上)和描绘 FOXM1 靶基因在 pan-pCAF 中上调的热图。
3,预后分析
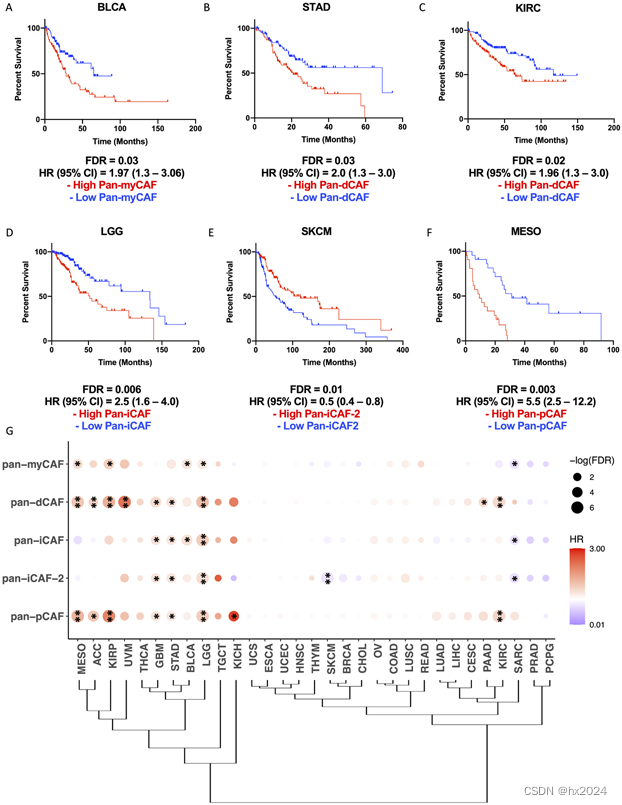
4,Pan-CAF亚型与肿瘤中特定分子功能的关联
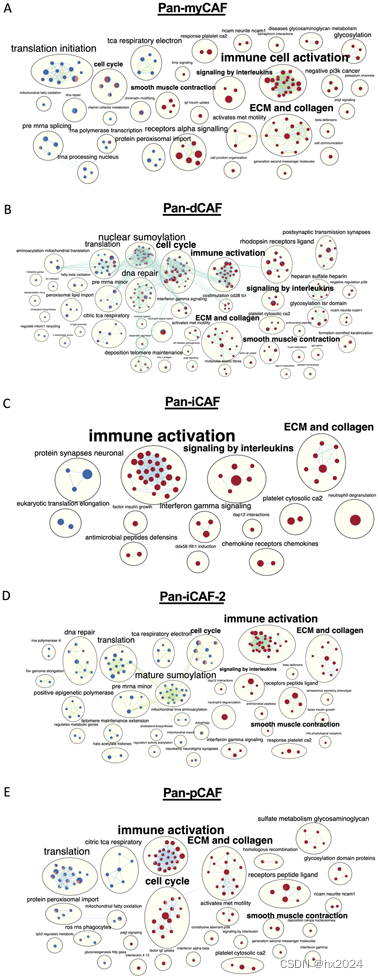
节点是肿瘤中表达较高的基因中富集(红色圆圈)或耗尽(蓝色圆圈)的项,泛CAF基因特征表达增加,而边缘则将术语与重叠基因连接起来。使用 Enrichmentmap 通过更通用的术语进一步总结了具有类似功能的连接节点。在每个节点中,填充的颜色代表来自各个癌症类型的结果。(A) 由 BLCA 和 KIRP 癌症引起的 pan-myCAF。(B) KIRC、KIRP、LGG、UVM、MESO 和 STAD 癌症的 pan-dCAF 结果。(C) LGG 的泛 iCAF 结果。(D) LGG 和 SKCM 癌症的 pan-iCAF 2 结果。(E) KIRC、KIRP、LGG 和 MESO 的 pan-pCAF。
②泛癌单细胞转录图谱上癌症相关成纤维细胞的分子分类
我们采用了包含12种实体瘤类型的综合单细胞转录组图谱。我们的目标是建立一种新的分子分类,并阐明CAFs的进化轨迹。我们使用单细胞调控网络推理和聚类以及单细胞基因集富集分析研究了每种 CAF 亚型的功能特征。通过生存曲线分析评估这些亚型的临床相关性。同时,我们对肿瘤组织进行多重免疫荧光染色,以确定不同肿瘤阶段CAF亚型的动态变化。此外,我们使用分子对接技术将小分子原花青素 C1 (PCC1) 鉴定为基质生成 CAF (matCAF) 的靶标,并通过体外和体内实验进一步验证了这些发现。
1, 泛癌 CAF 图谱的构建和分析
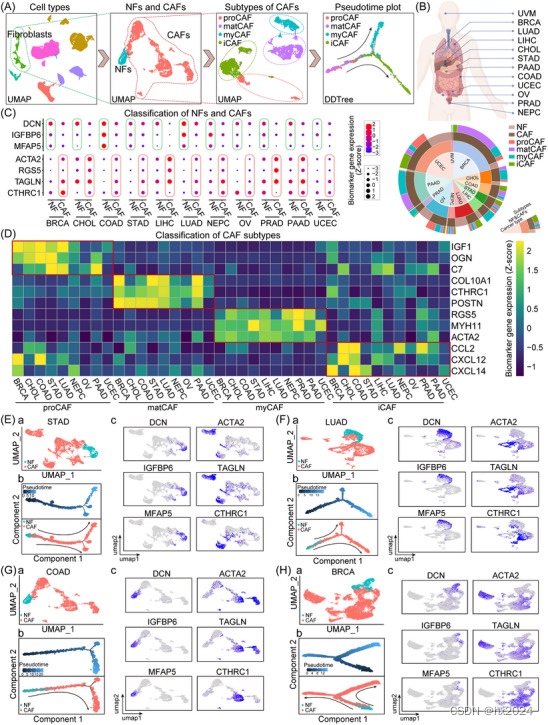
通过泛癌单细胞RNA测序(scRNA-seq)分析对成纤维细胞进行全面分类。(A) 用于鉴定癌症相关成纤维细胞 (CAF) 亚型的单细胞转录组分析过程的示意图。将成纤维细胞与每个样品中的其他细胞类型分离,然后分为正常成纤维细胞 (NF) 和 CAF。随后,基于独特的分子属性,将CAF进一步分为祖细胞CAF(proCAF)、基质生成CAF(matCAF)、肌成纤维细胞CAF(myCAF)和炎性CAF(iCAF)亚型。进行伪时间分析以阐明这些亚型的发育轨迹。(B) 饼图显示了 NF 和各种 CAF 亚型在 12 种癌症中的分布:葡萄膜黑色素瘤 (UVM)、乳腺癌 (BRCA)、肺癌 (LUAD)、肝细胞癌 (LIHC)、胆管癌 (CHOL)、胃癌 (STAD)、胰腺导管腺癌 (PAAD)、结直肠癌 (COAD)、子宫体子宫内膜癌 (UCEC)、卵巢癌 (OV)、前列腺腺癌 (PRAD) 和神经内分泌前列腺癌 (NEPC)。(C) 本研究中成纤维细胞的分类依赖于几种生物标志物:DCN、IGFBP6 和 MFAP5(用于 NF),以及 ACTA2、RGS5、TAGLN 和 CTHRC1(用于 CAF)。这些生物标志物在 NF 和 CAF 中的表达强调了我们单细胞亚组的准确性。(D) 四种 CAF 亚型的鉴定得益于它们各自的亚型特异性生物标志物:proCAF 的 IGF1、OGN 和 C7;matCAF 的 COL10A1、CTHRC1 和 POSTN;RGS5、MYH11 和 ACTA2 用于 myCAF;用于 iCAF 的 CCL2、CXCL12 和 CXCL14。(E-H)通过统一流形近似和投影(UMAP)图、伪时间分析图和生物标志物表达特征图,展示了STAD、LUAD、COAD和BRCA中NFs和CAFs的详细分类。对于每种癌症类型,UMAP 图 (a) 将成纤维细胞群中的 NF 和 CAF 分开,伪时间分析 (b) 揭示了 CAF 的发育轨迹,特征图 (c) 说明了 NF 和 CAF 生物标志物的表达分布。
2,四种 CAF 亚型中不同生物标志物的鉴定和表征
为了阐明 CAF 内部的异质性,我们在将 CAF 与其 NF 对应物分离后进行了无监督聚类。这种分层过程导致了四种不同 CAF 亚型的鉴定:proCAF、iCAF、myCAF 和 matCAF。这些亚型是根据独特生物标志物的相对丰度和表达水平来区分的。
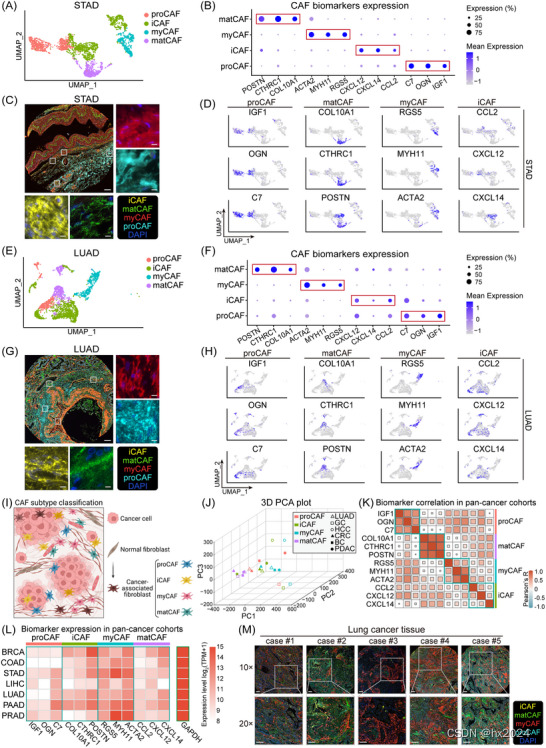
四种癌症相关成纤维细胞 (CAF) 亚型的表征和生物标志物表达。(A) 统一流形近似和投影 (UMAP) 图,展示了 STAD 中 4 种 CAF 亚型的分类。(B) 气泡热图说明了 STAD 中亚型特异性生物标志物的表达水平,突出显示了相应 CAF 亚型中各个生物标志物的比例升高和平均表达水平。(C) STAD 患者胃癌组织的代表性多重免疫荧光 (mIF) 图像,用 DAPI(蓝色)、抗COL10A1(绿色)、CCL2(黄色)、OGN(青色)和α平滑肌肌动蛋白 (α-SMA)(红色)抗体染色。以 10× 倍率(比例尺 = 200 μm)拍摄的大图像,以 40× 倍率(比例尺 = 50 μm)拍摄相同组织的插图。(D) UMAP图描述了STAD中所有CAF亚型的生物标志物表达水平,表明在相应的CAF亚型群体中表达增强。(E-H)在LUAD中观察到的CAF亚型分布和生物标志物表达模式与在STAD中相似。(I) CAF亚型示意图,说明每个亚型的空间分布。(J) 三维主成分分析 (PCA) 图展示了各种实体瘤中 CAF 亚型的聚类。(K) 在每个 CAF 亚型中,特定标记物表现出正相关。(L) 癌症基因组图谱 (TCGA) 队列中分析的生物标志物的表达水平和相对丰度。(M) 来自 LUAD 的组织微阵列的代表性 mIF 图像。DAPI(细胞核)以蓝色显示,COL10A1(产生基质的 CAF [matCAF])以绿色显示,CCL2(炎症性 CAF [iCAF])以黄色显示,OGN(祖细胞 CAF [proCAF])以青色显示,α-SMA(肌成纤维细胞 CAF [myCAF])以红色显示。五个案例中每个案例的上图都是在10×倍放大倍率下拍摄的,相应的下图是以20×倍放大倍率从同一组织拍摄的(10×图像中的轮廓区域对应于20×图像中显示的区域),所有比例尺代表200μm。DAPI,4',6-二脒基-2-苯基吲哚。
3,CAF亚型转录因子之间的激活多样性

癌症相关成纤维细胞 (CAF) 亚型的区分功能。(A) 显示 LUAD、STAD 和 COAD 中每种 CAF 亚型的前 20 个转录因子 (TF) 的激活水平。突出显示了具有与 CAF 子类型相对应的功能的 TF。(B) 确定了BRCA、COAD、LUAD、PAAD和STAD中祖CAFs(proCAFs)的前100个富集TF。交集图显示了不同癌症组合中共享 TF 的数量。在所有癌症类型中富集的TFs在红色框中表示。(C-E)还对炎症性 CAF (iCAF) (C)、肌成纤维细胞 CAF (myCAF) (D) 和产生基质的 CAF (matCAF) (E) 进行了类似的分析。(F) t分布随机邻域嵌入(t-SNE)图说明了COAD中的CAF分类,分别使用4个TF(NFIXs、IRF9、MEF2C和CREB3L1)作为proCAF、iCAF、myCAF和matCAF中富集TFs的例子(括号内标明了每个TF调控子中的基因数量)。曲线下面积 (AUC) 分数超过阈值的细胞将突出显示并与相应的 CAF 亚型群体对齐,如 t-SNE 图所示。(G) 火山图显示了COAD中不同CAF亚型中基因的特异性高表达。在每个 CAF 亚型和其他亚型之间进行差异表达基因 (DEG) 分析。值得注意的是,具有对数的基因2|折叠变化|> 1.5 和 p < .05 被涂成红色,并进行随后的基因本体 (GO) 富集分析。(H-K)GO富集图显示proCAFs参与增殖,以及COAD(H)中其他CAF亚型执行的功能。与免疫应答相关的高表达基因在 iCAF 中富集 (I)。此外,与收缩和肌肉相关事件有关的基因在 myCAF 中富集 (J),而控制细胞外基质 (ECM) 形成的基因在 matCAF 中富集 (K)。
4,CAF亚型在肿瘤进展中的进化途径
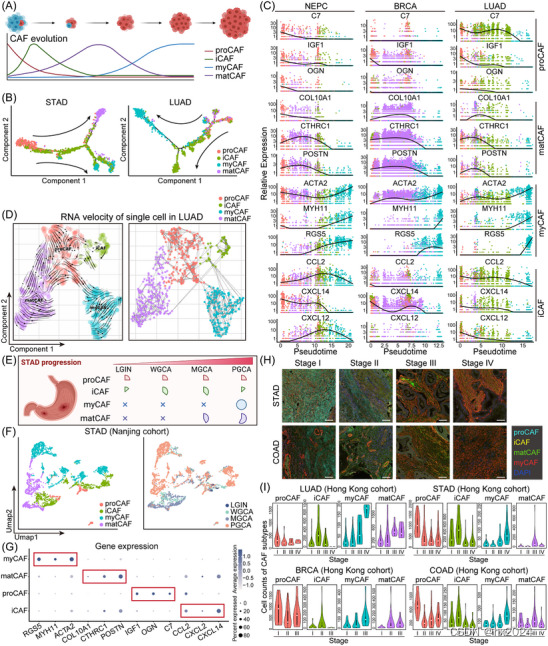
描述实体瘤中癌症相关成纤维细胞 (CAF) 亚型的典型进化轨迹。(A) 说明整个肿瘤进展过程中 CAF 亚型演变的示意图。(B) 由 Monocle2 确定的二维状态空间内 CAF 亚型沿伪时间的排列。这种假时间分析表明,祖细胞 CAF (proCAF) 是 STAD 和 LUAD 中其他 CAF 亚型的发育祖细胞。(C) 通过基于CAF亚型生物标志物表达水平的单细胞伪时间分析推断神经内分泌前列腺癌(NEPC)、BRCA和LUAD中CAF亚型的发育轨迹。(D) 在单细胞 RNA 剪接水平上进行类似的分析,其中 RNA 速度图描绘了 CAF 亚型从 proCAF 到肌成纤维细胞 CAF (myCAF) 的演变。(E) 使用内部单细胞 RNA 测序 (scRNA-seq) 数据集,详细说明 STAD 中不同 CAF 亚型分布的动态变化以及癌症进展的示意图。(F) 在南京 STAD 队列中,呈现了不同 CAF 亚群的单细胞均匀流形近似和投影 (UMAP) 图,与疾病进展的不同阶段相关。(G) 气泡热图显示了 STAD 中亚型特异性生物标志物的表达水平,突出了相应 CAF 亚型中相应生物标志物的比例和平均表达水平的增加。(H) STAD 和 COAD 的代表性多重免疫荧光 (mIF) 图像突出显示了不同 CAF 亚型的生物标志物的表达变化 (比例尺 = 200 μm)。(I) 小提琴图阐明了 LUAD、STAD、BRCA 和 COAD 中四种 CAF 亚型在肿瘤阶段的细胞计数变化。
5,细胞环境中不同CAF亚型之间的互通网络
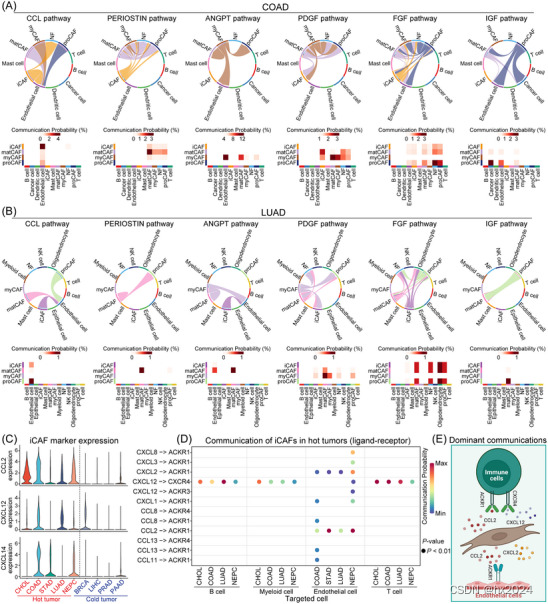
癌症相关成纤维细胞 (CAF) 亚型在单细胞水平上与其他细胞类型的详细相互作用。(A) 确定每个 CAF 亚型与 COAD 中其他细胞类型之间的基本相互作用途径,使用通讯概率作为相互作用强度的指示。选择的相互作用途径包括 C-C 基序趋化因子配体 (CCL) 通路 (inflammatory CAF [iCAF])、PERIOSTIN 通路(基质产生癌症相关成纤维细胞 [matCAF])、血管生成素 (ANGPT) 和血小板衍生生长因子 (PDGF) 通路(肌成纤维细胞 CAF [myCAF]),以及成纤维细胞生长因子 (FGF) 和胰岛素样生长因子 (IGF) 通路(祖细胞 CAF [proCAF])。(B) 对 LUAD 中的每个 CAF 亚型进行了类似的分析,得出的结果与 COAD 中发现的结果一致。(C) iCAF 生物标志物(CCL2、CXCL12、CXCL14)在热肿瘤和冷肿瘤中的表达水平比较显示所有 iCAF 标志物在热肿瘤中的表达水平升高。(D) 热肿瘤中 iCAF 相互作用机制的示意图,其中 CXCL12-CXCR4 配体-受体对参与与 B 细胞、髓样细胞和 T 细胞的相互作用。同时,CXCL2-ACKR1 和 CCL2-ACKR1 配体-受体对有助于与内皮细胞的相互作用。(E) 该示意图说明了 iCAF 与免疫细胞和内皮细胞之间的主要配体-受体相互作用,展示了肿瘤微环境 (TME) 内通讯的复杂性。
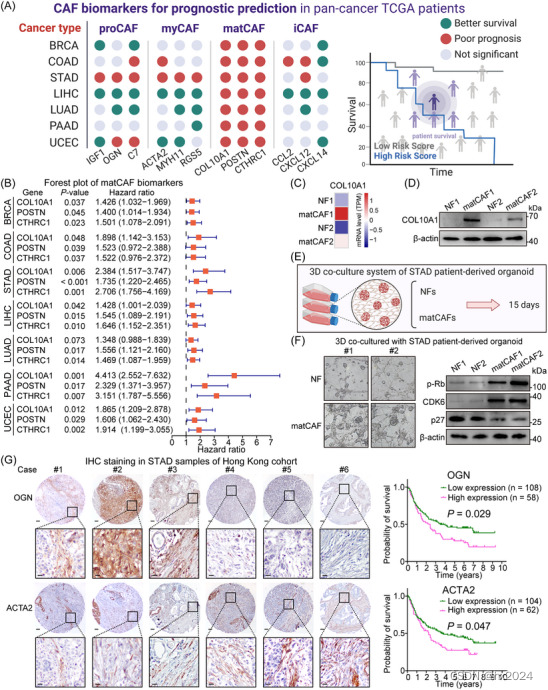
6, CAF 亚型作为预后指标的临床意义
收集了TCGA队列中癌症患者的临床数据和基因表达水平。根据每种 CAF 亚型的生物标志物的高表达或低表达将患者分为几组,并进行生存分析。结果显示,虽然 iCAF、myCAF 和 proCAF 的生物标志物在预后价值方面产生了可变或不确定的结果,但 matCAF 生物标志物的高表达始终与所有癌症类型中较差的生存率相关。这凸显了matCAF生物标志物作为预后指标和治疗靶点的潜力。
7,靶向matCAF的药物筛选和验证
鉴于matCAF的促癌作用,我们使用小鼠模型进行了体内实验。这涉及共同注射matCAF和肿瘤细胞。
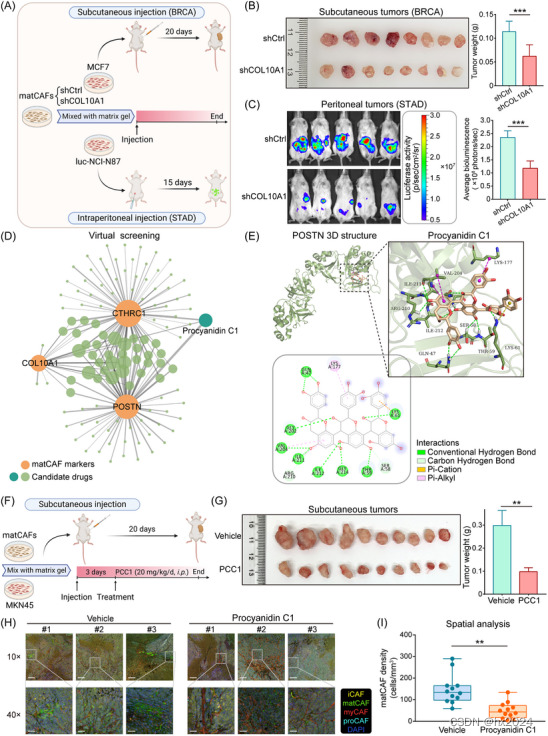
抑制产生基质的癌症相关成纤维细胞 (matCAF) 可抑制肿瘤生长和转移。(A)体内小鼠模型的示意图,涉及共同注射matCAF和肿瘤细胞。上半部分描绘了皮下注射 MCF7 细胞的 BRCA 小鼠模型,而下半部分显示了腹膜内注射 luc-NCI-N87 细胞的 STAD 小鼠模型。在两个实验中,根据所接受的治疗,将matCAF分为两组:shCtrl组和shCOL10A1组。(B) 皮下肿瘤的图像表明,BRCA 模型中的肿瘤生长在 shCOL10A1 组中显着抑制 (n = 8/组)。直方图统计显示,shCOL10A1组的肿瘤重量明显小于shCtrl组(p < .001)。(C) 小鼠生物发光水平的体内成像和直方图分析表明,matCAF 的COL10A1敲低降低了 STAD 腹部转移的能力 (n = 5/组;p < .001)。(D) 原花青素 C1 (PCC1) 预计对所有三种 matCAF 标志物均有效。(E) 显示了 POSTN 与 PCC1 结合的预测三维结构和分子间相互作用。(F)皮下接种CAFs和MKN45细胞后小鼠的目视观察,这些细胞与基质凝胶结合。(G) 载体组和 PCC1 组中皮下肿瘤的图像。PCC1组肿瘤重量显著低于对照组(n = 10/组;第 < 页 .01)。(H) 载体组和 PCC1 组中不同 CAF 亚型生物标志物的多重免疫荧光 (mIF) 图像。与载体组相比,PCC1组的绿色染色减少(比例尺= 200μm用于低放大倍率,50μm用于高放大倍率)。黄色代表CCL2(炎症性CAF [iCAF]生物标志物);绿色代表COL10A1(matCAF生物标志物);红色代表 ACTA2(肌成纤维细胞 CAF [myCAF] 生物标志物);青色代表OGN(祖细胞CAF [proCAF]生物标志物);蓝色 DAPI 代表原子核。(I)选择每个染色切片的4个随机视场,通过空间分析计算matCAF密度。分析显示,PCC1处理组的matCAF细胞密度显著低于载体组(p < .01)。
8,讨论部分
CAF 研究面临的主要挑战包括准确描述 CAF 的异质性和亚群、确定不同的标记物以及了解每个群体的独特作用。值得注意的是,不同研究人员对不同类型癌症的 CAF 进行了不同的分子分类。43 , 55 , 56 , 57 传统上,根据 CAFs 在不同癌症中的主要功能,CAFs 亚群主要分为 iCAFs 和 myCAFs。46 , 58 通过 IL-1 和肿瘤生长因子-β(TGF-β)刺激胰腺导管腺癌中的静止胰腺星状细胞诱导 IL-6 CAFs(iCAF)和 α-SMA CAFs(myCAF)就是这种分类的例证: FAPP/PPDPNPP 和 FAPPP/PPDPNP+++-群体,前者显示 TGF-β 信号富集,并与癌症进展相关。13 , 61 Kieffer 等人基于 scRNA-seq 对乳腺癌中的 CAF 进行了广泛的分子分类,确定了八个不同的 CAF 群,其中包括三种 iCAF 和五种 myCAF 类型。62 此外,对黑色素瘤、头颈部鳞状细胞癌和肺癌的其他研究进一步将 CAF 细分为六种亚型。63 尽管进行了大量研究,但目前仍缺乏普遍接受的 CAFs 分子分类。我们的研究利用 scRNA-seq,在泛癌症谱中建立了四种 CAF 分子亚型:proCAF、iCAF、myCAF 和 matCAF。这种分类适用于各种实体瘤,并与每种肿瘤类型的主要特征十分吻合。值得注意的是,我们观察到在 LIHC 和 PRAD 中几乎完全不存在 proCAF 和 matCAF。虽然这可能是由于样本量有限,但也表明在这些癌症类型进展过程中观察到的明显纤维化可能需要进一步研究。39 , 64 事实上,作为 myCAF 的生物标志物,α-SMA 是组织纤维化的标志物之一。在肝癌中,纤维化主要由肌成纤维细胞驱动。这一现象解释了为什么肝脏肿瘤的 CAF 亚型中,肌成纤维细胞占很大比例。这些细胞中α-SMA的存在不仅标志着它们的纤维活性,还凸显了它们在TME中的关键作用。
在单细胞分析中,我们发现 matCAF 在各种实体瘤中都很突出。matCAF 的主要作用是分泌大量胶原蛋白,使其成为 ECM 的关键组织者。特定的高表达基因和独特的 TF 标志的富集支持了这一点。胶原蛋白是癌症组织基质的重要组成部分,在促进肿瘤转移和进展方面的作用已得到公认,这与我们的观察结果一致。65 , 66 PCA 聚类分析发现 matCAF 是大多数肿瘤类型中相对保守和稳定的亚型。临床上,每种 CAF 亚型独特的生物标记物特征表明,高 matCAF 特征与几乎所有腺癌的不良预后相关。这一发现促使人们探索针对 matCAF 的策略。值得注意的是,消减癌症组织中 matCAF 中的 COL10A1 能显著减少肿瘤的进展。我们的计算虚拟筛选确定了 PCC1 作为三种 matCAF 生物标志物的潜在靶向药物: COL10A1、POSTN和CTHRC1。在胃癌皮下肿瘤小鼠模型中使用 PCC1,结果显示肿瘤生长受到明显抑制,matCAF 显著下降。这与之前的研究显示 PCC1 在减缓细胞衰老 27 和阻碍结直肠癌进展方面的作用相吻合。67
虽然有些研究强调了靶向 CAF 有可能无意中加速癌症进展, 68 , 69 但这强调了各种 CAF 亚群在 TME 中的不同作用。我们对 matCAF 的关注,尤其是其致癌特性与癌症患者较差预后之间的联系,提供了一个细致入微的视角。matCAF 的一个关键功能是分泌胶原蛋白,增强 ECM 的形成。胶原 I 同源三聚体是 ECM 的重要组成部分,已被认为是胰腺癌的致癌基因,对肿瘤的进展起着积极作用。65 然而,必须认识到,在某些情况下,特定的 CAFs 可能会通过其 ECM 生成起到抑制肿瘤的作用。这凸显了 CAF 生物学的复杂性和异质性,因 CAF 亚型和肿瘤环境而异。未来的研究将深入探讨 matCAF 的内在致癌机制。
在我们的研究中,我们观察到与不利生存和化疗疗效有限有关的肿瘤,即 "冷肿瘤",如 LIHC 和 BRCA, 70 的 iCAFs 较少而 myCAFs 较多。相反,以炎症细胞浸润增加为特征的 "热肿瘤",如STAD和COAD,则显示出较高的iCAFs含量,而iCAFs是已知对免疫疗法反应良好的亚群。新的研究支持这样一种观点,即从 "冷 "TME 过渡到免疫原性 "热 "TME 可提高免疫疗法的疗效,从而改善治疗效果。71 , 72 我们的研究通过分析 iCAFs 的比例,为评估实体瘤的免疫疗法敏感性提供了一个新的视角。有趣的是,在 "热点肿瘤 "中,我们发现 iCAFs 主要通过 CXCL12-CXCR4 轴与免疫细胞相互作用。不过,iCAFs 在肿瘤中的作用似乎是双向的。一些研究表明它们具有促进肿瘤生长的作用, 43 而另一些研究则表明它们具有抑制肿瘤生长的作用。73 这凸显了进一步进行功能测试以明确 iCAF 群作用的必要性,以及进行更详细的亚分类以了解 CAF 作用复杂性的重要性。
我们还研究了 CAF 亚型的进化轨迹,发现了它们在肿瘤环境中出现的时间模式:proCAFs 是最早出现的形式之一,随后 iCAFs 增加,matCAFs 和 myCAFs 出现在肿瘤进化的中后期。对多种癌症病理切片的分析表明,中晚期肿瘤中 matCAF 特别是 myCAF 的出现频率增加,这表明随着肿瘤的发展,CAF 亚群也在发生动态变化。这表明 CAF 亚型在肿瘤发生过程中并非一成不变,而是随着时间的推移而不断演变。研究表明,衰老 CAFs 表现出衰老相关分泌表型(SASP),富含促炎细胞因子,iCAFs 在缺氧条件下表现强劲。74 , 75 鉴于衰老和缺氧在整个肿瘤进展过程中普遍存在,这为 iCAFs 的进化提供了基础。然而,晚期肿瘤中的 iCAFs 会随着免疫反应的减弱而逐渐减少。晚期肿瘤向 matCAF 和 myCAF 的转变表明,这些亚型与晚期肿瘤对放疗和化疗的耐药性之间存在潜在联系。76 虽然我们的研究没有直接证实这一假设,但它与之前的研究结果一致,并为未来的研究指明了新的方向。了解这些 CAF 亚型的具体作用对于开发靶向疗法,尤其是晚期耐药肿瘤的靶向疗法至关重要。
参考文献:
1:Molecular Features of Cancer-associated Fibroblast Subtypes and their Implication on Cancer Pathogenesis, Prognosis, and Immunotherapy Resistance
2:The molecular classification of cancer-associated fibroblasts on a pan-cancer single-cell transcriptional atlas






















 792
792











 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








