
成果简介
锂金属电池面临界面处电荷转移缓慢以及锂金属阳极和电解质之间的寄生反应等问题,这是由于氧供体溶剂的强电负性。这些因素限制了锂金属电池在低温下的可逆性和动力学性能。
近日,中国科学院金属所李峰团队应用了一种非溶剂共溶剂来减弱醚类溶剂中供体氧的电负性,使阴离子供体参与到Li+的溶剂化结构中。这种策略显著加速了Li+的脱溶过程,并减少了溶剂对界面传输和稳定性的副作用。设计的阴离子聚集电解质具有独特的温度不敏感溶剂化结构,使锂金属阳极在室温和-20°C下实现了高平均库仑效率。高负载的LiFePO4||Li电池在室温、-20°C和-40°C下经过150次循环后显示出100%的容量保持率。实际1Ah级别的LiFePO4||Li袋式电池在室温下进行充放电时,在-20°C和-40°C下分别实现了81%和61%的容量。通过电负性调控构建温度不敏感溶剂化策略,为开发低温电池电解质提供了新的方法。相关文章以“Designing Temperature-Insensitive Solvated Electrolytes for Low- Temperature Lithium Metal Batteries”为题发表在Journal of the American Chemical Society上。
研究背景
石墨负极的锂离子电池在低温,特别是低于-40°C的条件下难以实现高可逆的充放电性能。在这种工作条件下,石墨的嵌锂电位易于降至相对于Li/Li+的0.0V以下,从而限制了锂离子电池的可逆性,这是由于锂在石墨表面沉积所致。相比之下,锂金属阳极含有过量的锂,有效防止了因锂损失引起的容量迅速下降。此外,锂金属阳极具有诱人的能量密度,具有高理论比容量(3860 mAh g−1)和最低电化学电位(相对于标准氢电极为−3.04 V)。这些特性使得锂金属阳极成为实现高能量密度低温锂金属电池的首选。
然而,锂枝晶的生长以及传统碳酸盐电解质中锂金属阳极的低库仑效率对锂金属电池的性能构成了重大挑战。这一问题源于碳酸盐电解质的溶剂化,其中乙烯碳酸酯(EC)的氧供体溶剂的强电负性完全阻止了Li+和阴离子的配位。因此,在电解质中以溶剂分离离子对(SSIP)的形式存在,阴离子不能直接与Li+配位。碳酸盐溶剂的高溶剂化能力需要更多的能量进行界面处的Li+脱溶过程,导致锂沉积/剥离过程中的过电位增加。碳酸盐电解质的最低未占分子轨道(LUMO)的低能级形成的界面,具有高有机含量、较厚且易碎的特点,不能稳定锂阳极。这些问题在低温下进一步恶化,对锂金属电池在寒冷环境中的长期稳定性产生了负面影响。此外,碳酸盐电解质的固有特性,包括其高冰点和粘度,限制了其在低温应用中的适用性。
弱溶剂电解质(WSE)具有低极性溶剂,高浓度电解质(HCE)具有高盐/溶剂比,以及在HCE中加入非溶剂共溶剂的局部高浓度电解质(LHCE),可以有效减少Li+与溶剂的配位。这允许更多的阴离子整合到Li+溶剂化结构中,形成接触离子对(CIP,一个阴离子与一个Li+配位)和离子聚集体(AGG,一个阴离子与两个或多个Li+配位)。这种溶剂化促进了快速脱溶和富无机稳定界面的形成,从而在室温下实现高库仑效率并抑制锂枝晶的生长。然而,WSE的有限氧化耐受性和温度依赖溶剂化,HCE的粘度增加,以及LHCE在低温下锂稳定性不足等挑战,限制了这些电解质在高能量密度低温锂金属电池中的适用性。
图文导读
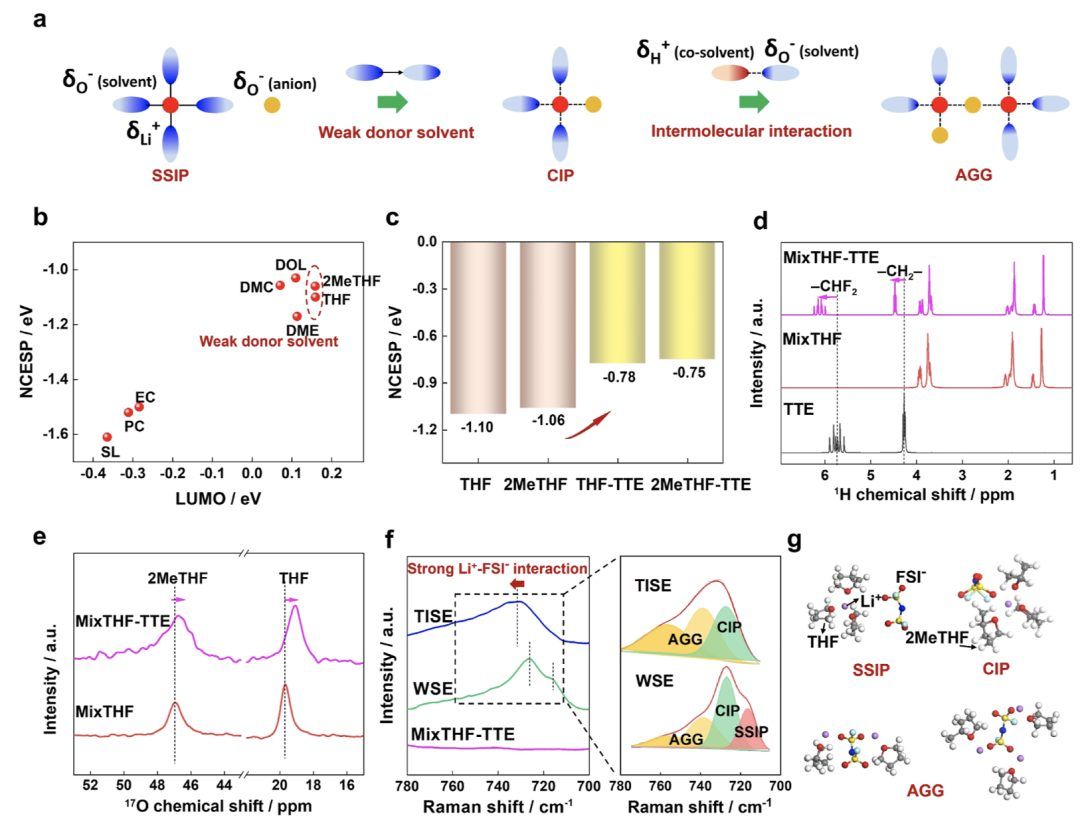 图1 电解质溶剂化设计的原理和溶剂化调节
图1 电解质溶剂化设计的原理和溶剂化调节
通过调节供体溶剂的电负性设计溶剂化结构。电势描述了溶剂分子的表面电荷分布,用于反映溶剂对Li+的溶剂化能力。负电势中心(NCESP)为溶剂提供了一个定量参数,与电解质的溶剂化结构相关。图1a展示了通过控制静电相互作用进行溶剂化设计的示意图。根据NCESP,强供体溶剂如砜(SL)、EC和PC在供体氧上具有强电负性(图1a,b)。强电负性导致与Li+的强配位,因此,SSIP主导了溶剂化结构。相比之下,弱供体溶剂,如碳酸二甲酯(DMC)、1,3-二氧戊环(DOL)、1,2-二甲氧基乙烷(DME)、四氢呋喃(THF)和2-甲基四氢呋喃(2MeTHF),在供体氧上的电负性较弱,这允许Li+-阴离子结合在低浓度电解质中形成CIP和AGG。此外,溶剂的更高LUMO能级在热力学上不利于有机反应物的分解,这进一步确保了界面的稳定性。基于常见砜、碳酸盐和醚类溶剂的NCESP和LUMO能级图,THF和2MeTHF被选为具有较弱电负性和最佳还原稳定性的溶剂(图1b)。THF和2MeTHF也在适合作为低温溶剂的弱供体溶剂中具有最低的熔点(图S1)。在本研究中,混合溶剂MixTHF(THF/2MeTHF,1:1)作为弱供体溶剂,结合了2MeTHF的低NCESP和宽液相窗口(图S1)以及THF的宽电化学稳定性(图1b和S2)。
TTE(−94到93°C)具有强电子吸引基团−CFn,显著减弱了TTE中氧的电负性,使TTE不能作为Li+配位的供体溶剂。TTE作为共溶剂进一步减弱了MixTHF的电负性,正如THF-TTE复合物和2MeTHF-TTE复合物的NCESP值相比THF和2MeTHF更弱(图1c)。核磁共振(NMR)光谱用于分析共溶剂TTE对MixTHF的影响。在MixTHF与TTE混合后,在TTE的1H NMR光谱中观察到显著的下场位移−CHF2和−CH2−(图1d,S3和S4)。THF信号在15−25 ppm范围内和2MeTHF在45−49 ppm范围内的17O光谱在与TTE混合后均上移(图1e)。TTE中的−CHF2和−CH2−基团周围的正电势通过邻近的−CF2−基团增强,可能与MixTHF中的电子富氧相互作用,从而减少氧周围的电子云密度。也有报道称TTE中的H与醚类中的O之间的氢键可以提高1,2-二甲氧基乙烷(DME)的氧化稳定性。此外,MixTHF的1H信号几乎没有变化(图1d),表明MixTHF中的H与TTE中的O或F之间的相互作用可以忽略不计。如图S5所示,TTE中−CHF2的轻微位移主要归因于混合后TTE分子间H-F耦合相互作用的减弱,因为MixTHF中没有1H光谱变化。阴离子主要由O、F和N等电负性原子组成,这使得与MixTHF和TTE中的负电O和F原子之间的相互作用不太可能。除与正电Li+相互作用外,阴离子可能与MixTHF和TTE中的H原子相互作用。
然而,值得注意的是,加入锂盐后,与MixTHF-TTE相比,电解液中TTE的1H光谱没有显著变化,表明阴离子与TTE之间的相互作用可以忽略不计(图S6)。此外,在TTE存在的情况下,Li+与溶剂之间的结合能的绝对值低于在没有TTE存在的情况下,表明TTE减弱了Li+与溶剂之间的相互作用(图S7)。基于Hirshfeld划分的独立梯度模型可视化了溶剂与TTE之间的相互作用。发现THF和2MeTHF中的氧对TTE中的氢有吸引作用(图S8)。因此,MixTHF溶剂中的氧电负性被TTE减弱。
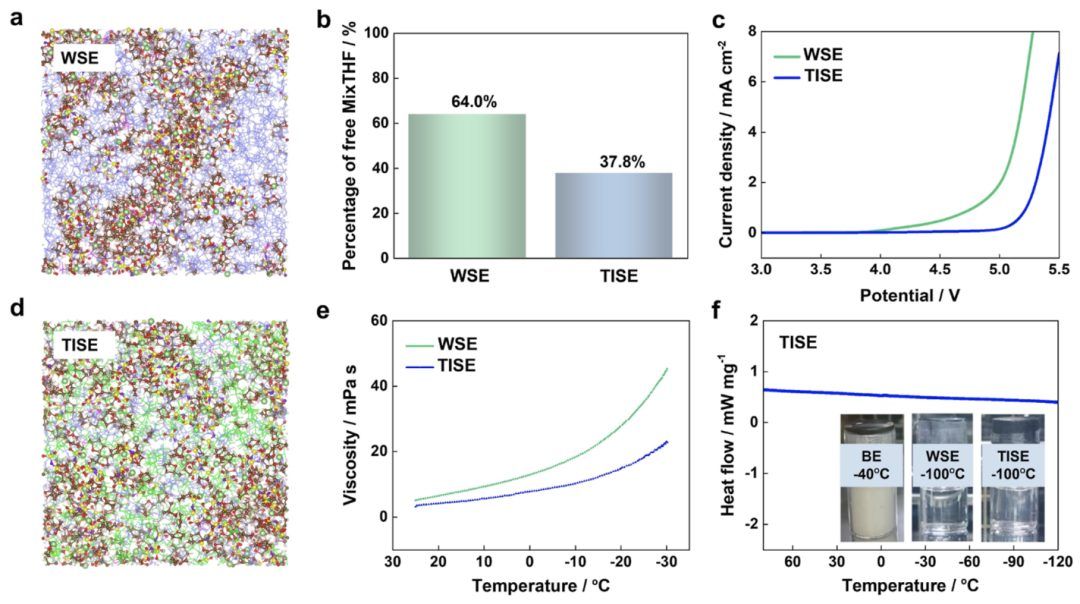 图2.电解质的物理性质
图2.电解质的物理性质
通过拉曼光谱表征电解质的溶剂化结构。当TTE用作共溶剂时,Li+-FSI−配位对应的峰位移到更高波数,这表征了700-780 cm−1范围内FSI−振动的S−N−S弯曲模式(图1f)。图1f还显示了SSIPs/CIPs/AGGs的分类和比例。与含有强供体溶剂且仅有SSIP的电解质相比,不含TTE的1.5 M LiFSI/MixTHF(弱溶剂电解质,WSE)显示出更高比例的CIPs(42%)和AGGs(38%),而SSIP的比例保持在21%。使用1.5 M LiFSI/MixTHF-TTE(温度不敏感溶剂化电解质,TISE)时,Li+-阴离子结合显著增加,AGGs占主导地位,达到66%,而SSIP的存在很少(图1a,f)。图1g显示了SSIP、CIP和AGG的代表结构。TISE的7Li NMR光谱相对于WSE的下场位移进一步证明了Li+与溶剂的弱相互作用(图S9)。
图2a,d显示了分子动力学模拟中WSE和TISE的快照。Li+及其第一个配位结构(Li+的3.0 Å内)通过球棍模型表示,而自由MixTHF溶剂(蓝色)、自由FSI−(红色)和自由TTE共溶剂(绿色)分别用线框表示。TTE共溶剂的最高占分子轨道(HOMO)能级低于MixTHF,并且不直接与Li+配位的自由MixTHF溶剂的数量随着TTE共溶剂的加入而减少,这有助于提高电解质的抗氧化性(图2b和S2)。在铂上的线性扫描伏安法(LSV)测试证实了TISE相对于WSE的氧化窗口延伸(图2c)。TTE共溶剂减少了MixTHF分子之间的相互作用,使TISE在低温下的粘度增加较少(图2e)。差示扫描量热法(DSC)测试和长时间静置评估(图2f)表明,特制的TISE在低于-100°C的液态下保持液态,无吸热峰或盐析出。根据长时间静置评估,WSE在低于-100°C时也保持液态。相比之下,常规碳酸盐电解质(1 M LiPF6/EC-DMC,BE)在-40°C时固化。
此外,EC(160°C)、DMC(18°C)、THF(−17°C)和2MeTHF(−11°C)的闪点使低浓度电解质的BE和WSE均具有可燃性,如阻燃测试结果所示(图S10)。而3.0 M LiFSI/MixTHF(高浓度电解质,HCE)由于自由溶剂的有限量显著减少了电解质的可燃性,使其在点燃10秒后仅存在微弱火焰。TISE一方面减少了自由溶剂的数量,另一方面含有不燃的TTE,因此更具阻燃性,并且在点燃10秒后能够自熄。使用自动蒸气压测试仪在室温下测试了不同电解质的蒸气压。WSE的蒸气压为0.2 kPa。增加盐浓度后,HCE的蒸气压降至0.01 kPa,而TISE的蒸气压降至0.008 kPa,接近商业电解质BE的蒸气压。
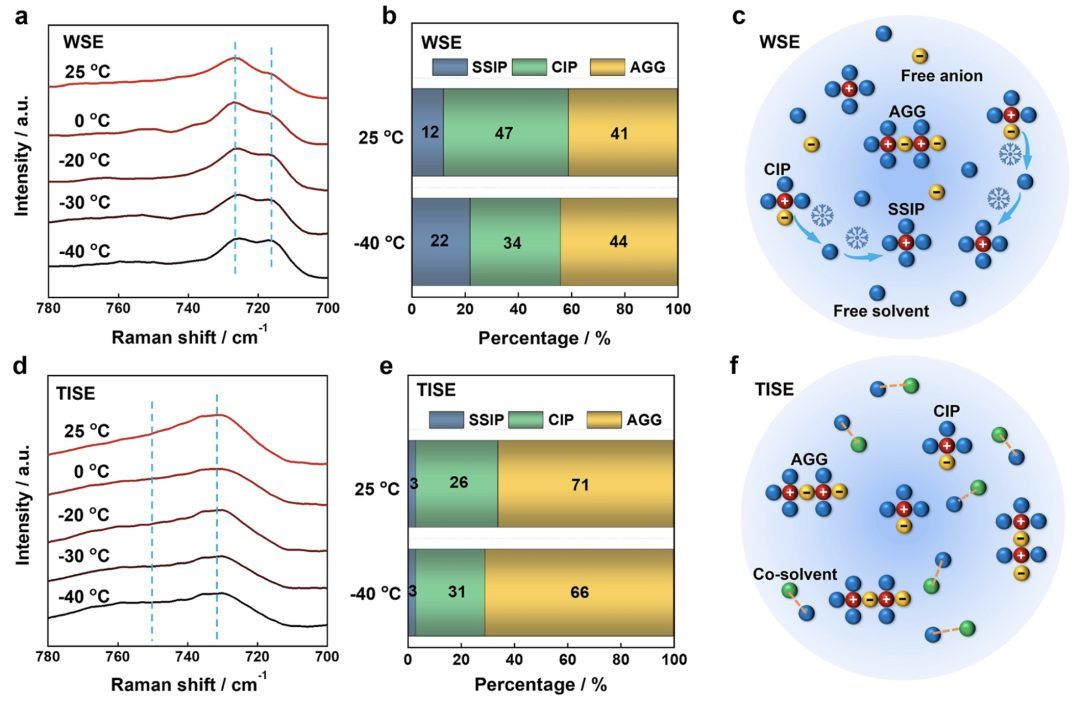 图3.溶剂化结构演变行为。
图3.溶剂化结构演变行为。
温度依赖溶剂化演变行为。研究温度依赖溶剂化结构的动态演变对于低温电解质的设计是必要的,但在过去很少受到关注。为了研究电解质在不同温度下的溶剂化演变及非溶剂共溶剂对溶剂化演变的影响,进行了变温拉曼光谱测试(图3a,d)。分析700-780 cm−1范围内FSI−振动的S−N−S弯曲模式以研究溶剂化结构。随着温度下降,WSE的SSIP峰在710-720 cm−1显著增加。这表明由于Li+−溶剂相互作用逐渐增加,低温下发生了溶剂化转变。相反,TISE的溶剂化对温度不敏感,这是因为TTE共溶剂与MixTHF之间存在分子间相互作用,如变温1H NMR光谱所示(图S11)。MixTHF与TTE的分子间相互作用可以减少MixTHF中氧的电子云密度,防止MixTHF与Li+重新结合形成SSIP。
在不同温度下进行了分子动力学模拟以进一步阐明电解质的溶剂化结构。使用径向分布函数(g(r),实线)和配位数(n(r),虚线)(图S12)模拟了电解质的溶剂化结构。FSI−和MixTHF分子主导了Li+的第一个溶剂化壳(Li+的3 Å内)。相反,TTE分子的原子远离第一个溶剂化壳,这意味着TTE分子未直接与Li+配位。TTE作为共溶剂的加入增加了FSI−的配位数,而THF和2MeTHF分子的配位数减少,这与光谱特性一致。根据分子动力学模拟获得了不同温度下WSE和TISE的SSIPs/CIPs/AGGs的比例(图3b,e)。这验证了CIP主导的WSE的不稳定溶剂化结构在温度下降时部分转变为SSIP,这与变温拉曼光谱的结果一致。图3c,f展示了温度下降过程中WSE和TISE溶剂化转变机制的示意图。在WSE电解质冷却过程中,Li+−FSI−相互作用逐渐减弱,发生“CIPs→SSIPs”溶剂化演变。相反,TISE的溶剂化主要涉及AGG,表现出可忽略的温度依赖性。
对于HCE,分子动力学模拟显示部分溶剂化结构仍随温度变化(图S13)。也可以从拉曼结果看出,随着温度的下降,SSIP峰略有增强。BE的溶剂化结构演变也被用作对比。分子动力学模拟表明,PF6−几乎不参与第一个Li+溶剂化壳(Li+的3 Å内)(图S14)。在25和−40°C下,溶剂化结构的SSIP约为90%,CIP约为10%,AGG可以忽略。变温拉曼光谱进一步证明了溶剂化结构的稳定性,因为随着温度的下降,溶剂和阴离子的峰基本没有移动(图S15)。Li+与碳酸盐溶剂之间的强相互作用导致BE的溶剂化结构随着温度下降基本不变。
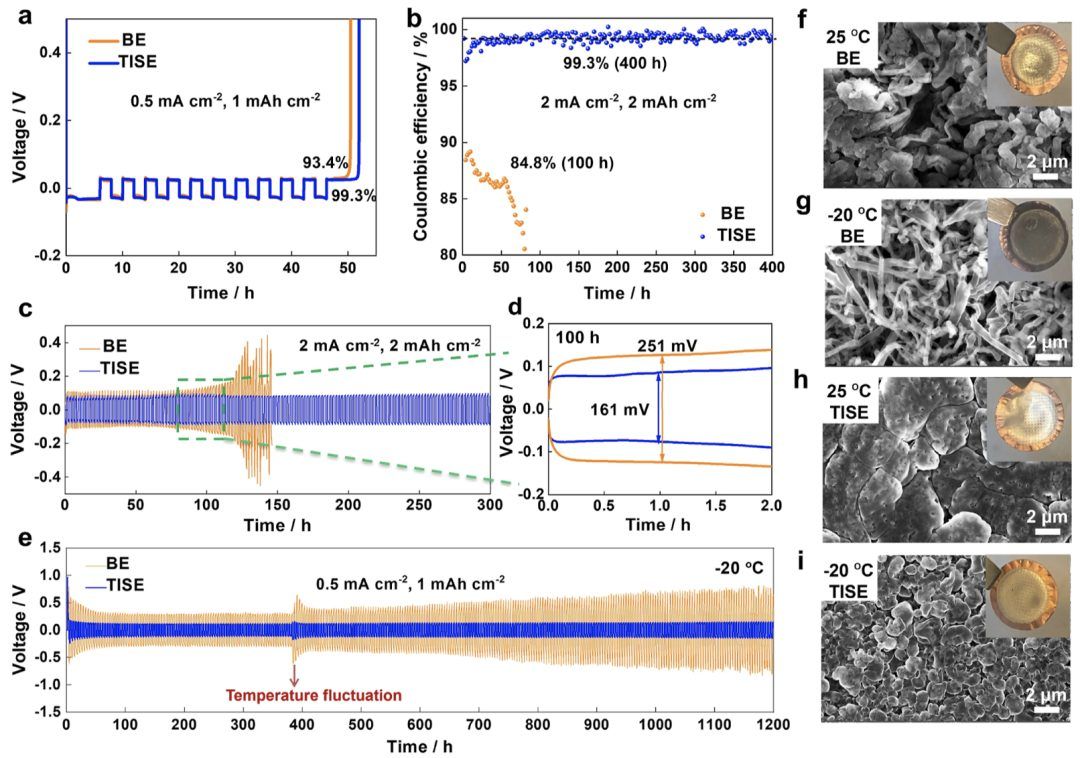 图4.锂金属阳极的电化学性能。
图4.锂金属阳极的电化学性能。
低温下锂金属阳极的电化学性能。电解质的溶剂化结构对于锂阳极的性能至关重要,特别是在低温下。BE、WSE、HCE和TISE在0.5 mA cm−2和1 mAh cm−2条件下进行10次循环测试的锂沉积/剥离曲线和平均库仑效率(图4a和S16)。结果显示,WSE(97.8%)和HCE(98.6%)的库仑效率均低于99%。TISE的库仑效率高达99.3%,比BE(93.4%)高出近6%。此外,还比较了1.5 M LiFSI/THF-TTE和1.5 M LiFSI/2MeTHF-TTE的锂库仑效率(图S17)。基于THF的TISE由于其高导电性(99.1%)和基于2MeTHF的电解液的高界面稳定性(99.2%),具有最高的库仑效率。TISE电池在2 mA cm−2和2 mAh cm−2条件下400小时内也实现了99.3%的库仑效率,并在0.5 mA cm−2和1 mAh cm−2条件下没有预沉积锂的情况下保持了1300小时的稳定循环(图S18)。
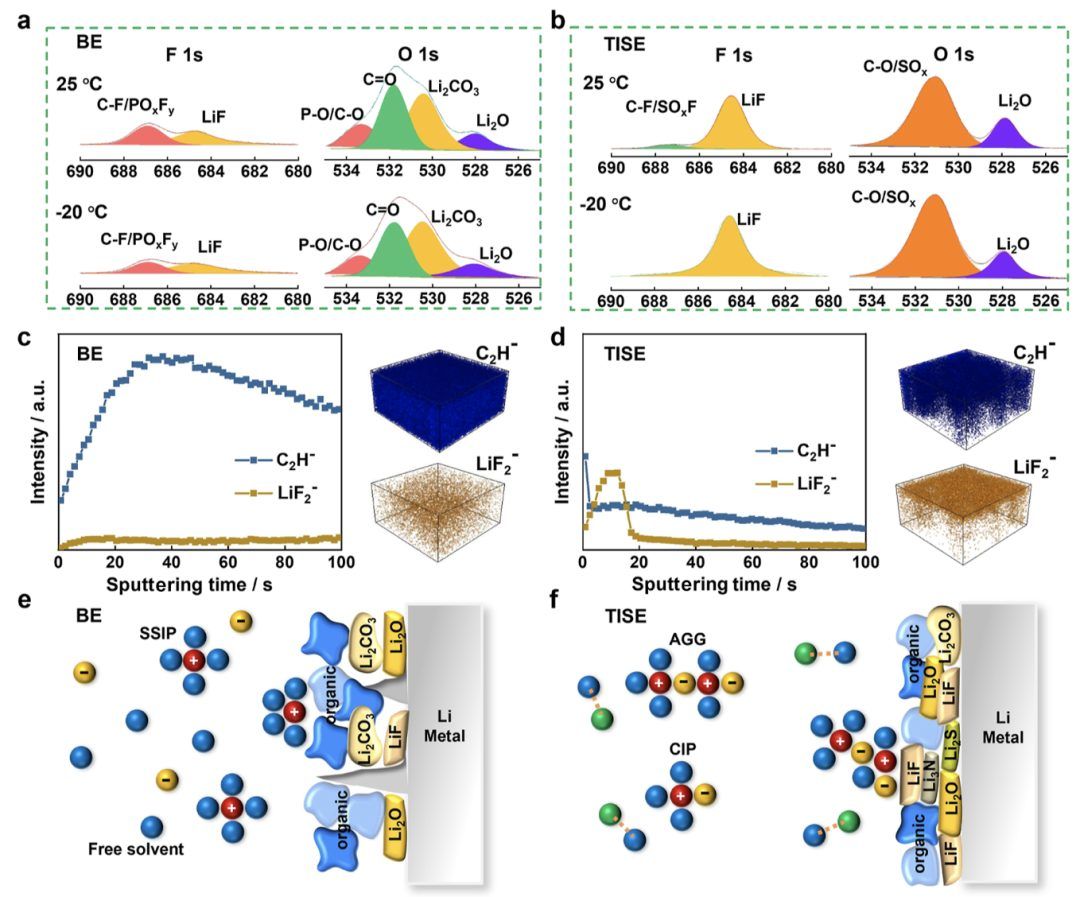 图5.锂金属阳极界面表征。
图5.锂金属阳极界面表征。
通过飞行时间二次离子质谱(TOF-SIMS)进一步确认了SEI的微观结构和组成。从深度剖面和相应的三维分布(图5c,d)来看,BE中的SEI含有大量的有机片段C2H−,但无机片段LiF2−较少。TISE中衍生的界面层为超薄,具有无定形外层和富含LiF的内层。富含无机物的内层可以形成丰富的相界和空位,从而促进Li+扩散,因为其扩散能垒较低且表面能较高。这可以有效提高SEI层的机械强度,从而抑制锂枝晶的生长。SEI的成分强烈依赖于电解质的溶剂化结构。TISE中主导的Li+-FSI−结合结构具有较高的还原电位并含有更多的阴离子,有利于TISE中无机LiF增强SEI的形成。此外,THF和2MeTHF溶剂的较高LUMO表明其在热力学上不利于还原。图5e,f显示了BE和TISE中锂金属界面的示意图。
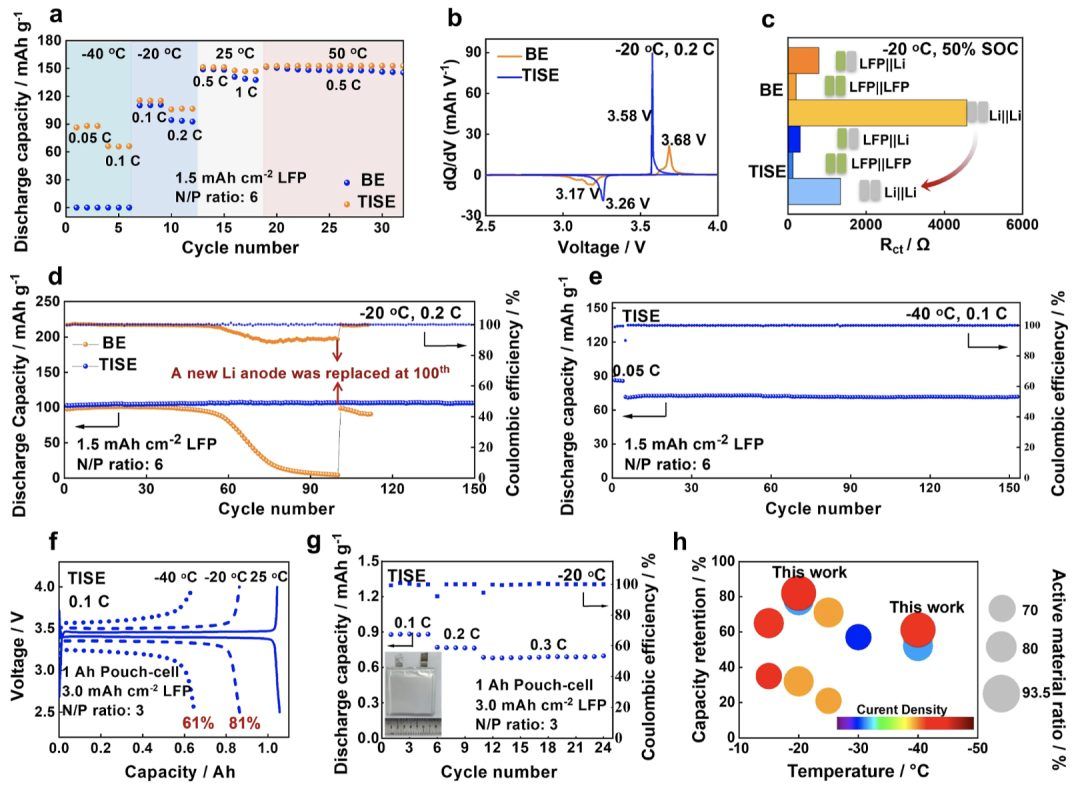 图6.低温下的限制因素和锂金属电池的电化学性能。
图6.低温下的限制因素和锂金属电池的电化学性能。
(31−37)根据文献32的再现。版权[2022] Wiley;根据文献33的再现。版权[2021] American Chemical Society;根据文献34的再现。版权[2022] Wiley;根据文献35的再现。版权[2021] American Chemical Society;根据文献37的再现。版权[2023] Wiley。
实际低温锂金属电池的性能。在−40到50°C温度范围内测试了BE和TISE的LFP(1.5 mAh cm−2)||Li(50 μm)电池的充放电容量和循环性能(图6a)。BE的电池在−40°C无法操作,因为达到了电解质的冰点,而TISE的电池在−40到50°C下正常工作,并且在低温下比BE具有更高的倍率容量。
具体来说,低温锂金属电池在低温下受其倍率容量和短寿命的限制。一方面,LFP||Li电池在0.2 C和−20°C下的电压曲线研究表明,限制低温容量的主要原因是电池的电化学极化。TISE显著减少了极化,并在低温下增加了容量(图S31)。从dQ/dV曲线可以明显看出,TISE在−20°C下可以将充放电电位降低0.2 V(图6b)。测试了电化学阻抗以找出对电池低温极化影响最大的因素(图6c)。比较了在50%充电状态(SOC)和−20°C下LFP||Li电池、LFP||LFP对称电池和Li||Li对称电池的电荷转移电阻。发现Li||Li对称电池显示了最高的电荷转移电阻,包括阴极和阳极界面处的脱溶过程。LFP具有较小的对称阻抗,而Li||Li具有较高的阻抗。因此,锂金属SEI中的离子传输主要是限制电池低温容量的关键因素。
另一方面,当电池在−20°C下使用BE进行循环时,容量显著衰减。然而,当电池中的锂金属阳极更换为新的时,电池容量可以恢复(图6d)。因此,低温锂金属电池的短循环寿命主要是由于锂金属阳极的副反应。图6d显示了−20°C下电池的循环性能。使用TISE的电池在0.2和−20°C下超过150次循环没有明显的容量衰减,平均库仑效率超过99.97%。相比之下,使用BE的电池在−20°C下不到100次循环内容量降至0 mAh g−1。图S31显示了0.2 C和−20°C下BE和TISE的电压曲线。此外,TISE的电池在0.1 C和−40°C下超过150次循环没有明显的容量衰减(图6e)。
上述全电池测试证明了TISE的出色低温循环性能。为了进一步探索TISE在实际应用中的潜力,配备50 μm Li(N/P比为3)的高负载(3 mAh cm−2)LFP阴极(图S32)。高负载全电池在室温下0.5 C下经过150次循环后,TISE实现了99.73%的优异容量保持率和99.82%的平均库仑效率。1.06 Ah袋式电池在0.1 C和−20°C下实现了0.86 Ah(室温容量的81%),在0.1 C和−40°C下实现了0.65 Ah(室温容量的61%)(图6f,表S4)。在−20°C下测试袋式电池在0.1、0.2和0.3 C下的倍率能力和循环性能。电池在0.2 C下显示了0.76 Ah,在0.3 C下显示了0.69 Ah,并在−20°C下具有稳定的循环性能(图6g)。与文献相比,我们设计的电解质在低温下的倍率容量保持率、锂沉积/剥离库仑效率和高活性材料比率和高负载LFP的循环性能方面具有优势(图6h和表S5)。
总结展望
这项研究开发了一种温度不敏感溶剂化电解质,以增强实际条件下低温锂金属电池的性能。其证明了非溶剂共溶剂与醚基溶剂之间的分子间相互作用可以减弱供体醚氧的电负性,并在温度下降过程中获得温度不敏感的阴离子聚集溶剂化。这种策略有助于在低温下实现锂金属阳极的快速和稳定的界面传输。具有所提议电解质的高负载LFP||50 μm Li电池在室温、−20°C和−40°C下经过150次循环后表现出高可逆的循环性能。此外,实际1Ah级别的LFP||Li袋式电池在室温下进行充放电时,在−20°C和−40°C下分别实现了81%和61%的容量。这项工作展示了一种设计低温电池电解质的新策略。
文献信息
Designing Temperature-Insensitive Solvated Electrolytes for Low-Temperature Lithium Metal Batteries,JACS,2024.
DOI: https://pubs.acs.org/doi/10.1021/jacs.4c01735.




























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








