在当今生命科学的研究领域中,非编码RNA(ncRNAs)尤其是MicroRNA(miRNA)的研究正日益成为热点。这些小分子RNA以其独特的方式参与调控基因表达,影响着从细胞分化到疾病发生的一系列生物学过程。miRNA的发现不仅为我们提供了一个全新的视角来理解细胞内的复杂调控网络,而且也开辟了疾病诊断和治疗的新途径。本期推文将带领大家来全方位认识MicroRNA(miRNA)。
01
小RNA的简介
从原核生物到真核生物,RNA在许多生物功能中发挥着重要且多样的作用,RNA中只有很少一部分是参与编码蛋白质的编码RNA(Coding RNA),剩下的大部分都是不参与编码蛋白质的非编码RNA(Non-coding RNA,ncRNAs)。在非编码RNA中,小于200个核苷酸(nt)的RNA被称为小非编码RNA(Small non-coding RNA,sncRNAs)。在多年的广泛研究中,根据小非编码RNA的大小和结构特征可以将其分类为:传统小RNA、结构小RNA和衍生小RNA(也称为非规范小RNA)[1],这些小RNA可以通过不同的机制参与各种生物过程,例如传统小RNA包括microRNA(miRNA)、piwi相互作用RNA(piRNA)和小干扰RNA(siRNA),他们可以与Argonaute蛋白(Ago蛋白)结合形成沉默复合体,进而切割或阻止靶向mRNA的翻译,或者介导染色质上表观遗传的改变,以达到沉默基因表达的目的[2];结构小RNA包括tRNA、rRNA、snoRNA、snRNA、yRNA和vtRNA,它们是细胞内调节生理稳态的重要成分;衍生小RNA是由古老的RNase酶裂解后产生的,不依赖Argonaute蛋白发挥功能,或者功能尚不明确的小RNA[3, 4]。
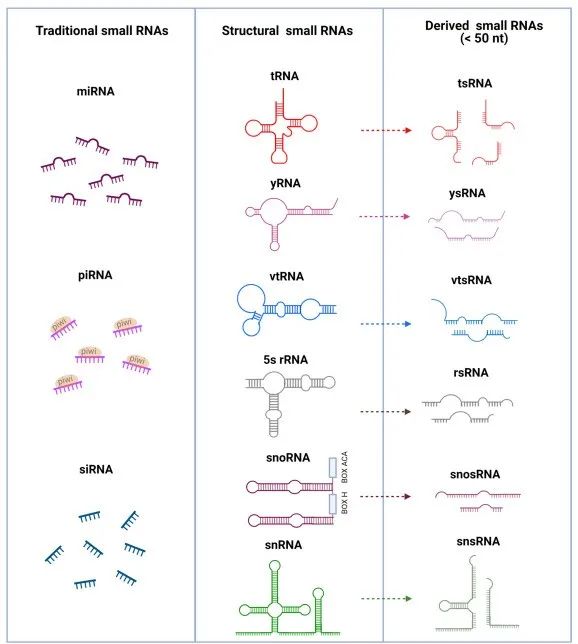
图 1 小非编码RNA的分类和结构[4]
02
MicroRNA简介
三十多年前,在好奇心的驱动下,研究人员在对秀丽线虫发育的研究过程中第一次发现了microRNAs的存在[5],此后,关于microRNA的研究越来越多涌现出来。成熟的microRNA是由内源基因编码的,长度约为21或23个核苷酸(nt)的短的RNA单链分子。RNA聚合酶II转录出包含茎环结构的初级转录本(pri-miRNAs),少数pri-miRNAs是由RNA聚合酶III转录的,pri-miRNAs在细胞核内被Ⅲ型核酸内切酶Drosha和辅助因子DGCR8蛋白识别,并在距离pri-miRNA茎环结构分界点约11个碱基处被剪切,形成miRNA前体(pre-miRNAs),pre-miRNAs通过核孔到细胞质后,在多种蛋白和Ⅲ型核酸内切酶Dicer的作用下形成miRNA双链,miRNA双链与包括Argonaute蛋白的蛋白质复合体结合,形成靶向mRNA的沉默复合体RISC(RNA induced silencing complex),又称为miRNP(micro ribo nucleo protein)。miRNA双链中5′-端碱基配对稳定性较差的链被保留,形成成熟的miRNA,另一条链则会被迅速降解[6-8]。
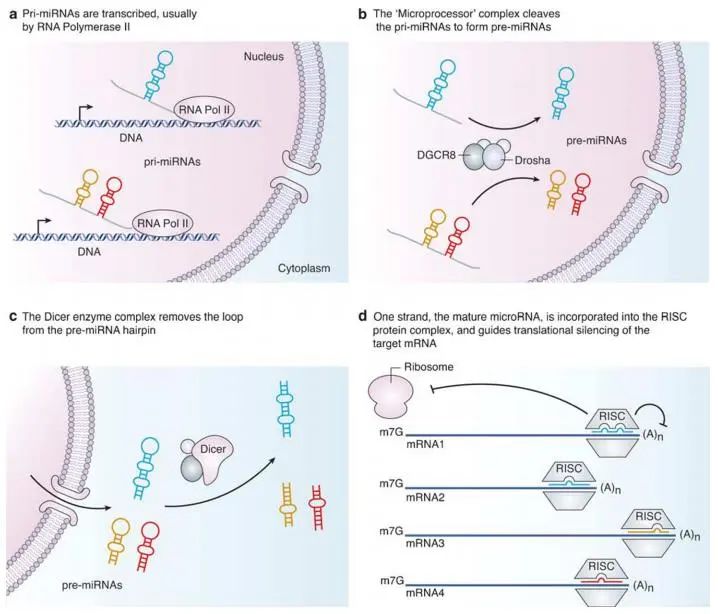
图 2 miRNA形成过程[6]
随着对microRNA的研究越来越多,在植物、动物和病毒中已经发现超过20000个miRNA分子,microRNA介导的基因调控可能在细胞分化、对环境的适应性、人类发育、造血过程、器官形成、细胞增殖和凋亡、脂肪代谢、肿瘤发生以及宿主细胞与病原体的相互作用中发挥关键作用。前文提到miRISC可以沉默靶向mRNA的表达,靶向mRNA 3′端的UTR序列,mRNA 3′端的UTR序列可以作为miRNA调控元件(miRNA Regulatory Element,MRE),与miRNA 5′端7个碱基的种子序列(Seed Sequence)相互作用,进行靶向识别[9],miRISC抑制效果由mRNA与miRNA之间的紧密结合程度决定:高度配对的miRNA-mRNA,如大部分植物内的miRNA,可以导致靶向mRNA切割和降解,靶向mRNA断裂后,无poly(A)序列的3′端加上多个U后很快降解,含poly(A)的序列能稳定存在一段时间;而在动物中大部分miRNA-mRNA不能高度结合,它们可以通过翻译抑制过程发挥作用,并且这一过程并不影响mRNA的稳定性[10]。
03
MicroRNA研究策略
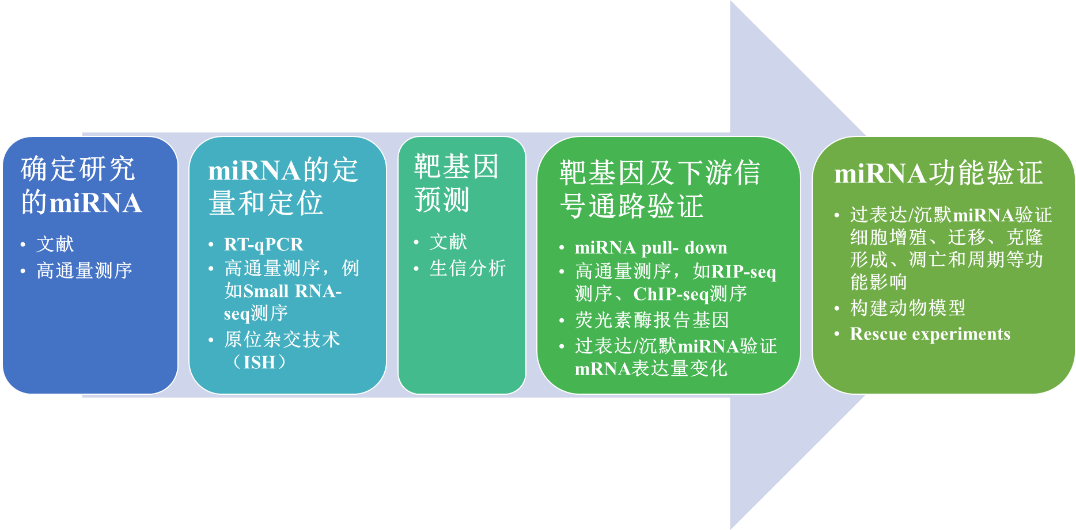
图 3 MicroRNA研究策略
3.1
MicroRNA提取
MicroRNA主要存在于细胞、组织和体液(如血清、血浆、泪液或尿液)中,早期文章中miRNA提取使用的是传统的Trizol裂解、苯酚-氯仿抽提和RNA沉淀的方法(图 4A),但是这种方法提取的miRNA中通常会有较多的污染物,并且由于短链核酸的沉淀效率比长链核酸低,在苯酚-氯仿抽提过程中,GC含量较低的miRNAs可能会发生丢失。后来很多文章中在提取miRNA时使用吸附柱法来避免出现这些问题(图 4B)[11]。
(A)
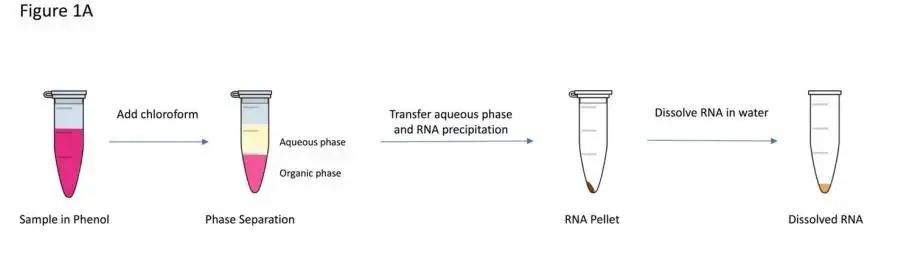
(B)
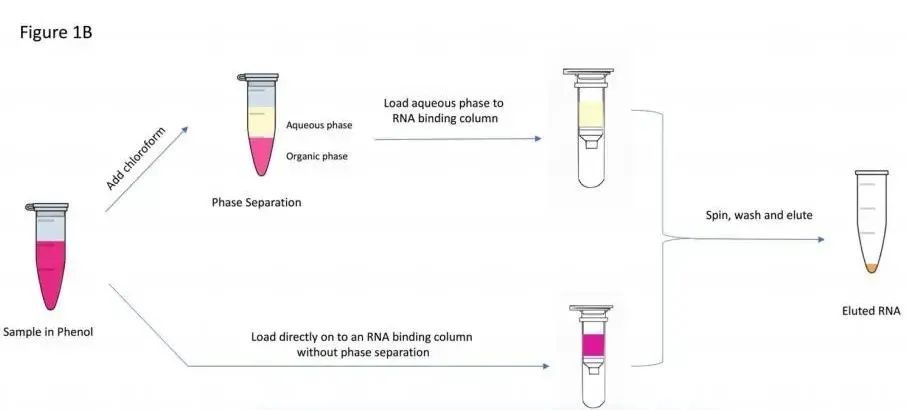
图 4 miRNA提取方法[11]
3.2
MicroRNA的RT-qPCR
我们可以通过RT-qPCR方法检测不同样本或者不同处理下miRNA的表达量,miRNA的长度通常只有21到23个碱基对,传统的荧光定量法并不适用于检测miRNA,因此大多数文章主要通过以下三种方法实现miRNA的RT-qPCR:
-
3.2.1 Loop反转录法
在逆转录过程中可以利用茎环结构设计引物,以达到延长miRNA长度的目的,茎环引物是长度约为45 bp且能够实现自身环化的序列,每一个miRNA都有自己独特的茎环引物,设计的茎环引物结构为:5′端的环化序列+ 3′端的miRNA的特定互补序列,它可以与miRNA序列结合起到延长miRNA的作用(图 5)。
实验步骤:设计茎环引物→逆转录→荧光定量qPCR
优点:特异引物逆转录,理论上效率更高,检测更灵敏;
缺点:茎环引物设计比较复杂,且特异性引物不能进行多基因同时逆转录;
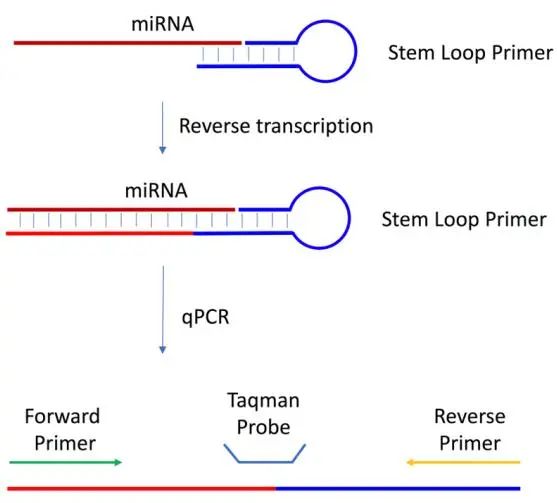
图 5 Loop反转录法[11]
-
3.2.2 poly(A)加尾法
通过在miRNA 3′端添加poly(A)尾,然后用3′端带有标签的poly(T)引物进行通用的逆转录(图 6)。
实验步骤:3′端加poly(A)尾→逆转录→荧光定量qPCR
优点:通用性高,一次逆转录获得的cDNA可用于多个目标分子的检测,经济,方便;
缺点:特异性较差;
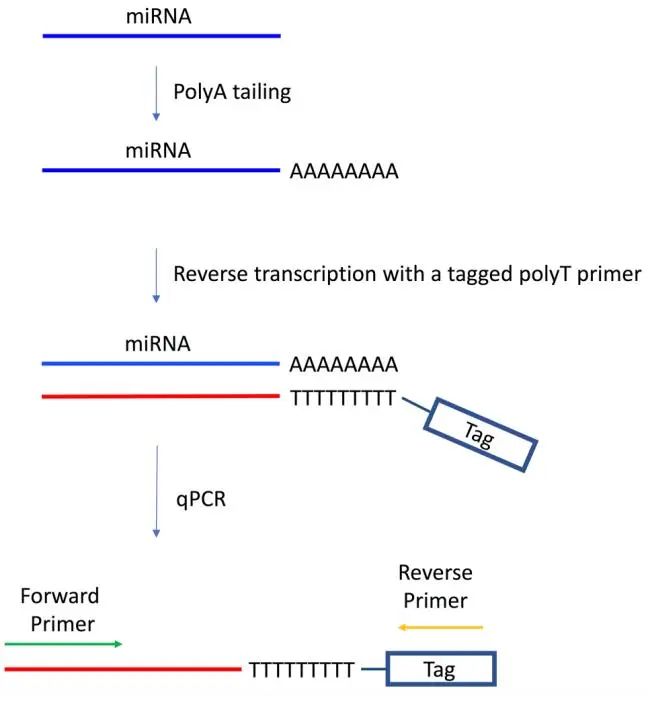
图 6 poly(A)加尾法[11]
-
3.2.2 通用逆转录法
另外少数文章中还提到了第三种RT-qPCR检测miRNA的方法—通用逆转录法:在miRNA的3′末端添加Poly(A)尾和接头,然后用3′端带有标签的poly(T)引物进行逆转录,使用通用引物扩增(可选步骤),最后添加miRNA特异性探针、miRNA特异性正向引物和通用反向引物进行qPCR。
实验步骤:3′端加poly(A)尾、加接头→逆转录→通用引物扩增(可选步骤)→加特异性探针、特异性正向引物和通用反向引物进行荧光定量qPCR
优点:特异性较好,但没有Loop反转录法特异性好;
缺点:方法尚不普及,实验条件还需摸索;
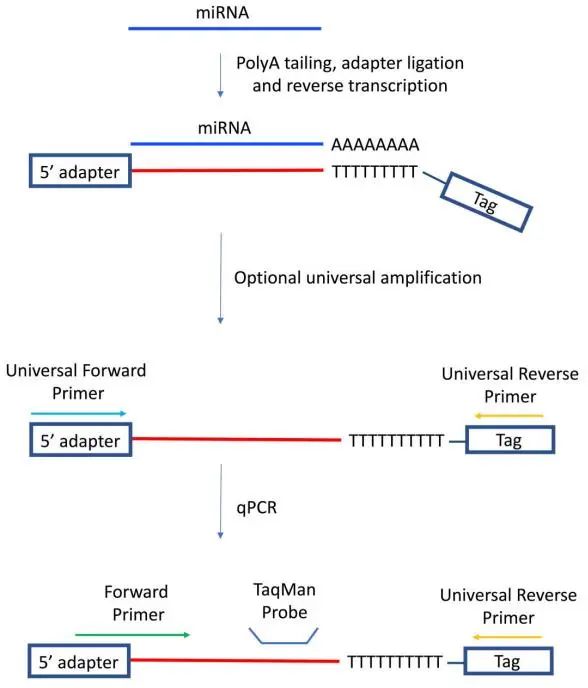
图 7 通用逆转录法[11]
3.3
MicroRNA验证方法
前文提到mRNA 3′端的UTR序列可以作为miRNA调控元件,与miRNA 5′端7个碱基的种子序列相互作用,进行靶向识别,使miRNA达到干扰或抑制翻译的目的。针对micro RNA的验证,可以分为靶基因验证、下游信号通路验证以及功能验证(即表型验证),接下来,我们将介绍两种常用的下游基因验证方法。
-
3.3.1 荧光素酶报告基因法:
将待确认的目的基因插入到荧光素酶报告基因载体上,再将载体转染到细胞中,用人工合成miRNA或miRNA抑制剂处理细胞后,如果目的基因上含有miRNA靶位点,则荧光素酶的转录翻译过程受到抑制而不发荧光。
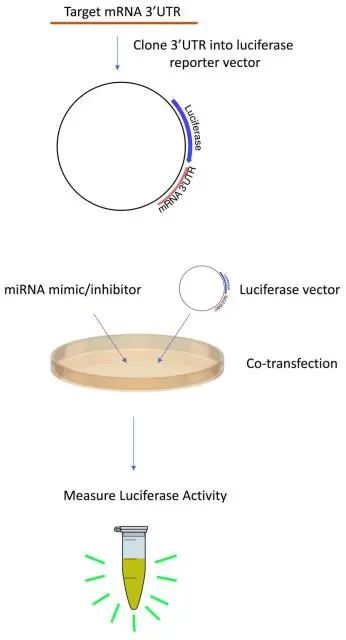
图 8 荧光素酶报告基因法[11]
-
3.3.1 RIP-seq
利用miRNA双链与包括Argonaute蛋白(Ago蛋白)的蛋白质复合体结合,形成靶向mRNA的沉默复合体RISC,将蛋白质和RNA交联后,孵育后裂解细胞,使用特异性的抗Ago抗体对RISC进行免疫共沉淀,将蛋白复合体消化并连接接头后,可以进行反转录,扩增和高通量测序。
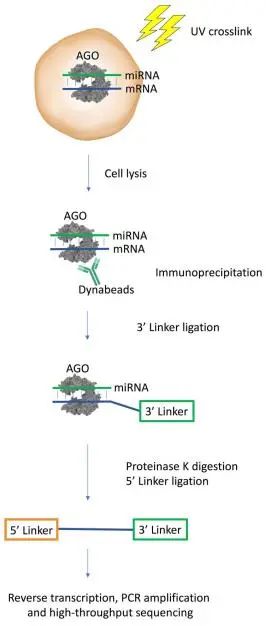
图 9 RIP-seq法[11]
04
总 结
本文对miRNA的分类、生物合成、功能机制以及研究策略进行了全面介绍。随着高通量测序和生物信息学工具的发展,我们对miRNA的认识愈发深入,这为揭示它们在复杂生物系统中的网络调控作用提供了新的视角。未来,miRNA的研究将继续拓展我们对生命现象的理解。我们期待这些研究成果能够转化为实际应用,为人类社会带来更多的科学突破和实际利益。
05
产品推广
最后,MicroRNA的研究里我们可以提供哪些服务呢?
1. MicroRNA的整体水平检测:全转录组测序,small RNA-seq测序;
2. MicroRNA的单基因定量检测:MiRNA RT-qPCR(loop反转录法和polyA加尾法均可提供);
3. 靶基因及下游信号通路验证:荧光素酶报告基因,RIP-seq。
-
参考文献:
[1] XIONG Q, ZHANG Y, LI J, et al. Small Non-Coding RNAs in Human Cancer [J]. Genes, 2022, 13(11):
[2] JIN S, ZHAN J, ZHOU Y. Argonaute proteins: structures and their endonuclease activity [J]. Molecular biology reports, 2021, 48(5): 4837-49.
[3] SHI J, ZHOU T, CHEN Q. Exploring the expanding universe of small RNAs [J]. Nature Cell Biology, 2022, 24(4): 415-23.
[4] XIONG Q, ZHANG Y. Small RNA modifications: regulatory molecules and potential applications [J]. Journal of Hematology & Oncology, 2023, 16(1):
[5] WANG P, ZHOU Y, RICHARDS A M. Effective tools for RNA-derived therapeutics: siRNA interference or miRNA mimicry [J]. Theranostics, 2021, 11(18): 8771-96.
[6] BOYD S D. Everything you wanted to know about small RNA but were afraid to ask [J]. Laboratory Investigation, 2008, 88(6): 569-78.
[7] BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function [J]. Cell, 2004, 116(2): 281-97.
[8] 赵雅, 生命科学 吴 J. 基因表达调控多面手——microRNA和siRNA的作用机制 [J]. 2010, 22(7): 6.
[9] LEWIS B P, BURGE C B, BARTEL D P. Conserved Seed Pairing, Often Flanked by Adenosines, Indicates that Thousands of Human Genes are MicroRNA Targets [J]. Cell, 2005, 120(1): 15-20.
[10] 赵爽, 中国科学:C辑 刘 J. MicroRNA作用机制研究的新进展 [J]. 2009, 1): 5.
[11] LU T X, ROTHENBERG M E. MicroRNA [J]. Journal of Allergy and Clinical Immunology, 2018, 141(4): 1202-7.
























 1万+
1万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








