
研究背景
半稳定性是均相催化中的一个重要概念,其中反应物活化和产物形成可以通过金属配体配位球的可逆打开和关闭同时进行。然而,这种效应在多相催化中很少报道。
在此,复旦大学徐昕等人通过对取代Cu1/CeO2单原子催化剂上的CO氧化反应进行理论研究,表明金属-载体配位的动态演变可以显著改变活性中心的电子结构。计算方法本文中所有的周期密度泛函理论(DFT)计算都是基于维也纳从头算模拟包(VASP),并采用投影增强波(PAW)方法对核心电子进行了描述。作者将价电子的平面波基组的动能截断设置为400 eV,以及采用2 × 2.× 1的表面Monkhorst–Pack k点网格对布里渊区进行采样。
在结构优化过程中,作者将收敛标准设置为每个原子上的最大剩余力小于0.02 eV /Å。在CI-NEB计算中, 作者将力收敛标准设置为0.03 eV /Å。作者对Ce 4f轨道、Cu 3d轨道和Ti 3d轨道分别添加了5.0 eV,5.0 eV和3.3 eV的U值 。此外,对于表面反应,作者通过使用DFT+ D3方法来描述色散相互作用。
结果与讨论
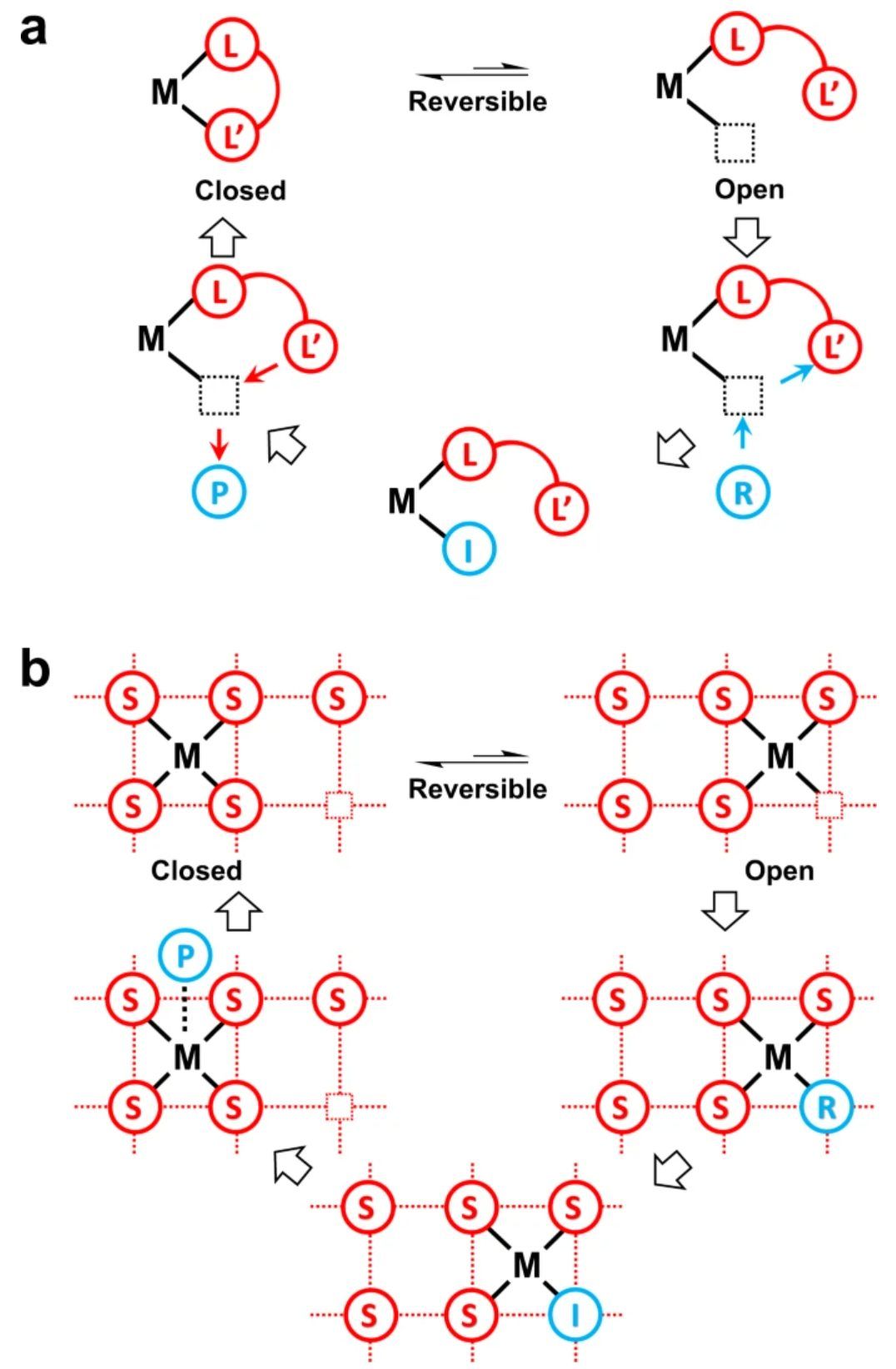
图1 半稳定性示意图
如图1a所示,半稳定性的特征是配位位点的可逆打开和关闭。不稳定的金属配体配位处于“打开”状态时,其被金属反应物/中间体配位取代。而处于“关闭”状态时,取代金属产物处于配位状态。半稳定配体在均相催化中是调节催化剂反应活性的有效方法之一,其中开放状态有利于反应物活化,而封闭状态有利于产物消除。图1b说明了当吸附质在催化循环过程中从反应物变为中间体并最终变为产物时,沿着反应路径动态金属-载体配位的可能机制,其可以被视为多相催化中的半稳定性。
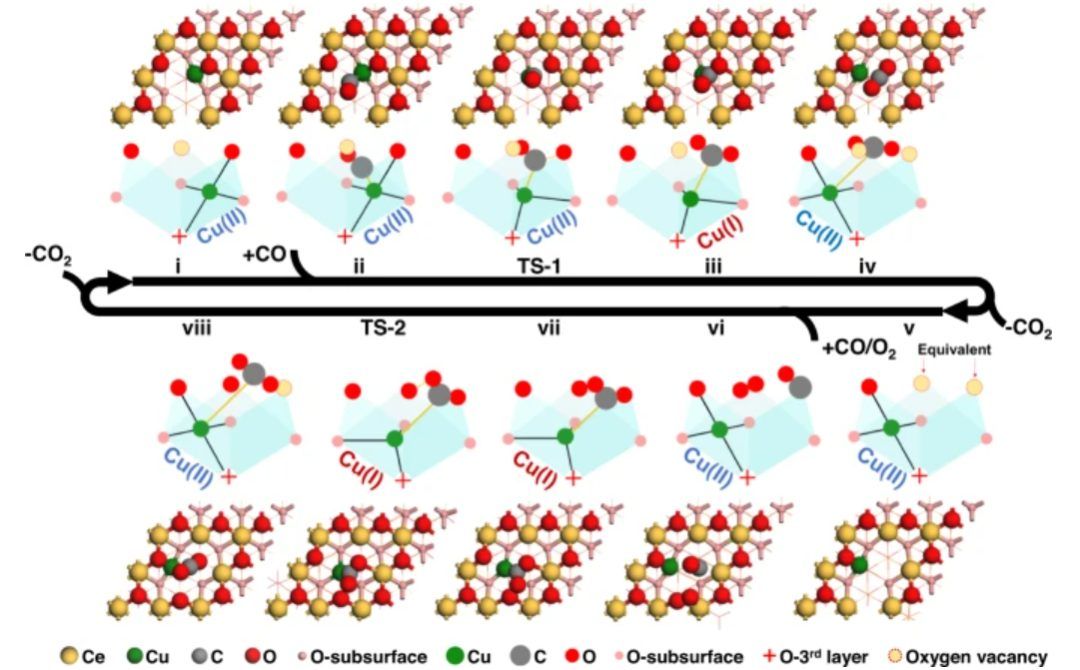
图2 Cu1/CeO2(111)在具有半稳定金属-载体配位的催化循环中的优化结构
图2总结了Cu1/CeO2(111)催化循环中中间体和过渡态的优化结构,在循环的前半部分(图中的i–iv),自发形成的VO上吸附的CO(即CO*)消耗了附近的晶格氧,从而产生了新的VO。在催化循环的后半部分(图2中的v–viii),发生缔合CO + O2途径,即CO和O2共同吸附,首先占据这两个VO位点,然后进行随后的CO氧化和晶格氧再生。
在CO2从状态viii解吸之后,催化循环完成并且催化剂再生。如图2所示,四个Cu-O配位位点中的一个被金属吸附质配位Cu-CO2*(状态iii)打开并移位,晶格O在越过TS-1后被消耗以形成弯曲的CO2*。在状态iv中,金属载体配位位点因Cu迁移到另一个等效正方形并与四个晶格氧键合而闭合。
同时,金属吸附质配位被削弱,即在状态iii和TS-1中的活性弯曲CO2*在状态iv中转化为非活性线性CO2*。在催化循环的后半部分的状态vi中,CO和O2只能存在于两个相邻的VO位点上。活性OCOO*物种的形成是无障碍的,随着Cu-O载体配位位点的打开,自发形成Cu-C吸附质配位,如状态vii所示。
在越过TS-2形成第二个CO2之后,Cu-O的再配位(闭合)同时实现,进而实现晶格氧再生,如状态viii所示。为了更直观地观察动态金属-载体配位,作者还对OCOO*解离进行了从头算分子动力学(AIMD)模拟,即从状态vii开始,在状态vii中可以看到具有Cu-O载体配位位点开口结构被与OCOO*吸附质的Cu配位填充,而模拟在状态viii结束,在状态viii中可以看到Cu-O的再配位和OCOO*解离同时发生。
因此,与均相催化相比,Cu-O金属载体配位位点的可逆打开和关闭表明了SAC中多样的半稳定特性,这是在活性Cu离子迁移到附近位置和晶格氧的消耗/再生情况下实现的。
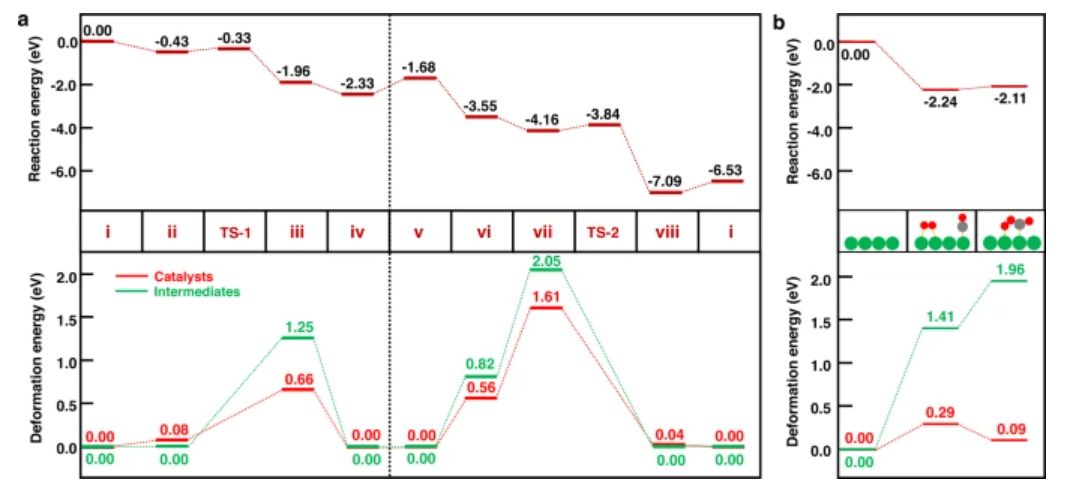
图3 每个状态的反应势能面
如图3a所示,在取代Cu1/CeO2(111)表面上的CO氧化很容易进行,其中最高势垒出现在OCOO*解离步骤(从状态vii到状态viii),能垒仅为0.32 eV。如图3a(底部)所示,对于金属载体配位位点打开的状态(状态iii和状态vii),吸附质(绿线)和催化剂(红线)的变形能都很大。因此,从图3a(底部)中可以看出,高活性中间体和催化剂通过强金属-中间体相互作用结合在一起,导致图3a(顶部)所示的平稳反应。与替代Cu1/CeO2催化剂相比,延伸Cu(111)表面的变形能要温和得多(图3b)。
尽管活性中间体的变形能也很高,但金属-金属配位对于相对高的变形能影响甚微。因此,最佳的静态催化剂,例如具有结构明确的活性中心的延伸金属表面,需要与不同的吸附质适度结合,以平衡Sabatier原理中的活化和解吸。考虑到SACs中金属-吸附质配位与金属-载体配位的动态性质,扩展的金属表面(或具有明确结构的纳米颗粒催化剂)和SAC之间的这种差异将为SAC的独特反应活性提供新的见解。在操作条件下重建金属催化剂也会产生活性位点,而局部环境可以通过从反应物到中间体和产物的吸附质动力学可逆地打开和关闭。
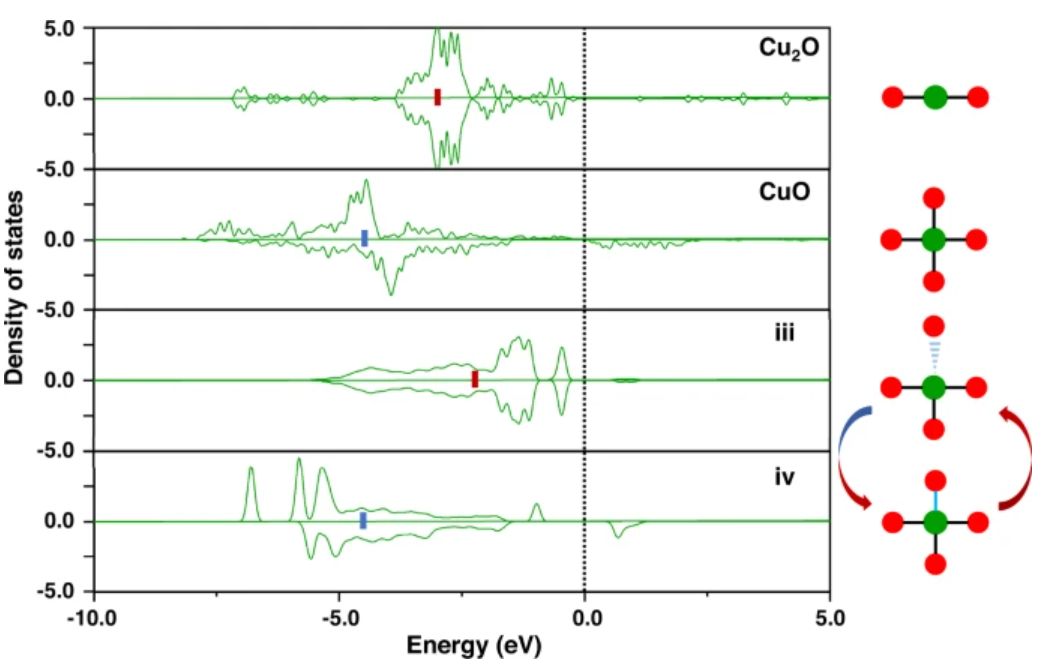
图4 不同金属-载体配位Cu的d-电子的态密度
如图4所示,与状态iv中的相比,状态iii中的Cu-d电子更接近费米能级,其具有更高的d带中心。当Cu-O配位的数量从三个(状态iii)增加到四个(状态iv)时,Cu-d带中心变得稳定,即远离费米能级。因此,动态金属-载体配位的打开和关闭可以显著地调整金属中心的d带中心,这对增强或削弱金属-吸附质结合做出了重要贡献。
作者还计算了Cu2O和CuO块中Cu的d带中心以进行比较(图4)。Cu2O体中的Cu(I)d电子是高能和自旋非极化的,这为状态iii提供了参考,而CuO体中的铜(II)d电子则是低能和自旋极化的,为状态iv提供了参考。Bader电荷分析还表明,金属-载体配位的变化导致金属电荷状态的变化,这对金属d带中心的变化至关重要。
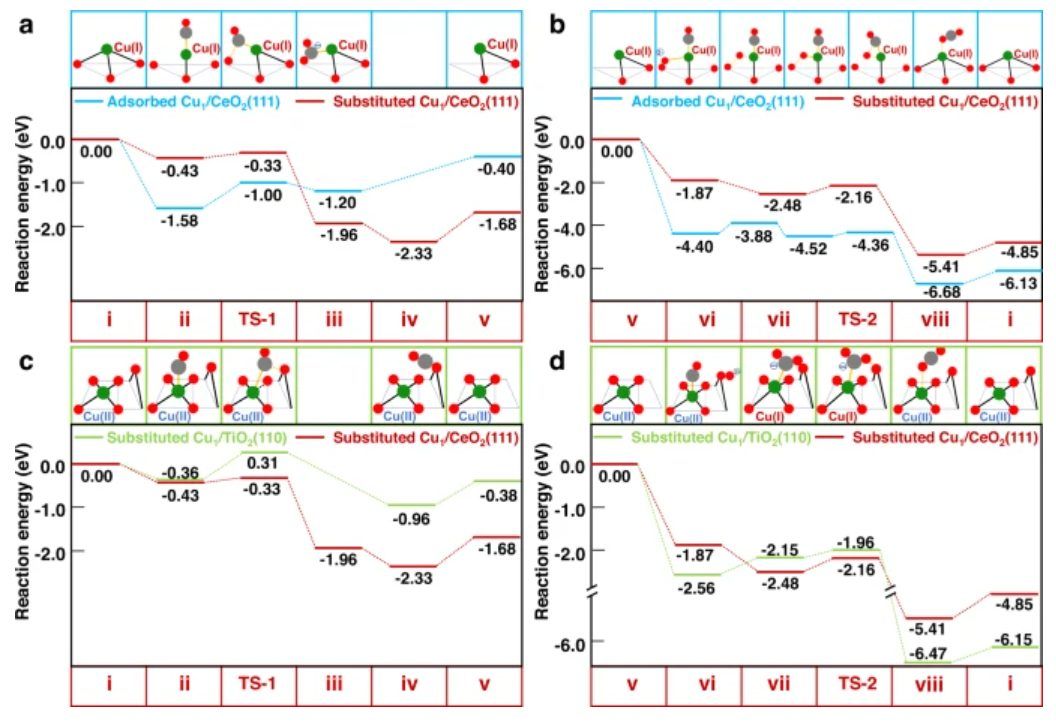
图5 CO在其他铜SAC上氧化的比较
如图5a所示,在吸附的Cu1/CeO2(111)中,金属-载体配位非常灵活,其可以很好地适应CO吸附。因此,CO强烈吸附在Cu1/CeO2(111)上(−1.58 eV),然后是CO氧化反应,并吸收0.38 eV的热量。 所形成的CO2也以0.80的解吸能与Cu(I)强结合,而这两个连续吸热步骤加起来具有相当高的能量成本(1.18 eV),并具有0.76 eV的有效势垒。
类似地,如图5b所示,CO和O2强烈结合吸附在Cu1/CeO2(111)上(−4.40 eV),它们不能耦合形成OCOO*,导致需要克服0.52eV势垒来进行O2离解,然后是0.16 eV的势垒用于形成CO2。结果表明,由于金属-载体配位过于灵活,它能与吸附质牢固结合,容易导致催化剂中毒。此外,作者研究了CO在取代Cu1/TiO2(110)催化剂上的氧化。
对于催化循环的前半部分,图5c中取代Cu1/TiO2(110)上的0.67 eV势垒比取代Cu1/CeO2(111)上的0.10 eV高得多。前者催化循环前半段的净反应能为-0.38 eV,而后者则低至-1.68eV, 这种差异是因为前者上最终消耗的晶格氧比后者上的晶格氧稳定得多。对于催化循环的后半部分,如图5d所示,尽管要再生更稳定的晶格氧,但在取代Cu1/TiO2(110)上被O2*氧化CO*的步骤必须克服0.60eV的势垒 ,而不是在取代Cu1/CeO2(111)上的0.32 eV。在取代Cu1/CeO2(111)上,打开Cu-O配位位点以促进OCOO*的形成,而这种机制对取代Cu1/TiO2(110)不起作用。
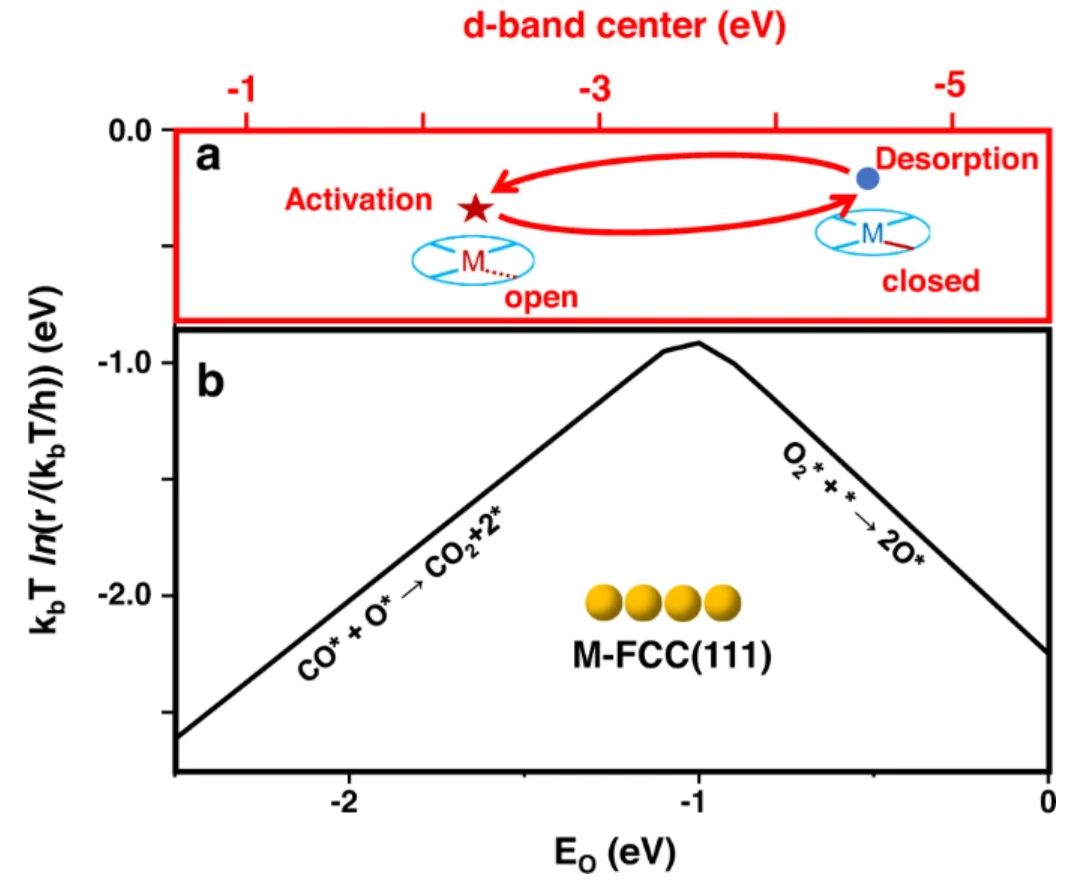
图6 两种催化CO氧化活性图谱的比较
如图6a所示,具有半稳定性的SAC可以将金属中心从一种状态可逆地切换到具有可行d带中心的另一种状态(图中的顶部水平轴6a,红星表示打开状态,蓝色圆圈表示关闭状态),因此,这可以促进反应物活化和产物解吸。图6b显示了在393.15 K下构建的紧密堆积的fcc(111)金属表面上催化CO氧化的火山图 。在恒定的CO结合能(ECO)下,只有平行于氧结合能,其在相应条件下可以穿过二维(EO和ECO)Sabatier火山顶部。显然,这种具有静态最优的Sabatier火山类型(图6b)不适用于具有半稳定性的SAC(图6a),即后者提供了一种沿反应途径的吸附结合以实现更高活性的方案。
结论与展望
活性中心的演变表明,当反应从反应物通过中间体进行到产物时,金属吸附质键合会增强或减弱,从而可以提高催化剂的活性。作者通过将半稳定效应扩展到单原子非均相催化剂来解释该观察结果,并引入这一概念来为活性位点动力学在催化中的重要作用提供新的见解,从而合理设计更复杂的单原子催化剂材料。
文献信息
Zheng Chen et.al Dynamic evolution of the active center driven by hemilabile coordination in Cu/CeO2 single-atom catalyst Nature Communication 2023



























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








