 成果简介
成果简介
全固态锂硫(Li-S)电池因其潜在的高能量密度、成本效益和安全操作而成为一种有前途的储能解决方案。深入理解固态硫的氧化还原反应对于推进全固态Li-S电池技术至关重要。特别是,固态硫的关键电化学反应与液态中有所不同,但对此方面的讨论迄今为止仍然缺乏。加拿大西安大略大学与宁波东方理工学院(暂名)孙学良,王长虹团队联合美国加利福尼亚大学洛杉矶分校李煜章团队通过探讨固态硫的底层氧化还原机制,提供了全固态Li-S电池的基础概述,特别强调了质量传输、电化学动力学和热力学等关键反应工程原理。他们着重介绍了无量纲达姆科勒数,以阐明固态硫中的传输和动力学限制。此外,还重点介绍了冷冻电镜等先进表征技术,这些工具有助于弥补目前对全固态Li-S电池部署的理解差距。相关文章以“All-solid-state lithium–sulfur batteries through a reaction engineering lens”为题发表在Nature Chemical Engineering上。
研究背景
讨论全固态锂硫电池底层氧化还原机制的当前理解,与液态电解质锂硫电池进行比较,提供了一个基础概述。接下来,我们通过质量传输、电化学动力学和热力学等关键反应工程原理的视角,讨论了固态硫的电化学反应,提出全固态锂硫电池的氧化还原机制可能比目前所理解的要复杂得多。为了进一步支持这一观点,我们重点介绍了那些对固态硫有更深入理解的研究,并指出该领域尚未解决的关键问题。最后,我们强调了可以用来探测和阐明不同长度和时间尺度下固态硫转换机制的各种表征技术。本文的总体目标是激发新的想法,加速全固态锂硫电池技术的发展。特别是,我们希望鼓励研究从传统的“爱迪生式”方法转向基于对全固态锂硫电池底层氧化还原机制的基础理解的更系统和分析的方法。
图文导读
液态电解质与固态电解质锂硫电池 比能量密度分析
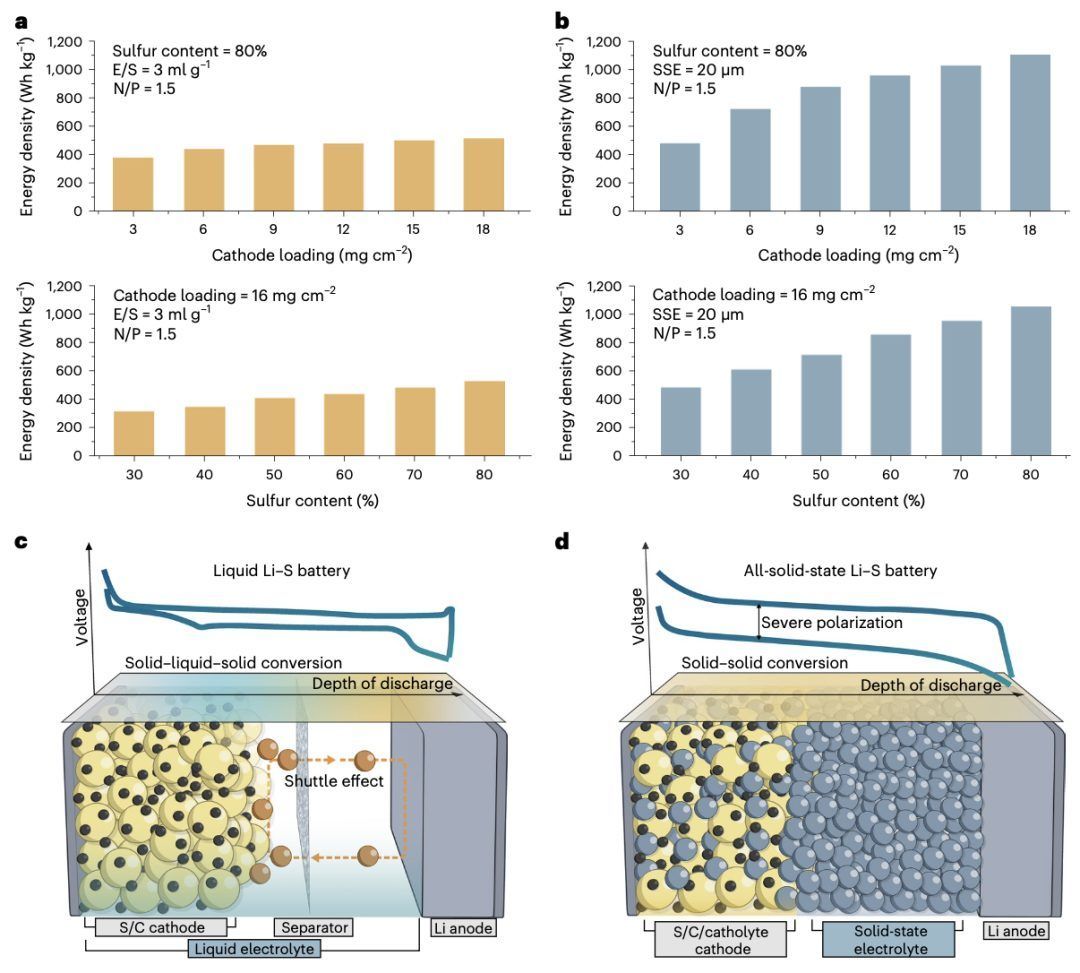 图1 | 比较液态锂硫电池和全固态锂硫电池
图1 | 比较液态锂硫电池和全固态锂硫电池
在过去的十年里,液态锂硫电池取得了长足进展,Lyten和Zeta Energy等初创公司正努力将这项技术商业化。相比之下,全固态锂硫电池技术仍处于起步阶段,尽管其在提供更高安全性和显著提高能量密度方面具有巨大潜力。虽然用不可燃固态电解质取代高可燃性的液态电解质的优势显而易见,但在全固态配置中能实现的更高能量密度的程度可能不那么明显。在这方面,我们使用关键性能参数(如硫含量和阴极负载)计算了液态和全固态锂硫电池在袋装电池配置中的比能量密度,以定量突出向全固态配置过渡的优势。在每种情况下,全固态锂硫电池的比能量密度都超过了其液态对应物。特别是当阴极负载为6毫克每平方厘米、硫含量为80重量百分比时,全固态锂硫电池提供的比能量密度接近743瓦时每公斤,在负载为18毫克每平方厘米时可高达1100瓦时每公斤,远远超过类似条件下的液态锂硫电池,并且也超过了世界各地倡议设定的约500瓦时每公斤的能量密度目标,如Battery500联盟(美国)、Battery2030+(欧洲)和日本新能源产业技术开发组织。实现高能量密度的关键因素在于全固态锂硫电池能够采用双极堆叠配置。这种配置使得多个电池可以在单个封装中串联堆叠,从而使一个电池的阳极和下一个电池的阴极可以使用单一的集电器。结果是,这最小化了非活性封装材料的使用,导致能量密度的增加。此外,固态电解质的重量比液态电解质低得多,这进一步提高了固态锂硫电池的能量密度。
反应途径和机制
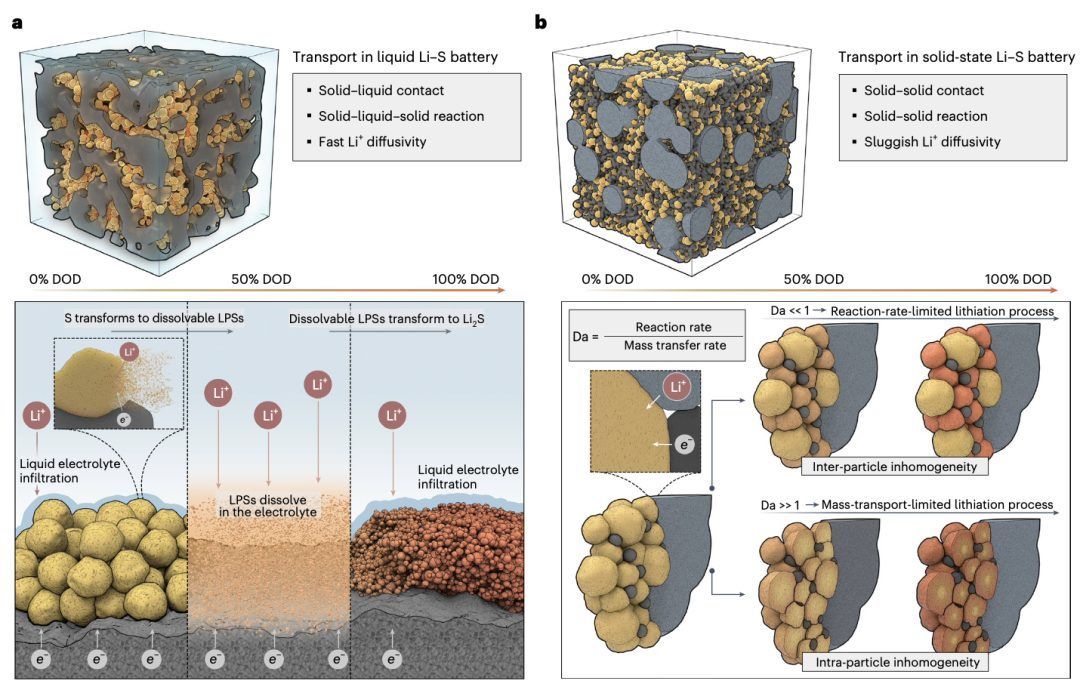 图2 | 比较液态电解质和固态电解质中硫在放电过程中的转化机制
图2 | 比较液态电解质和固态电解质中硫在放电过程中的转化机制
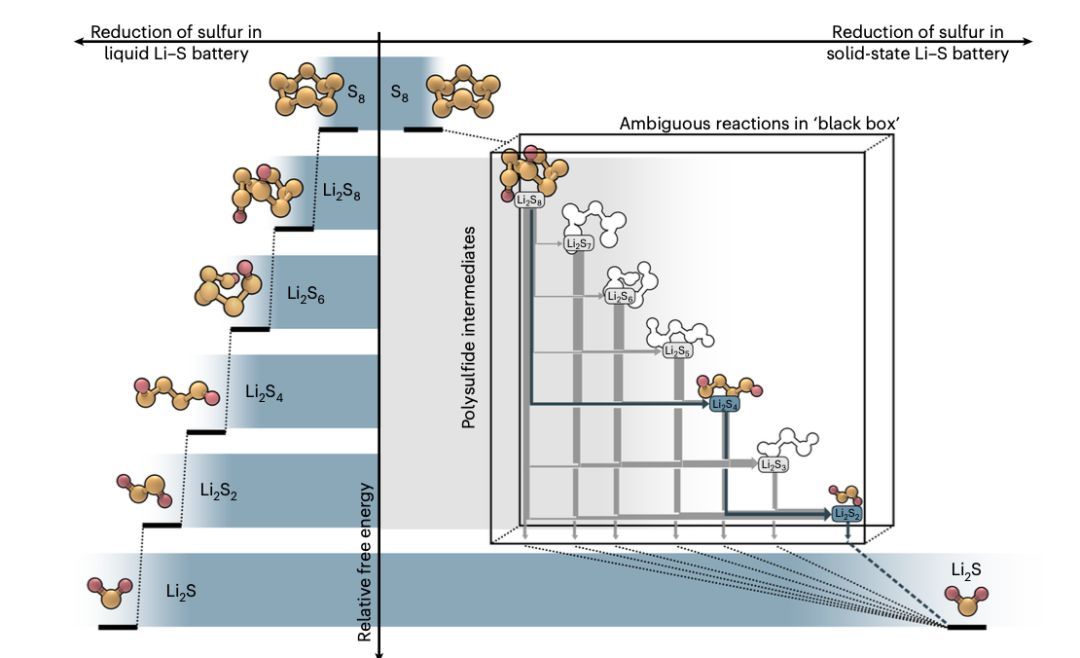 图3 | 映射液态和全固态配置中的硫转化路径
图3 | 映射液态和全固态配置中的硫转化路径
尽管液态和全固态锂硫电池的最终充放电状态(即S8和Li2S)相同,但硫达到热力学平衡的转换路径可能由于液态-固态和固态-固态界面上的质量传输和反应动力学的差异而有所不同。图3的左侧展示了液态锂硫电池中硫从S8转化为Li2S的简化模型,实际的转化机制要复杂得多,因为如Li2S6等多硫化物可以通过比例反应生成或消耗。目前,只有少数研究深入探讨了全固态锂硫电池的反应机制,因此固态硫的转化路径仍不清楚,特别是在放电过程中中间多硫化物的形成方面。尽
电化学动力学 放电产物
全固态锂硫电池的电化学行为在很大程度上受放电产物的影响,但这些产物的确切性质仍然难以捉摸。最初,认为Li2S是全固态锂硫电池的唯一放电产物。然而,最近的一项研究表明,放电产物实际上是未反应的S8、Li2S2和Li2S的混合物。后续的研究不仅进一步确认了Li2S2作为另一种放电产物的存在,还提供了关于它如何影响全固态锂硫电池电化学行为的有价值的见解。例如,发现通过促进以Li2S2为主要成分的放电产物的形成,可以提高全固态锂硫电池的初始放电容量、电化学可逆性和循环稳定性。主要由Li2S2组成的放电产物可以带来以下两个主要因素的性能提升:(1) 与Li2S相比,Li2S2在转化为S时的能量障碍较小,主要由于其较小的电子带隙(即较高的电子导电性),从而在硫复合电极中增强了电荷转移动力学;(2) Li2S2的体积膨胀较小,约为60%,相比之下,Li2S的膨胀约为80%。
充电产物
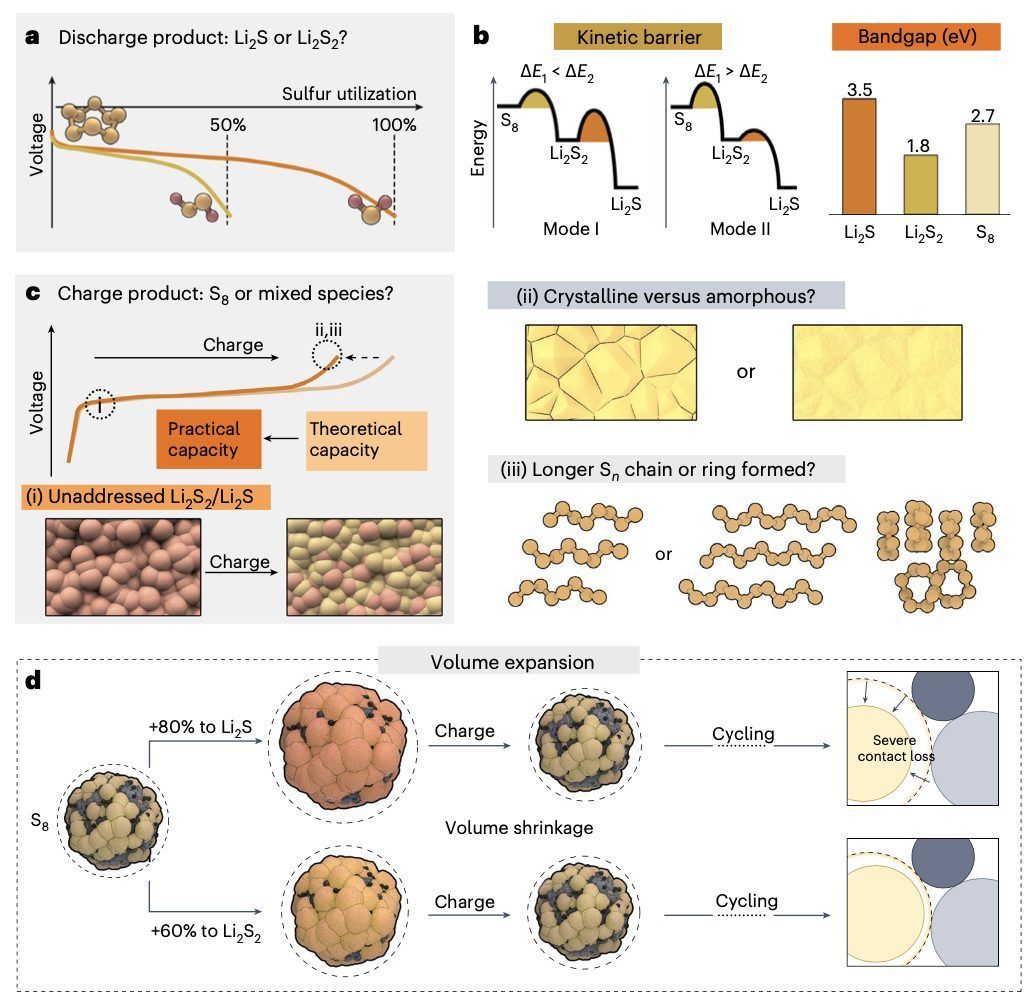 图4 | 全固态锂硫电池放电/充电产物的各种未解问题示意图
图4 | 全固态锂硫电池放电/充电产物的各种未解问题示意图
研究全固态锂硫电池的充电机制可以为其潜在的故障模式提供关键见解。然而,这一研究领域仍然大多未被探索。在理想情况下,放电后,S8应完全转化为Li2S,而在随后的充电过程中,Li2S应完全转化回S8。完全可逆的反应将在第一个循环中实现100%的转化效率,表明在充电过程中所有的Li2S都有效地转化回S8。然而,在典型的操作条件下,全固态锂硫电池的转化效率经常低于90%,正如几份之前的报告所示。低转化效率被归因于放电后Li2S2/Li2S的不可逆形成。然而,可能被忽视的另一个导致低转化效率的因素是充电产物不完全由S8组成;它们可能包含其他硫物种,如高阶多硫化物和部分或未反应的低阶多硫化物。此外,尚不清楚在随后的循环中S8环是否可以重新形成。 我们推测,可能会出现其他形式的硫,如线性或链状硫。一维硫链可以表现出金属行为,表明更全面地了解控制充电产物形成的底层过程可能为有意诱导具有更高导电性的链状硫结构提供策略。研究全固态锂硫电池在充电过程中的硫再结晶程度也可以为S8和Li2S之间转化的可逆性提供宝贵见解。例如,在液态锂硫电池中,发现充电循环后硫的再结晶高度依赖于复合阴极的制备方法。关于全固态锂硫电池充电产物的关键研究方向如图4c所示。
中间产物
在过去的十年中,大量文献致力于研究液态锂硫电池中的锂多硫化物,并对其状态和行为有了全面的了解,从而大大提高了电池性能。相比之下,尽管在液态中重要,几乎没有研究关注全固态锂硫电池中锂多硫化物的潜在存在。这一领域的研究缺乏可以归因于几个因素,包括硫物种的化学相似性和缺乏标准的锂多硫化物参考样品,这对其表征提出了挑战。然而,我们推测,导致这一研究差距的主要原因之一是忽视了全固态锂硫电池中锂多硫化物的潜在存在。值得注意的是,一些研究试图确定全固态锂硫电池中锂多硫化物的存在,但得出结论认为这些物种不存在。如果这些发现确实有效,那么为什么液态和固态下硫的氧化还原反应存在如此显著差异的问题仍然存在。 尽管如此,我们认为,进一步探讨锂多硫化物的潜在存在并确定其与性能的相关性仍然是全固态锂硫电池技术发展的重要且必要的工作。特别是,深入了解锂多硫化物物种可以为深度恒流循环过程中固态硫的演变提供关键见解。这些见解可以为设计新原则铺平道路,旨在增强硫复合电极中固态界面的耐久性,从而延长整体循环寿命。
全固态锂硫电池的表征工具
要揭示全固态锂硫电池底层的氧化还原机制,深入了解固态硫在质量传输、反应动力学和热力学等基础反应工程原理方面是至关重要的。在此,我们重点介绍了各种适合阐明固态硫动态转化机制的工具。中子成像,未来的研究将揭示固态硫的起始、生长和演变以及相异性如何影响整体电池行为。 了解全固态锂硫电池在非平衡条件下的氧化还原机制是至关重要的,因为多硫化物如Li2S8和Li2S2在循环过程中具有亚稳定性和不成比例反应。因此,使用非破坏性原位和操作表征技术是至关重要的,尤其是当多硫化物对空气敏感时,可能会在样品准备过程中影响其化学状态。在这方面,我们确定X射线吸收谱和拉曼光谱是两个强有力的工具,用于阐明固态硫的反应机制。X射线吸收谱是独特的,因为它可以探测特定元素的局部电子结构,从而提供关键见解,例如本地化学性质、氧化状态和特定硫物种的原子配位。拉曼光谱则非常适合探索固态硫的氧化还原机制,因为硫分子具有独特的振动和旋转模式,可以用来识别特定硫物种。然而,设计一种专用的操作单元,以在表征过程中保持高压并确保对环境的适当密封而不影响表征信号,提出了使用上述技术的巨大挑战。 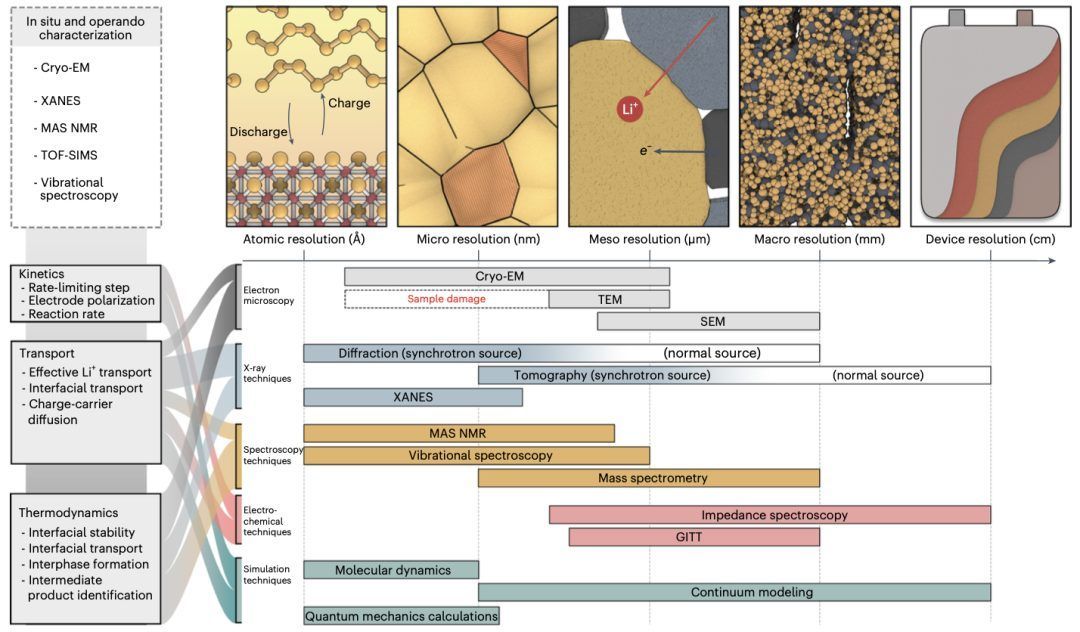 图5 | 全固态锂硫电池的表征工具
图5 | 全固态锂硫电池的表征工具
总结展望
了解固态硫的转化机制及其在循环过程中演变对于设计具有长循环寿命、高能量密度和快速充电能力的全固态锂硫电池至关重要。这需要对控制固态硫的底层氧化还原机制有深入的理解,特别是在化学工程及其核心原理,如热力学、动力学和质量传输方面。在这方面,深入理解全固态锂硫电池的底层氧化还原机制仍然是该领域的重大挑战。然而,本文认为,通过将全固态锂硫电池的氧化还原行为分为三个不同的类别(放电产物、充电产物和中间产物),并利用先进的表征工具(如cryo-EM),可以更好地理解固态硫在分子尺度上的转化机制。该项工作希望激发对全固态锂硫电池技术的新兴趣。对于那些已经深入参与该领域的研究人员,也希望本文的讨论能够成为推进全固态锂硫电池实际应用的催化剂。
文献信息
Kim, J. T., Su, H., Zhong, Y., Wang, C., Wu, H., Zhao, D., Wang, C., Sun, X., & Li, Y. (2024). All-solid-state lithium–sulfur batteries through a reaction engineering lens. Nature Chemical Engineering, 1, 400–410.




























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








